Плаквенил (Plaquenil®) инструкция по применению
📜 Инструкция по применению Плаквенил
💊 Состав препарата Плаквенил
✅ Применение препарата Плаквенил
📅 Условия хранения Плаквенил
⏳ Срок годности Плаквенил
Препарат отпускается по рецепту
Входит в список «Жизненно необходимых и важнейших лекарственных
препаратов»
Температура хранения: от 2 до 25 °С
Описание лекарственного препарата
Плаквенил
(Plaquenil®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2014
года, дата обновления: 2013.09.19
Владелец регистрационного удостоверения:
Контакты для обращений:
САНОФИ
Код ATX:
P01BA02
(Гидроксихлорохин)
Лекарственная форма
|
Препарат отпускается по рецепту |
Плаквенил |
Таблетки, покрытые пленочной оболочкой, 200 мг: 60 шт. рег. №: ЛП-(006044)-(РГ-RU) Предыдущий рег. №: П N015606/01 |
Форма выпуска, упаковка и состав
препарата Плаквенил
Таблетки, покрытые пленочной оболочкой белого цвета, круглые, двояковыпуклые, с гравировкой «HCQ» на одной стороне и «200» — на другой.
Вспомогательные вещества: лактозы моногидрат, повидон К25, крахмал кукурузный, магния стеарат, опадрай OY-L-28900 (гипромеллоза, макрогол 4000, титана диоксид (Е171), лактозы моногидрат).
10 шт. — блистеры (6) — пачки картонные.
Фармакологическое действие
Плаквенил обладает противомалярийными свойствами, а также оказывает противовоспалительное и иммунодепрессивное действие при хронической дискоидной или системной красной волчанке (СКВ), остром и хроническом ревматоидном артрите. Механизм его действия при малярии, СКВ и ревматоидном артрите до конца не известен.
Гидроксихлорохин обладает свойствами умеренного иммуносупрессора, подавляя синтез ревматоидного фактора и компонентов реакции острой фазы. Он также накапливается в лейкоцитах, стабилизируя лизосомальные мембраны, и подавляет активность многих ферментов, в т.ч. коллагеназы и протеаз, которые вызывают распад хряща.
Эффективность при СКВ и ревматоидном артрите связана со следующими противовоспалительными и иммуномодулирующими эффектами гидроксихлорохина:
- повышение внутриклеточного рН приводит к замедлению антигенного ответа и уменьшает связывание пептидов рецепторов главного комплекса гистосовместимости (ГКГ); меньшее количество рецепторов антиген-ГКГ достигает поверхности клетки, что приводит к снижению аутоиммунного ответа;
- снижение активности фосфолипазы А2 при высоких концентрациях, лизосомальных ферментов;
- снижение концентраций цитокинов ИЛ-1 и ИЛ-6, ведущее к уменьшению клинических и лабораторных показателей аутоиммунного ответа; т.к. отсутствует нарушение синтеза интерферона гамма, эти эффекты могут быть связаны с селективным воздействием на цитокины;
- ингибирование пре- и/или посттранскрипции ДНК и РНК.
Препарат активно подавляет бесполые эритроцитарные формы, а также гаметы Plasmodium vivax и Plasmodium malariae, которые исчезают из крови почти одновременно с бесполыми формами. Плаквенил не действует на гаметы Plasmodium falciparum. Не эффективен в отношении резистентных к хлорохину штаммов Plasmodium falciparum, а также не активен в отношении внеэритроцитарных форм Plasmodium vivax, Plasmodium malariae и Plasmodium ovale и поэтому не может предупредить заражение этими микроорганизмами при назначении в профилактических целях, а также не способен предотвратить рецидив заболевания, вызванного этими возбудителями.
Фармакокинетика
Всасывание
После приема внутрь гидроксихлорохин быстро и почти полностью всасывается из ЖКТ. У здоровых добровольцев после однократной дозы 400 мг Cmax гидроксихлорохина в плазме крови достигалась через 1.83 ч и колебалась от 53 до 208 нг/мл.
Распределение
Связывание с белками плазмы — 45%.
Неизмененный препарат и его метаболиты хорошо распределяются в организме. Vd составляет 5-10 л/кг. Гидроксихлорохин накапливается в тканях с высоким уровнем обмена — в печени, почках, легких, селезенке (в этих органах концентрация превышает плазменную в 200-700 раз), в ЦНС, эритроцитах, лейкоцитах, а также в сетчатке глаза и тканях, богатых меланином.
Гидроксихлорохин проникает через плацентарный барьер, в незначительных количествах обнаруживается в грудном молоке.
Метаболизм
В печени гидроксихлорохин частично превращается в активные этилированные метаболиты.
Выведение
Среднее значение T1/2 из плазмы варьирует в зависимости от времени, прошедшего после приема препарата следующим образом: 5.9 ч (от достижения Cmax до 10 ч), 26.1 ч (от 10 до 48 ч) и 299 ч (от 48 до 504 ч).
Гидроксихлорохин и его метаболиты выводятся в основном с мочой и в меньшей степени с желчью. Выведение препарата медленное, терминальный T1/2 составляет около 50 дней (из цельной крови) и 32 дня (из плазмы). За 24 ч с мочой выводится 3% от введенной дозы препарата.
Показания препарата
Плаквенил
- ревматоидный артрит;
- ювенильный ревматоидный артрит;
- системная красная волчанка;
- дискоидная красная волчанка.
Малярия (за исключением хлорохин-резистентных штаммов Plasmodium falciparum):
- для профилактики и лечения острых приступов малярии, вызванной Plasmodium vivax, Plasmodium ovale и Plasmodium malariae, а также чувствительными штаммами Plasmodium falciparum;
- для радикального лечения малярии, вызванной чувствительными штаммами Plasmodium falciparum.
Режим дозирования
Плаквенил предназначен только для перорального применения. Препарат принимают во время еды или со стаканом молока.
Все дозы препарата приведены из расчета на гидроксихлорохин сульфат и не эквивалентны дозам основания.
Лечение ревматоидного артрита
Гидроксихлорохин обладает кумулятивной активностью. Для проявления его терапевтического действия необходимо несколько недель приема препарата, в то время как побочные эффекты могут проявляться относительно рано. Необходимый терапевтический эффект развивается после нескольких месяцев приема препарата. В случае отсутствия объективного улучшения в состоянии больного в течение 6 месяцев приема гидроксихлорохина, применение препарата следует прекратить.
Взрослым (включая лиц пожилого возраста) препарат назначают в минимальной эффективной дозе. Доза не должна превышать 6.5 мг/кг массы тела в сут (рассчитывается по идеальной, а не по реальной массе тела) и могут составлять или 200 мг, или 400 мг/сут.
У пациентов, способных принимать 400 мг ежедневно, начальная доза — по 400 мг ежедневно в несколько приемов. При достижении очевидного улучшения состояния доза может быть снижена до 200 мг. При уменьшении эффективности поддерживающая доза может быть увеличена до 400 мг.
Детям препарат назначают в минимальной эффективной дозе. Доза не должна превышать 6.5 мг/кг массы тела (исходя из идеальной массы тела), поэтому для детей с массой тела менее 31 кг не предназначены таблетки 200 мг.
Применение Плаквенила в комбинации с ГКС, салицилатами, НПВС, метотрексатом и другими терапевтическими средствами второго ряда является безопасным. После нескольких недель применения Плаквенила дозы ГКС и салицилатов могут быть уменьшены или может быть прекращен прием этих препаратов. Дозы ГКС следует снижать постепенно каждые 4-5 дней: доза кортизона — не более чем на 5-15 мг, доза гидрокортизона — не более чем на 5-10 мг, доза преднизолона и преднизона — не более чем на 1-2.5 мг, доза метилпреднизолона и триамцинолона — не более чем на 1-2 мг и дексаметазона — не более чем на 0.25-0.5 мг.
Лечение системной красной волчанки
Взрослым назначают в начальной средней дозе 400 мг 1-2 раза/сут в течение нескольких недель или месяцев в зависимости от реакции пациента. Для продолжительной поддерживающей терапии, достаточно применение препарата в меньшей дозе от 200 до 400 мг.
Лечение малярии
С целью профилактики острых приступов малярии, вызванных Plasmodium malariae, и чувствительными штаммами Plasmodium falciparum взрослым препарат назначают в дозе 400 мг еженедельно в один и тот же день недели. Для детей еженедельная доза составляет 6.5 мг/кг (для расчета берется идеальная масса тела), однако вне зависимости от массы тела доза для детей не должна превышать дозу для взрослых.
Если условия позволяют, то профилактическую терапию следует начинать за 2 недели до въезда в эндемичную зону. Если это невозможно, то можно назначить начальную двойную (нагрузочную) дозу: взрослым — 800 мг, детям — 12.9 мг/кг идеальной массы тела (но не более 800 мг), разделенную на два приема с 6-часовым интервалом. Профилактическое лечение следует продолжать в течение 8 недель после выезда из эндемичной зоны.
Для лечения острых приступов малярии взрослым препарат назначают в дозе 800 мг, затем через 6-8 ч — 400 мг, затем в 2 последующих дня — по 400 мг (в общей сложности 2 г гидроксихлорохина сульфата).
Альтернативный способ лечения: была доказана также эффективность однократного приема в дозе 800 мг.
Доза для взрослых так же, как и для детей, может быть рассчитана с учетом идеальной массы тела.
Детям препарат назначают в общей дозе 32 мг/кг (но не более 2 г) в течение 3 дней по следующей схеме:
первая доза – 12.9 мг/кг (не более однократной дозы 800 мг);
вторая доза – 6.5 мг/кг (не более 400 мг) через 6 ч после первой дозы;
третья доза – 6.5 мг/кг (не более 400 мг) через 18 ч после второй дозы;
четвертая доза – 6.5 мг/кг (не более 400 мг) через 24 ч после третьей дозы.
Для радикального лечения малярии, вызванной Plasmodium malariae и Plasmodium vivax, необходим одновременный прием производных 8-аминохинолона.
Побочное действие
Со стороны органа зрения: редко — ретинопатия с изменениями в пигментации и дефектами полей зрения. В ранней форме ретинопатия обратима при прекращении курса лечения гидроксихлорохином. Если ретинопатия сохраняется, то может возникнуть риск необратимого поражения сетчатки даже после отмены лечения. Изменения сетчатки вначале могут быть бессимптомными, или проявляться скотомой парацентрального или перицентрального типов, преходящей скотомой, нарушением цветового зрения.
Возможны изменения роговицы, включая отек и помутнение. Они могут быть бессимптомными или вызывать такие нарушения, как появление ореолов, нечеткости зрения или фотофобии. Эти изменения могут быть обратимыми при прекращении лечения.
Возможно снижение зрения из-за нарушения аккомодации, которое зависит от дозы и является обратимым.
Дерматологические реакции: возможны кожные высыпания, зуд, изменения пигментации кожи и слизистых оболочек, обесцвечивание волос и алопеция. Эти реакции обычно быстро проходят при прекращении лечения.
Сообщалось о развитии буллезной сыпи, включая очень редкие случаи многоформной эритемы и синдрома Стивенса-Джонсона, фоточувствительности и отдельных случаев эксфолиативного дерматита.
Очень редкие случаи острого генерализованного экзантематозного пустулеза (ОГЭП) необходимо отличать от псориаза, хотя гидроксихлорохин и может провоцировать обострение псориаза. ОГЭП может сопровождаться повышением температуры и гиперлейкоцитозом. После отмены препарата исход обычно благоприятный.
Со стороны пищеварительной системы: тошнота, диарея, анорексия, боли в области живота; редко — рвота. Эти реакции обычно проходят сразу же после снижения дозы или прекращения лечения. При длительном применении и в высоких дозах возможна гепатотоксичность. В отдельных случаях — нарушения функции печени; в единичных случаях — внезапно развившаяся печеночная недостаточность.
Со стороны ЦНС и периферической нервной системы: иногда — головокружение, шум в ушах, потеря слуха, головная боль, раздражительность, эмоциональная неустойчивость, психозы, судороги, мышечная слабость, атаксия; в отдельных случаях — миопатия скелетных мышц или нейромиопатия, ведущие к прогрессирующей слабости и атрофии проксимальных групп мышц. Миопатия может быть обратимой после отмены препарата, но для полного восстановления может потребоваться несколько месяцев. Возможны слабые сенсорные изменения, подавление сухожильного рефлекса и снижение нервной проводимости.
Со стороны сердечно-сосудистой системы: редко — кардиомиопатия. В случае обнаружения нарушений проводимости (блокада ножек пучка Гиса/AV-блокада) или гипертрофии миокарда обоих желудочков следует иметь в виду возможность хронической кардиотоксичности (в эти ситуациях требуется отмена препарата). После отмены препарата возможно обратное развитие этих изменений.
Со стороны системы кроветворения: редко — угнетение костномозгового кроветворения; в отдельных случаях — анемия, апластическая анемия, агранулоцитоз, лейкопения, тромбоцитопения.
Со стороны обмена веществ: гидроксихлорохин может провоцировать или вызывать обострение порфирии.
Аллергические реакции: крапивница, ангионевротический отек, бронхоспазм.
Противопоказания к применению
- ретинопатия;
- детский возраст — при необходимости длительной терапии (у детей имеется повышенный риск развития токсических эффектов);
- детский возраст до 6 лет (таблетки по 200 мг не предназначены для детей с идеальной массой тела менее 31 кг);
- беременность;
- наследственная непереносимость лактозы, недостаточность лактазы, галактоземия или синдром мальабсорбции глюкозы/галактозы (из-за присутствия в составе препарата лактозы);
- повышенная чувствительность к производным 4-аминохинолина.
С осторожностью следует применять препарат при зрительных расстройствах (снижение остроты зрения, нарушение цветового зрения, сужение полей зрения), одновременном приеме препаратов, способных вызывать неблагоприятные офтальмологические реакции (опасность прогрессирования ретинопатии и зрительных расстройств); при гематологических заболеваниях (в т.ч. в анамнезе); при тяжелых неврологических заболеваниях, психозах (в т.ч. в анамнезе); при поздней кожной порфирии (риск обострения), псориазе (риск усиления кожных проявлений заболевания), одновременном приеме препаратов, способных вызывать кожные реакции; при почечной недостаточности и/или печеночной недостаточности, гепатите, одновременном приеме препаратов, способных неблагоприятно влиять на функцию печени и/или почек (при тяжелых нарушениях функции почек или печени дозу следует подбирать под контролем концентрации гидроксихлорохина в плазме); при дефиците глюкозо-6-фосфатдегидрогеназы; при тяжелых желудочно-кишечных заболеваниях; при гиперчувствительности к хинину (возможность перекрестных аллергических реакций).
Применение при беременности и кормлении грудью
Данные о применении препарата при беременности ограничены. Гидроксихлорохин проникает через плацентарный барьер. Следует отметить, что 4-аминохинолины в терапевтических дозах могут вызывать внутриутробные повреждения ЦНС, в т.ч. слухового нерва (нарушения со стороны слуха и вестибулярного аппарата, врожденная глухота), кровоизлияния в сетчатку глаза и аномальную пигментацию сетчатки. Поэтому следует избегать применения гидроксихлорохина при беременности, за исключением случаев, когда потенциальная польза терапии для матери превышает риск для плода.
Следует тщательно взвесить необходимость применения препарата в период лактации (грудного вскармливания), т.к. показано, что гидроксихлорохин в небольших количествах выделяется с грудным молоком, а также известно, что грудные дети особенно чувствительны к токсическим эффектам 4-аминохинолинов.
Применение при нарушениях функции печени
С осторожностью следует применять препарат при печеночной недостаточности.
Применение при нарушениях функции почек
С осторожностью следует применять препарат при почечной недостаточности.
Применение у детей
Противопоказание: детский возраст — при необходимости длительной терапии (у детей имеется повышенный риск развития токсических эффектов); детский возраст до 6 лет (таблетки по 200 мг не предназначены для детей с идеальной массой тела менее 31 кг).
Применение у пожилых пациентов
У пожилых пациентов препарат используется в тех же дозировках, что и у взрослых.
Особые указания
Токсическое воздействие на сетчатку является в значительной степени дозозависимым. Частота возникновения ретинопатии при применении препарата в дозах до 6.5 мг/кг идеальной массы тела является небольшой. Превышение рекомендованной суточной дозы резко увеличивает риск развития ретинопатии и ускоряет ее появление.
Перед началом длительного курса лечения препаратом следует провести тщательное обследование обоих глаз. Обследование должно включать определение остроты зрения, осмотр глазного дна, оценку цветового зрения и полей зрения. Во время терапии такое обследование должно проводиться не реже 1 раза в 6 месяцев.
Более частое обследование следует проводить в следующих случаях:
- суточная доза, превышающая 6.5 мг/кг идеальной массы тела (при расчете дозы с учетом абсолютной массы тела возможна передозировка у тучных пациентов);
- почечная недостаточность;
- суммарная доза более 200 г;
- пациенты пожилого возраста;
- сниженная острота зрения.
При возникновении любых зрительных расстройств (снижение остроты зрения, изменение цветового зрения) препарат следует немедленно отменить и обеспечить тщательное наблюдение за состоянием зрения пациента, т.к. изменения сетчатки (и зрительные расстройства) могут прогрессировать даже после отмены препарата.
С осторожностью рекомендуется применять препарат у пациентов с заболеваниями печени и почек. При тяжелых нарушениях функции почек или печени доза должна подбираться под контролем плазменных концентраций гидроксихлорохина.
Поскольку препарат влияет на функции печени и почек, может потребоваться снижение дозы.
При длительной терапии следует периодически проводить полный анализ крови, при появлении гематологических нарушений гидроксихлорохин следует отменить.
Дети особенно чувствительны к токсическим эффектам 4-аминохинолинов, поэтому пациенты должны особо тщательно следить за тем, чтобы убирать гидроксихлорохин из мест, доступных для детей.
Все больные, длительно получающие препарат, должны периодически обследоваться у невролога в отношении функций скелетных мышц и выраженности сухожильного рефлекса. Если наблюдается мышечная слабость, препарат следует отменить.
Плаквенил не эффективен в отношении хлорохин-резистентных штаммов Plasmodium falciparum, а также неактивен в отношении внеэритроцитных форм Plasmodium vivax, Plasmodium ovale и Plasmodium malariae и поэтому не может предупредить инфицирование этими микроорганизмами при его назначении с целью профилактики острых приступов малярии, а также не может предотвратить рецидив заболевания, вызванного этими возбудителями.
Влияние на способность к управлению транспортными средствами и механизмами
Пациенты должны соблюдать осторожность при вождении транспорта или выполнении работ, требующих повышенного внимания, т.к. гидроксихлорохин может нарушать аккомодацию и нарушать четкость зрительного восприятия. Если это состояние не проходит само по себе, то дозу препарата можно временно уменьшить.
Передозировка
Передозировка 4-аминохинолинов особенно опасна у детей, даже при применении препарата в дозе 1-2 г возможен летальный исход.
Симптомы: головная боль, нарушения зрения, коллапс, судороги, гипокалиемия, нарушения ритма и проводимости, за которыми следует остановка сердца и дыхания. Т.к. эти эффекты могут развиться сразу же после принятия чрезмерной дозы препарата, требуется проведение неотложной терапии. Следует немедленно принять меры для удаления препарата из желудка (искусственно вызвать рвоту или провести промывание желудка), назначить активированный уголь в дозе, как минимум в 5 раз превышающей принятую дозу препарата. Целесообразно назначение диазепама парентерально (описано снижение кардиотоксичности хлорохина на его фоне).
Лечение: при необходимости следует проводить ИВЛ и противошоковую терапию. Необходим постоянный врачебный контроль в течение не менее 6 ч после купирования симптомов передозировки.
Лекарственное взаимодействие
При одновременном применении гидроксихлорохина и дигоксина возможно повышение концентрации дигоксина в сыворотке (при данной комбинации следует необходимо снижать дозу дигоксина под контролем плазменных концентраций дигоксина).
Поскольку гидроксихлорохин может усиливать эффекты гипогликемических препаратов, в начале приема гидроксихлорохина может потребоваться уменьшение дозы инсулина или гипогликемических препаратов.
При одновременном применении антацидов интервал между приемами должен составлять не менее 4 ч, т.к. возможно снижение абсорбции гидроксихлорохина.
При применении гидроксихлорохина также нельзя исключить перечисленного ниже лекарственного взаимодействия, которое было описано для хлорохина, но не наблюдалось при приеме гидроксихлорохина.
При одновременном применении с антибиотиками группы аминогликозидов происходит потенцирование угнетающего действия на нервно-мышечную передачу.
Циметидин подавляет метаболизм противомалярийных препаратов, что может привести к повышению их концентраций в плазме крови, что увеличивает риск развития побочных эффектов, особенно токсических.
Хлорохин проявляет антагонизм действия в отношении неостигмина и пиридостигмина.
На фоне применения хлорохина наблюдается уменьшение образования антител в ответ на первичную иммунизацию внутрикожной человеческой диплоидно-клеточной вакциной против бешенства.
Условия хранения препарата Плаквенил
Список Б. Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Срок годности препарата Плаквенил
Условия реализации
Препарат отпускается по рецепту.
САНОФИ
|
Представительство |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Методы лечения ревматоидного артрита: базисная терапия, противовоспалительные средства разных групп, методы физического и механического воздействия на иммунную систему, местное лечение, физиотерапевтическое лечение, диета.
Основным средством лечения ревматоидного артрита считаются так называемые базисные препараты. Поэтому именно с базисных препаратов мы начнем наш разговор о методах лечения артрита.
Считается, что базисные препараты воздействуют на основание болезни, ее «базис». Применяются эти средства с прицелом на будущее, в расчете на их способность прерывать развитие заболевания. Но нужно иметь в виду, что в отличие от противовоспалительных средств и гормонов, базисные препараты не дают сиюминутного положительного эффекта, то есть они не устраняют симптомов болезни в первые дни и недели их применения. Как правило, базисные препараты способны подействовать не раньше, чем через месяц, — и в этом их существенный недостаток.
Кроме того, практически ни один базисный препарат не способен дать гарантированного стопроцентного результата. То есть притормаживают развитие артрита и со временем дают улучшение многие из базисных препаратов, но насколько выраженным будет это улучшение, не сможет заранее предсказать ни один, даже самый многоопытный ревматолог. Потому правильный подбор базисной терапии во многом зависит не только от опыта врача, но и от его интуиции. Тем не менее свои характерные достоинства и недостатки есть у любого базисного препарата, и о них мы сейчас побеседуем.
Базисная терапия ревматоидного артрита
В настоящее время в качестве базисной терапии используют чаще всего препараты трёх групп: соли золота, антималярийные лекарства, и антимикробный препарат сульфасалазин.
1. Цитостатики (иммунодепрессанты).
Цитостатические препараты, или так называемые иммунодепрессанты (метотрексат, арава, ремикейд, азатиоприн, циклофосфан, хлорбутин, циклоспорин, и другие), были заимствованы ревматологами у онкологов. По мнению большинства современных ревматологов цитостатики — лучшая группа базисных препаратов для лечения не только ревматоидного, но и псориатического артрита.
В онкологии эти препараты применяются для торможения деления клеток, в том числе раковых. Причем онкологическим больным цитостатики назначаются в огромных дозах, что приводит к большому количеству осложнений. В связи с этим и врачи, и больные очень настороженно относятся к применению цитостатиков, опасаясь тяжелых побочных эффектов.
Однако когда речь идет о применении этих препаратов в лечении артрита, опасность явно преувеличивается, ведь в артрологии цитостатики используются в значительно меньших дозах, чем в онкологии. Дозы цитостатиков при лечении артритов примерно в 5-20 раз меньше доз, используемых при лечении опухолей!
Такие небольшие количества иммунодепрессантов редко вызывают побочное действие, а вот терапевтический эффект чаще всего бывает значительным. Использование цитостатиков помогает, как минимум, 70-80% больных, причем наибольшую пользу лекарства приносят страдающим быстро прогрессирующей тяжелой формой ревматоидного артрита.
Побочные явления возможны у 15-20% пациентов и редко бывают тяжелыми. Чаще всего это аллергические сыпи, ощущение «мурашек» на коже, расстройство стула и умеренные нарушения мочеиспускания. Все эти проявления обычно исчезают сразу после отмены препаратов. Другие побочные эффекты, о которых можно узнать из аннотации к препаратам, случаются при приеме «противоартритных доз» цитостатиков нечасто.
Тем не менее, во избежание осложнений, необходимо контролировать состояние больного, принимающего иммунодепрессанты. Раз в месяц нужно исследовать мочу, и главное — раз в две недели делать анализ крови, взятой из пальца, чтобы вовремя заметить возможное угнетение кроветворения. Раз в три месяца необходимо проверять «печеночные показатели» в крови, взятой из вены. Если же все в порядке и пациент легко переносит цитостатическую терапию, можно ждать явного улучшения самочувствия уже через 2–4 недели после начала лечения.
В настоящее время ревматологи чаще всего используют для лечения ревматоидного артрита 3 цитостатических препарата:
Метотрексат — пожалуй, лучший из лучших базисных препаратов для лечения ревматоидного и псориатического артритов. На сегодняшний день он считается «препаратом выбора» при этих заболеваниях. Для базисного лечения ревматоидного артрита метотрексат принимают только 1 раз (по 10-20 мг) в неделю.
В первый раз выбирают конкретный день, скажем, понедельник, и с этих пор на протяжении всего курса лечения метотрексат принимают только по понедельникам. Терапевтический эффект обычно проявляется через 5-6 недель от начала приема метотрексата и достигает максимума обычно за полгода-год.
Внимание! В день приема метотрексата желательно обойтись без употребления нестероидных противовоспалительных препаратов. Во все остальные дни противовоспалительные препараты можно использовать смело.
Арава, или лефлуномид. Считается, что по эффективности и переносимости арава не уступает метотрексату и сульфасалазину. Хотя по моим наблюдениям, она все-таки переносится несколько хуже метотрексата.
В целом арава рекомендуется больным, у которых артрит протекает очень активно, и тем, кто плохо переносит метотрексат. А еще араву иногда назначают тем пациентам, которым метотрексат помогает слабо — поскольку бывает так, что порой арава помогает больным, для которых метотрексат оказался неэффективным (и наоборот, часто бывает так, что метотрексат пациенту помогает хорошо, а арава — нет).
Терапевтический эффект обычно проявляется через 4-6 недель от начала приема аравы и может нарастать в течение 4-6 месяцев.
Ремикейд, он же инфликсимаб, и препараты схожего действия. Новый быстродействующий и довольно эффективный базисный препарат.
Его применяют в тех случаях, когда другие базисные препараты, в частности метотрексат, не дают должного эффекта. А еще ремикейд применяют в тех случаях, когда необходимо снизить дозу принимаемых кортикостероидных гормонов, или при очень высокой активности артрита.
К сожалению, ремикейд пока весьма дорого стоит. Тем не менее, несмотря на высокую стоимость, применение ремикейда потихоньку набирает обороты — в силу того, что ремикейд действует быстрее многих других базисных препаратов.
Однако применять ремикейд надо с большой осторожностью. Очень часто он переносится больными тяжелее, чем арава или метотрексат, и чаще дает побочные эффекты.
До начала лечения ремикейдом необходимо выявить и пролечить все имеющиеся у пациента инфекции, в том числе скрытые, и пролечить все абсцессы. Ведь если этого не сделать, применение ремикейда может спровоцировать сильнейшее обострение недолеченных инфекционных процессов вплоть до развития сепсиса.
Кроме того, во время лечения ремикейдом рекомендуется применять антиаллергические препараты, чтобы предотвратить возможные аллергические реакции (они бывают довольно часто).
Еще во время лечения необходимо использовать надежные методы контрацепции, чтобы не допустить возникновения беременности — ремикейд категорически противопоказан беременным, а также кормящим матерям (на время терапии следует воздержаться от кормления грудью). Грудное вскармливание разрешается не ранее, чем через 6 месяцев после окончания лечения ремикейдом!
* * *
Другие цитостатические препараты, такие как азатиоприн (имуран), хлорбутин, циклофосфан (эндоксан) и циклоспорин (имуспорин, консупрен, сандиммун, экорал), при ревматоидном артрите применяются редко, поскольку они переносятся пациентами гораздо тяжелее, чем метотрексат, арава и ремикейд и гораздо чаще дают различные побочные эффекты. Из-за «тяжести» перечисленных препаратов, из-за их плохой переносимости и высокой частоты побочных эффектов, эти лекарства применяют только в крайних случаях, при неэффективности остальных базисных препаратов.
2. Антималярийные препараты (делагил и плаквенил).
Антималярийные препараты делагил (он же хлорохин, резохин, хингамин) и плаквенил (он же гидроксихлорохин, гидрохлорин) с давних пор использовались инфекционистами для лечения тропической лихорадки (малярии).
Однако в XX в. на них обратили внимание и ревматологи. Они заметили, что при очень длительном применении делагил и плаквенил способны влиять на активность ревматоидного процесса, постепенно уменьшая воспаление в суставах.
К сожалению, со временем выяснилось, что эти препараты действуют очень медленно: лечебный эффект развивается только спустя полгода — год непрерывного приема лекарства. Эффективность делагила и плаквенила тоже оказалась невысокой. Это одни из самых слабых из всех современных базисных препаратов.
Но у них есть важное достоинство — хорошая переносимость и малое количество побочных эффектов.
Хотя эффективность этих препаратов не очень велика и действуют они медленно, мы вынуждены использовать их и поныне, поскольку ощущаем относительный дефицит антиревматоидных средств.
Ведь иногда возникают ситуации, когда другие базисные средства безуспешно перепробованы и отменены из-за неэффективности или выраженного побочного действия. Тогда-то и приходится использовать пусть слабые, но все же обладающие специфическим антиартритным действием делагил и плаквенил.
По мнению большинства ведущих современных ревматологов, базисную терапию нужно начинать с антималярийных средств только тогда, когда ревматоидный артрит протекает очень мягко, и нет необходимости в более сильных лекарствах, обладающих лучшим лечебным действием, но способных провоцировать многочисленные побочные эффекты.
Ведь в отличие от них антималярийные препараты практически безвредны. Лишь в редких случаях при длительном применении делагил или плаквенил могут провоцировать развитие побочных реакций.
3. Сульфаниламиды (сульфасалазин и салазопиридазин).
Сульфасалазин и салазопиридазин — антимикробные препараты, успешно применяемые в базисной терапии ревматоидного артрита. По силе лечебного действия сульфаниламиды совсем немного уступают препаратам золота и метотрексату, вполне сопоставимы по эффективности с Д-пеницилламином, и явно превосходят по силе действия такие препараты, как делагил и плаквенил.
Главным преимуществом сульфаниламидов перед остальными базисными препаратами является их хорошая переносимость — сульфасалазин и салазопиридазин почти не дают осложнений даже при долгом применении.
При длительном приеме побочные эффекты развиваются только у 10-20% больных, и эти побочные эффекты практически никогда не бывают тяжелыми.
Умаляет достоинства сульфаниламидных препаратов лишь медленное развитие их лечебного эффекта. Некоторое улучшение состояния при лечении сульфаниламидами обычно отмечается лишь после трех месяцев терапии, а «пик формы» достигается спустя 6-12 месяцев от начала лечения.
* * *
Итак, существует 3 основных группы базисных препаратов для борьбы с ревматоидным артритом. Все они имеют свои достоинства, и, к сожалению, свои недостатки, которые мы только что рассмотрели. Самый частый вопрос, который задают пациенты по поводу базисной терапии и который нередко обсуждается больными в Интернете, касается потенциальной вредности базисных препаратов.
Так, один из самодеятельных «специалистов», явно не разбирающийся в проблеме, с возмущением заявил на одном из Интернет-форумов: «Что же за лекарства такие назначают врачи, если они имеют столько побочных эффектов — одно лечат, другое калечат?»
Вот уж действительно, до чего велико желание некоторых недалеких людей видеть во всем чуть ли не заговор врачей. Но может они правы, и нам действительно не нужно назначать пациенту никаких лекарств вообще, и базисных препаратов в частности? Пусть себе болеет и мучается?
Если отбросить досужие измышления недалеких критиков, факты выглядят так: по многочисленным наблюдениям ученых и врачей (и по моим наблюдениям тоже), чем позже больному назначают базисную терапию, тем для него хуже — болезнь протекает гораздо тяжелее, с многочисленными осложнениями, и чаще заканчивается фатальным исходом. И наоборот, если базисные препараты назначены пациенту вовремя, в первые месяцы болезни, нам часто удается добиться существенного улучшения самочувствия больного, а иногда получается даже и вовсе прервать развитие болезни.
Хотя, безусловно, подбор базисной терапии — дело серьезное. И мы обязаны учитывать возможность развития побочных эффектов. А потому лечащий врач, как говорится, должен постоянно держать «руку на пульсе» и регулярно контролировать состояние пациента.
Еще желательно, чтобы пациент был максимально информирован о том, какие осложнения может вызвать принимаемое лекарство, и сообщал врачу о любых настораживающих реакциях. Именно с целью дать вам максимум информации о принимаемых лекарствах и их возможных побочных реакциях я и писал эту главу.
Но все же: какой базисный препарат предпочесть в каждом конкретном случае? Вот на этот вопрос может ответить только ваш лечащий ревматолог. Только он знает (во всяком случае, должен знать), когда и какое базисное средство следует применить для того или иного пациента.
Хотя недостаток базисных средств как раз в том и состоит, что врачам бывает трудно со стопроцентной вероятностью угадать, даст ли лекарство должный терапевтический эффект. Ответ на этот вопрос можно получить только через месяц-другой от начала применения препарата. И если препарат не действует, то приходится его менять и снова пару месяцев ждать результата.
Таким образом, на подбор базисной терапии порой уходит от 4 до 6 месяцев. Срок, безусловно, чрезвычайно долгий для болеющего человека, но приходится смиряться — другого выбора у нас нет. Но мы можем попытаться улучшить состояние пациента на этот «срок ожидания» с помощью методов физического и механического воздействия на иммунную систему, с помощью противовоспалительных средств, и с помощью местного воздействия на суставы. О них разговор пойдет дальше.
Противовоспалительные средства разных групп
1. Нестероидные противовоспалительные препараты (НПВП).
Как средство первой помощи при суставных болях чаще всего используют «классические» нестероидные противовоспалительные препараты — диклофенак, ибупрофен, кетопрофен, пироксикам, индометацин, мовалис, бутадион и др. Нестероидные противовоспалительные препараты при ревматоидном артрите эффективно снижают воспаление в суставах и уменьшают болевые ощущения.
Без сомнения, эти препараты способны существенно облегчить жизнь больного, но вылечить ревматоидный артрит с помощью нестероидных противовоспалительных препаратов невозможно. Их применяют не для того, чтобы вылечить артрит, а для временного снижения воспаления и боли в суставе.
То есть они не могут остановить развитие болезни, а применяются исключительно симптоматически. И как только пациент прекращает их принимать, болезнь постепенно возвращается.
Тем не менее, поскольку человеку, болеющему ревматоидным артритом, очень трудно обойтись без нестероидных противовоспалительных препаратов, и принимать НПВП при артрите приходится долго, поговорим о том, как их лучше использовать.
Начинать лечение следует с наименее токсичных препаратов. То есть с тех, которые быстро всасываются и легко выводятся из организма. К таким препаратам относятся диклофенак, ибупрофен, кетопрофен и их производные, а также селективный противовоспалительный препарат мовалис.
Индометацин, пироксикам, кеторолак и их аналоги выводятся из организма дольше, считаются более «тяжелыми» препаратами, поэтому их стараются назначать реже, в основном тем пациентам, у которых меньше риск развития побочных эффектов со стороны почек, сердечно-сосудистой системы и желудка. Кроме того, учитывая, что у пожилых людей индометацин может вызывать развитие психических нарушений, его назначают, как правило, только пациентам молодого или среднего возраста.
Второй критерий выбора — эффективность препарата. Обычно лечебный эффект от применения нестероидных противовоспалительных средств развивается быстро, в течение первых трех — семи дней лечения. Если за это время улучшения от приема используемого противовоспалительного препарата не наступило, его надо поменять на другой.
При этом одним из самых эффективных противовоспалительных препаратов считается диклофенак. Правда, многих пациентов, да и врачей, отпугивает чересчур подробная аннотация к препарату. Особенно та ее часть, где пунктуально перечислены все возможные осложнения и побочные эффекты к лекарству. Большинство людей, прочитавших аннотацию, думают, что у них обязательно возникнут все перечисленные осложнения.
Между тем, диклофенак ничуть не вреднее аспирина, который многие пьют не задумываясь. Просто аннотация к диклофенаку написана честнее и подробнее. А перечисленные побочные эффекты возникают далеко не у всех людей, даже годами принимающих диклофенак или его аналоги.
2. Кортикостероидные гормональные препараты (кортикостероиды).
Для оказания быстрой помощи страдающим ревматоидным артритом многие врачи, особенно зарубежные, помимо нестероидных противовоспалительных препаратов, не задумываясь назначают противовоспалительные кортикостероидные гормоны: преднизолон (он же медопред), триамцинолол (он же кеналог, полькортолон, триамсинолол, кенакорт), дексаметазон, метилпреднизолон (он же метипред, медрол, депо-медрол), бетаметазон (он же дипроспан, флостерон, целестон).
Среди наших врачей бытует два полярно разных взгляда на использование гормональных кортикостероидных препаратов. Одни врачи однозначно приветствуют их использование в лечебных целях, а другие полностью отвергают и игнорируют. В результате пациенты, старающиеся быть в курсе веяний «медицинской моды», находятся в полном недоумении: полезны такие гормоны при артрите или вредны, можно их использовать или нет? Что же, давайте порассуждаем вместе.
С одной стороны, применение таких гормонов почти всегда способствует явному улучшению состояния пациента. Сразу уменьшается боль в суставах, исчезает утренняя скованность, пропадают или уменьшаются слабость и ознобы. Естественно, такой быстрый результат вызывает у любого пациента чувство благодарности к врачу. А в условиях платной медицины эта благодарность часто подкрепляется материально — за такое облегчение пациент готов платить деньги, причем немалые, — что является главным стимулом западной и современной платной медицины.
К сожалению, пациентам, принимающим кортикостероидные гормоны, часто невдомек, что они получают достаточно мощный удар по всем системам организма. Ведь кортикостероиды — гормоны стресса. И пока пациент принимает такие гормоны, ему хорошо. Но стоит их отменить или снизить дозу, болезнь накинется на человека буквально с удвоенной или утроенной силой.
Вы спросите: может быть, тогда стоит не отменять гормоны, а продолжать принимать их постоянно? Нет, это не выход. То, что со временем кортикостероиды перестают так же хорошо снимать боль, как в начале их применения, это полбеды. Хуже всего, что постепенно «накапливаются» побочные эффекты от их использования.
Таких побочных эффектов немало — кортикостероиды способствуют развитию симптомокомплекса Иценко-Кушинга, при котором происходит задержка натрия и воды в организме с возможным появлением отеков и повышением артериального давления. Кроме того, такие гормоны повышают уровень сахара в крови вплоть до развития сахарного диабета, способствуют увеличению веса тела, снижают иммунитет, провоцируют у некоторых пациентов появление язвы желудка и двенадцатиперстной кишки, повышают риск образования тромбов.
При длительном приеме кортикостероидов могут произойти появление угрей, лунообразного лица, нарушения менструального цикла, развитие геморрагического панкреатита. У некоторых пациентов развиваются реакции со стороны нервной системы: появляются бессонница, эйфория, возбуждение (в некоторых случаях даже с развитием психозов), судороги по типу эпилепсии. К тому же при длительном применении лекарственные кортикостероиды подавляют выработку организмом своих естественных гормонов.
В результате рано или поздно наступает момент, когда из-за побочных эффектов пациент вынужден отказаться от приема кортикостероидных гормонов. Но сделать это не так-то просто. Организм уже не может обойтись без поступления кортикостероидов извне, и быстрое снижение их дозы приводит к резкому ухудшению самочувствия и обострению суставных болей.
Поэтому уменьшать дозы потребляемых гормонов приходится постепенно, по несколько миллиграмм в неделю. И окончательная их отмена отдаляется на несколько месяцев. Но даже при таком постепенном уменьшении дозы гормонов процесс редко проходит безболезненно для организма.
Так что, прежде чем назначить пациенту гормонотерапию, врач должен трижды взвесить, чего будет больше от такого лечения — вреда или пользы. С моей точки зрения, гормоны следует назначать только при высокой активности артрита, при «зашкаливании» в анализах воспалительных показателей (например, повышении СОЭ, или РОЭ, выше 40 мм/час, при сильном повышении уровней С-реактивного белка, серомукоида и других показателей), особенно если воспаление не сбивается нестероидными противовоспалительными препаратами, и сопровождается сильнейшими болями и слабостью заболевшего.
Так что, прежде чем назначить пациенту гормонотерапию, врач должен трижды взвесить, чего будет больше от такого лечения — вреда или пользы. С моей точки зрения, гормоны следует назначать только при высокой активности артрита, при «зашкаливании» в анализах воспалительных показателей (например, повышении СОЭ, или РОЭ, выше 40 мм/час, при сильном повышении уровней С-реактивного белка, серомукоида и других показателей), особенно если воспаление не сбивается нестероидными противовоспалительными препаратами, и сопровождается сильнейшими болями и слабостью заболевшего.
И, конечно, гормоны однозначно следует назначать при развитии ряда так называемых системных осложнений артрита — синдроме Фелти, синдроме Стилла, ревматической полимиалгии и др. То есть, с одной стороны, врач не имеет права назначать гормоны всем подряд, но и не должен отказываться от их применения в тех случаях, когда они действительно необходимы.
Ведь в некоторых ситуациях применение гормонов может, без преувеличения, спасти пациенту жизнь. Поэтому подходить к вопросу об их применении нужно крайне взвешенно, и, естественно, необходимо учитывать еще и наличие противопоказаний к гормональному лечению.
Местное лечение
1. Внутрисуставное введение кортикостероидных гормонов
Чаще всего в сустав при артритах вводят препараты кортикостероидных гормонов: кеналог, дипроспан, гидрокортизон, флостерон, целестон, метипред, депо-медрол. Кортикостероиды хороши тем, что они быстро и эффективно подавляют боль и воспаление при отеке и припухании сустава. Именно быстрота, с какой достигается лечебный эффект, — причина того, что кортикостероидные инъекции завоевали особую популярность среди врачей.
Введение кортикостероидных гормонов в сустав помогает больному пережить период особо острого воспаления отдельных суставов. Такие внутрисуставные инъекции могут существенно облегчить жизнь больному даже в особо тяжелых случаях ревматоидного артрита. Но обычно лечебного эффекта от инъекции хватает всего на 3-4 недели. Затем воспаление вновь начинает понемногу нарастать.
То есть такие инъекции ни в коей мере не являются панацеей. Тем более, что их нельзя делать слишком часто — иначе гормоны начнут оказывать отрицательное воздействие на весь организм.
Поэтому интервалы между такими процедурами должны быть не меньше 7-10 дней. А в один сустав в сумме, даже с большими интервалами, нежелательно делать больше 5-8 гормональных уколов. Ведь слишком частые введения гормонов провоцируют нарушение структуры связок сустава и окружающих его мышц, постепенно вызывая «разболтанность» сустава и деструкцию хряща.
2. Лазерная терапия
Этот метод оказывает при ревматоидном артрите мягкий противовоспалительный эффект. Применяется лазеротерапия и как отдельный метод лечения ревматоидного артрита, и в сочетании с базисной терапией.
Существуют два способа воздействия лазерным излучением на организм больного. В острой фазе ревматоидного артрита лазером облучают не суставы пациента, а область локтевой вены — то есть излучение воздействует на кровь, циркулирующую внутри организма. Считается, что после облучения крови лазером в организме происходят разнообразные положительные сдвиги: нормализуется иммунитет, улучшается кровоснабжение органов и тканей, уменьшается любое воспаление и подавляются очаги инфекции.
В хронической фазе болезни (при нормализации анализов и температуры тела) лазером воздействуют непосредственно на суставы больного ревматоидным артритом. Делается это при условии, что у пациента нормальные анализы и температура тела. Улучшение после лазеротерапии отмечается у 80% больных, хотя в начале курса лечения происходит кратковременное обострение заболевания.
В целом наиболее благоприятные результаты отмечаются у пациентов с вялотекущей, мягкой формой ревматоидного артрита. При тяжелых формах болезни лазер малоэффективен. Курс лечения состоит из 15-20 процедур, проводимых через день.
Противопоказаниями к применению лазера являются опухолевые заболевания, болезни крови, гиперфункция щитовидной железы, инфекционные заболевания, физическое истощение, кровотечения, инфаркт миокарда, инсульт, туберкулез, цирроз печени, гипертонический криз.
3. Криотерапия — воздействие местным охлаждением
Криотерапия является одним из лучших местных методов лечения ревматоидного, псориатического и реактивного артритов, а также болезни Бехтерева. Криотерапия с успехом применяется как в острой, так и в хронической фазе ревматоидного артрита. Лечение это практически безвредное и почти не имеет противопоказаний, но требует регулярности. Улучшение после криотерапии отмечается более чем у 80% больных ревматоидным артритом.
Существуют два основных аппаратных метода криотерапии: сухая криотерапия (воздействие воздухом сверхнизкой температуры, в частности применение криосаун), и «жидкая криотерапия» — воздействие на организм струей жидкого азота.
При «жидкой криотерапии» на пораженные суставы или спину направляют струю жидкого азота под давлением, азот моментально испаряется и быстро охлаждает место воздействия. В результате такой процедуры удается добиться выраженной ответной реакции со стороны организма и пораженных суставов — уменьшается воспаление и отечность суставов, улучшается кровообращение и обмен веществ, снижаются болевые ощущения. Курс лечения включает 8-12 процедур, проводимых ежедневно или через день.
При правильном воздействии криотерапия жидким азотом почти не имеет противопоказаний и может быть использована даже для лечения пожилых, ослабленных больных. Ее нельзя применять лишь при синдроме Рейно, некоторых аритмиях, и непосредственно сразу после инфаркта или инсульта.
Во время сухой криотерапии раздетого пациента на очень короткое время помещают в специальное помещение — криосауну, куда подается очень холодный воздух. Сухая криотерапия оказывает меньшее локальное воздействие на отдельные воспаленные суставы пациента, но, равно жидкой криотерапии, хорошо действует на общее состояние больных ревматоидным артритом — особенно в том случае, когда у пациента воспалена сразу большая группа суставов.
Однако, при прочих равных условиях, сухая криотерапия в коммерческих медицинских центрах стоит, как правило, значительно дороже жидкой криотерапии, поскольку требует более сложного и дорогостоящего оборудования.
4. Лечебные мази и кремы
Лечебные мази и кремы часто рекламируются как средства, гарантирующие исцеление от суставных заболеваний. Однако при артрите лечебные мази способны принести больному лишь небольшое облегчение.
Обычно при ревматоидном артрите используют мази на основе нестероидных противовоспалительных веществ (индометациновая, бутадионовая, долгит, вольтарен-гель, фастум-гель и др.). К сожалению, они действуют не так эффективно, как хотелось бы — ведь кожа пропускает не более 5-7% действующего вещества, а этого явно недостаточно для развития полноценного противовоспалительного эффекта.
Но зато эти мази почти никогда не вызывают тех побочных эффектов, которые случаются от внутреннего применения нестероидных противовоспалительных средств. То есть они практически безвредны.
Физиотерапевтическое лечение ревматоидного артрита
Массаж и любые физиотерапевтические процедуры, за исключением криотерапии и лазера, при ревматоидном артрите проводятся только тогда, когда минует обострение артрита, и показатели крови придут в норму. Ведь физиопроцедуры и массаж оказывают стимулирующее действие на организм, которое полезно при артрозах, но при артритах способно усиливать воспаление суставов.
Поэтому физиотерапию и массаж делают исключительно при нормальной температуре тела, хороших анализах крови и при отсутствии покраснения и отека суставов (покраснение и отек указывают на скопление в суставе патологической «воспалительной» жидкости).
Еще раз подчеркну: массаж и практически любые физиотерапевтические процедуры, за исключением криотерапии и лазера, абсолютно противопоказаны при средней и высокой активности ревматоидного артрита, пока продолжается заметное воспаление суставов!
И только после ликвидации обострения можно переходить к мягкому массажу и физиотерапии, чтобы добиться улучшения кровообращения больных суставов, уменьшения их деформации и увеличения их подвижности.
С этой целью применяют инфракрасные облучения, диатермию, УВЧ, аппликации парафина, озокерита и лечебных грязей. Эти виды физиотерапии способствуют мышечной релаксации и устранению контрактуры суставов, улучшают питание больных суставов. С успехом применяется также фонофорез с лекарственными препаратами (например, с гидрокортизоном). Фонофорез оказывает на суставы больного мягкое противовоспалительное действие.
Несколько реже при ревматоидном артрите используется рентгенотерапия. Метод заключается в воздействии на пораженные суставы небольших доз рентгеновских лучей. Малые дозы облучения оказывают выраженное обезболивающее и противовоспалительное действие и не вызывают серьезных осложнений. Иногда рентгенотерапию применяют для усиления противовоспалительного эффекта базисных препаратов, даже при активном ревматоидном артрите.
Диета при ревматоидном артрите
Диета при ревматоидном артрите — одна из важных составляющих лечения. У некоторых больных проявляется четкая взаимосвязь между активностью воспаления и переносимостью определенных продуктов питания.
Обострение артрита наступает при употреблении в пищу продуктов, «аллергизирующих» организм, а их отмена приводит к улучшению состояния. Наиболее часто, по мнению ряда ученых, обострению воспалительного процесса при ревматоидном артрите способствует употребление в пищу кукурузы, пшеницы, свинины, цитрусовых, овсянки, ржи, молока и молочных продуктов.
Значит, все эти продукты необходимо по возможности ограничить или исключить из рациона больного ревматоидным артритом. Рекомендуется употребление рыбы, рыбьего жира и других морепродуктов, а также овощей, фруктов, куриных яиц, перловой и гречневой круп. Питание должно быть дробным и частым, 5-6 раз в день.
Готовить еду желательно на пару. Постарайтесь сократить употребление поваренной соли и как можно меньше есть жареную или копченую пищу. Некоторые ученые рекомендуют пациентам, болеющим ревматоидным артритом, вообще перейти на диету № 10 (см. 1-ю главу).
***
Статья доктора Евдокименко© для книги «Артрит», опубликована в 2003 году.
Отредактирована в 2011г. Все права защищены.
ЧИТАТЬ ДАЛЕЕ:
- Симптомы ревматоидного артрита
- Причины ревматоидного артрита
- Диагностика ревматоидного артрита
- Лекарства больше Не нужны?
- Все статьи доктора Евдокименко
Дата публикации 21 января 2020Обновлено 10 мая 2023
Определение болезни. Причины заболевания
Ревматоидный артрит — это хроническое воспалительное заболевание соединительной ткани, которое характеризуется повреждением суставов и системным поражением внутренних органов.
Краткое содержание статьи — в видео:
Чаще всего заболевание поражает именно суставы, но может также затрагивать другие системы (лёгкие, сердце и нервную систему). Повреждение суставов происходит вследствие хронического воспаления синовиальной оболочки — внутреннего слоя, выстилающего суставную сумку.
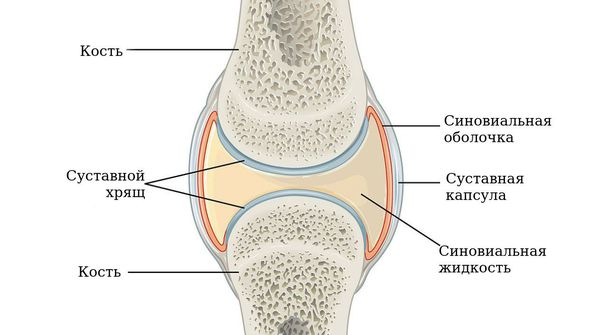
Строение сустава
По мере прогрессирования болезни происходит эрозия кости и деформация суставов. Заболевание имеет аутоиммунный характер, это означает, что в организме образуются антитела против собственных тканей. В результате длительного воздействия этих антител происходит разрушение и воспаление тканей.
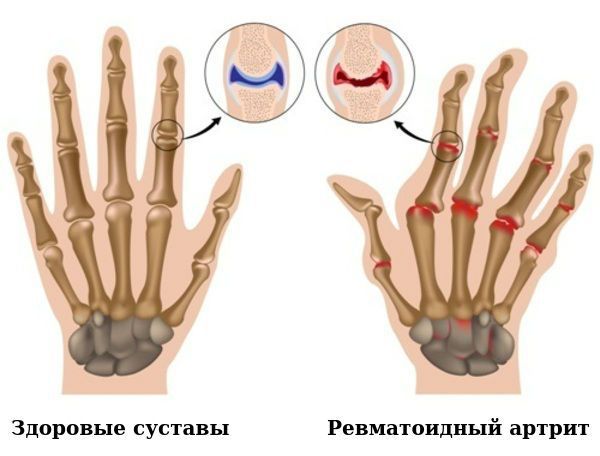
Повреждение суставов при ревматоидном артрите
Распространённость в популяции взрослого населения составляет 0,5-2 % (у женщин < 65 лет ~ 5 %). Заболеваемость ревматоидным артритом составляет примерно 50-100 новых случаев на 100 000 населения в год [1]. Соотношение распространённости среди женщин и мужчин — 2-3:1. Поражаются все возрастные группы, включая детей и пожилых. Пик начала заболевания 30-55 лет.
Причины развития ревматоидного артрита неизвестны.
Предрасполагающие факторы:
- Инфекции (вирус Эпштейна — Барр, парвовирус В19 и др.).
- Генетические факторы, носительство антигена гистосовместимости HLA-DR4.
- Курение, злоупотребление кофе, высокий индекс массы тела, стресс.
- Контакт с минеральными маслами (моторными или гидравлическими). В эксперименте [13] было показано, что эти масла обладают артритогенными (т. е. вызывающими воспаление суставов) свойствами.
- Половые гормоны и факторы репродукции (беременность, роды и т. д.).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы ревматоидного артрита
В течении ревматоидного артрита выделяют продромальный период, который формируется за несколько недель и/или месяцев до развития типичного симптомокомплекса, присущего ревматоидному артриту. Он проявляется общей слабостью, недомоганием, болями в мышцах и суставах, снижением аппетита, субфебрильной температурой (от 37,1 до 38 °C) [1][2][8].
Дебют ревматоидного артрита может клинически проявляться различными вариантами:
- неспецифическими признаками с незначительно выраженным суставным проявлением (умеренные боли в суставах);
- острым полиартритом (боль, отёчность двух или трёх суставов, ограничение объёма движений в них) с преимущественным поражением суставов кистей, стоп, выраженной утренней скованностью;
- острым полиартритом с системными проявлениями: фебрильная лихорадка (температура от 38 до 39 °C); лимфаденопатия (увеличение лимфоузлов; могут увеличиться до размера грецкого ореха); гепатоспленомегалия (увеличение печени и селезёнки) [1].
Для ранней стадии РА характерно поражение второго и третьего проксимальных межфаланговых и пястно-фаланговых суставов, а также положительный симптом сжатия кисти или стопы (при сжатии кисти или стопы возникает резкая боль) на уровне пястно-фаланговых и плюснефаланговых суставов. Типичным симптомом РА является веретенообразная дефигурация (изменение формы сустава, например в виде лебединой шеи или пуговичной петли) проксимальных межфланговых суставов кистей.
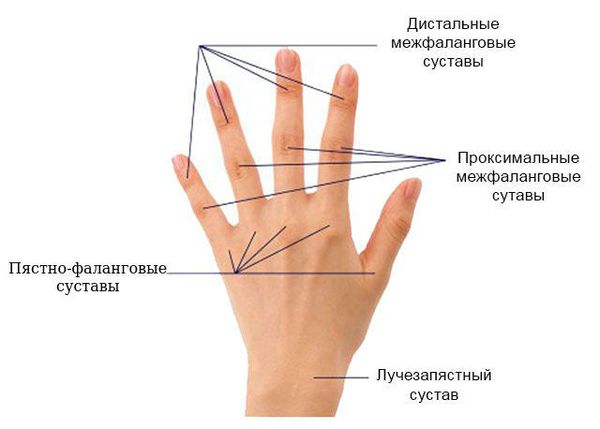
Суставы кисти
Одним из наиболее ранних и характерных симптомов является утренняя скованность (пациент не может согнуть и разогнуть суставы, как будто руки в тугих перчатках). Выраженность скованности чётко взаимосвязана с воспалительной активностью. При высокой активности воспалительного процесса она длится на протяжении многих часов, однако по утрам особенно выражена и всегда снижается после двигательной активности.
В развёрнутой и финальной стадиях заболевания появляются типичные для РА деструкции, деформации и анкилозы (заращение сустава, отсутствие движений в нём).
Кисти:
- ульнарная девиация пястно-фаланговых суставов (пальцы отклоняются в локтевую сторону в виде плавников моржа), обычно через 1-5 лет от начала болезни;
- поражение пальцев кистей по типу «бутоньерки» (сгибание в проксимальном межфаланговом суставе) или «шеи лебедя» (переразгибание в проксимальном межфаланговом суставе);
- деформация кисти по типу «лорнетки» [1][5].
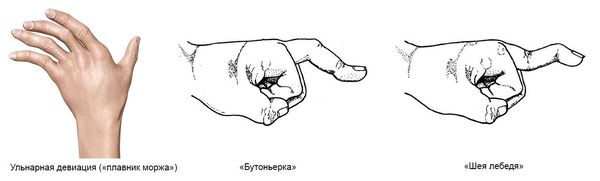
Виды деформации суставов
Коленные суставы: сгибательная и вальгусная (колени сводятся внутрь) деформация, киста Бейкера (подколенная или коленная киста).
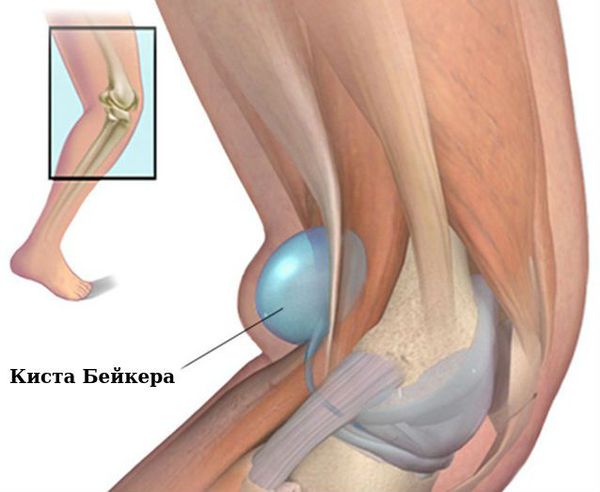
Киста Бейкера
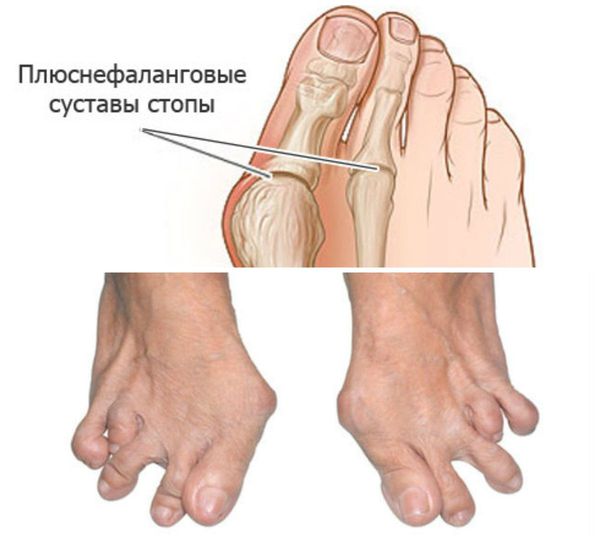
Стопы: подвывихи головок плюснефаланговых суставов, латеральная девиация (отклонение большого пальца к другим пальцам стопы), деформация большого пальца.
Деформация суставов стопы
Шейный отдел позвоночника: подвывихи в области атлантоаксиального сустава, иногда осложняющиеся сдавлением спинного мозга или позвоночной артерии.
Перстневидно-черпаловидный сустав: огрубение голоса, одышка, дисфагия (пациент не может глотать), рецидивирующий бронхит.
Связочный аппарат и синовиальные сумки: теносиновит (воспаление оболочек сухожилия) в области кисти и лучезапястного сустава; бурсит (воспаление в синовиальной сумке), чаще в области локтевого сустава; синовиальная киста на задней стороне коленного сустава (киста Бейкера).
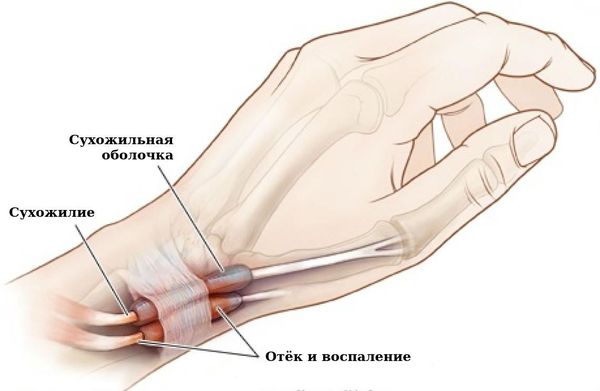
Теносиновит
Для РА характерны разнообразные внесуставные и системные проявления.
Конституциональные симптомы: генерализованная слабость, недомогание, похудение вплоть до истощения (вес меньше 40 кг), субфебрильная лихорадка.
В полиморфной картине ревматоидного артрита поражение сердца встречается нечасто. Кардиальная симптоматика может быть обусловлена как непосредственно воспалительным процессом в сердце, так и осложнением РА — атеросклерозом. При этом заболевании возможно вовлечение в патологический процесс миокарда (самой толстой мышцы сердца), перикарда (внешней оболочки сердца), эндокарда (внутренней оболочки сердца), аорты и венечных артерий сердца. Встречаются такие заболевания, как перикардит (воспаление внешней оболочки сердца), гранулематозное поражение клапанов сердца (очень редко), раннее развитие атеросклероза, воспаление коронарных артерий [1][6].
При РА нередко встречается поражение лёгких. Оно проявляется:
- плевритом (воспалением плевральных листков);
- интерстициальными поражениями лёгких (воспалением и нарушением структуры альвеолярных стенок, лёгочных капилляров);
- облитерирующим (обструктивным) бронхиолитом (стойкой, прогрессирующей закупоркой мелких бронхов);
- ревматоидными узелками в лёгких (синдром Каплана).
Наиболее серьёзным проявлением поражения лёгких является фиброзирующий альвеолит, который обусловлен как самим заболеванием, так и применением некоторых базисных противовоспалительных препаратов, а именно метотрексата, препаратов золота и Д-пеницилламина [1][6][7]. Фиброзирующий альвеолит проявляется непродуктивным кашлем (сухим, без мокроты), одышкой экспираторного типа (затруднён выдох), серым цианозом. Он приводит к повышению давления в лёгочной артерии и развитию лёгочного сердца (увеличению правых отделов сердца). На рентгенограмме определяется усиление лёгочного рисунка, феномен «медовых сот» (деструктивное изменение лёгких, характеризуется содержанием многочисленных кистозных воздушных пространств с толстыми стенками).
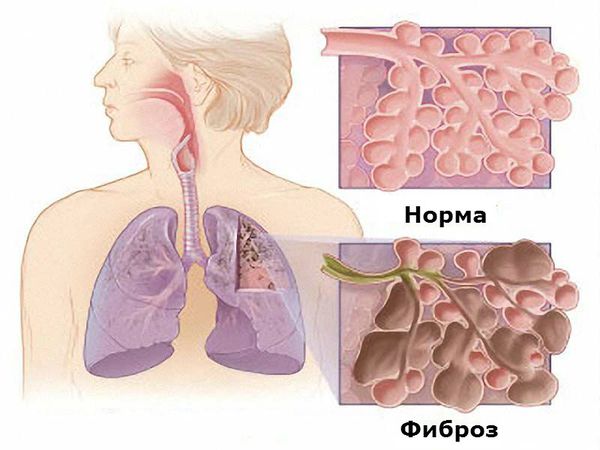
Фиброзирующий альвеолит
Кожный синдром имеет множество проявлений. Типичным внесуставным признаком являются ревматоидные узелки (костные образования на суставах размером с горошину или грецкий орех), которые располагаются под кожей чаще всего на разгибательной поверхности локтевых суставов, при атипичном расположении могут появляться на ахилловом сухожилии, роговице, в сухожилиях.
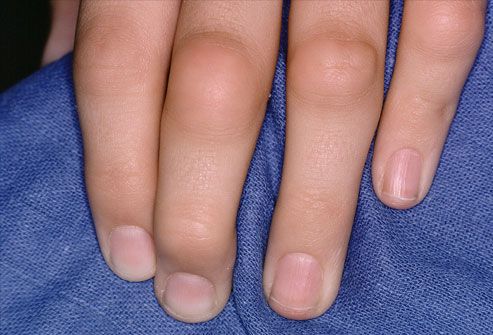
Ревматоидные узелки
Кожными проявлениями ревматоидного артрита считают и развитие различных патологий:
- кожного васкулита (воспаления сосудов кожи) от язвенно-некротических изменений до утолщения и гипотрофии кожи;
- дигитального (пальцевого) артериита (воспаления и разрушения подкожных сосудов), редко с гангреной пальцев;
- микроинфарктов в области ногтевого ложа (нарушения кровообращения, закупорки сосуда микротромбом и появления чёрных точек на пальцах),
- сетчатого ливедо (ретикулярной асфиксии, или Livedo reticularis) — нежного рисунка синего цвета в виде кружева [8].
Поражения периферической нервной системы объясняются сдавлением нервных стволов или их сосудистым поражением. Для ревматоидного артрита характерны компрессионные нейропатии: синдром запястного канала (длительная боль, онемение пальцев кисти), тарзального канала (боль в области голеностопного сустава, чувство ползания мурашек по руке) и т. д. Компрессия нервных стволов проявляется болями, чувством ползания мурашек, онемением, регионарной атрофией мышц. Возможно и поражение периферических нервов, которое проявляется чувствительными или чувствительно-двигательными нарушениями.
Большое значение при ревматоидном артрите имеет поражение мышц: атрофия межкостных мышц кисти, тенора (возвышения большого пальца), гипотенора (возвышения мизинца). Характерна атрофия мышц, которые расположены близко к поражённым суставам, например атрофия межкостных мышц кистей, мышц нижней трети бедра в случае выраженного артрита коленных суставов. Амиотрофия (отсутствие мышц) может быть проявлением ревматоидного васкулита, нейропатии, например при синдроме запястного или локтевого канала, длительном применении глюкокортикоидов, ограничении мышечной активности [1][2][8].
Патология глаз является одним из характерных проявлений ревматоидного артрита. Часто возникает эписклерит (воспаление тканей глаза), который очень редко сопровождается тяжёлым течением или исходом в перфорирующую склеромаляцию (размягчение ткани) с образованием отверстий в роговице и энуклеацией (удалением ядра).
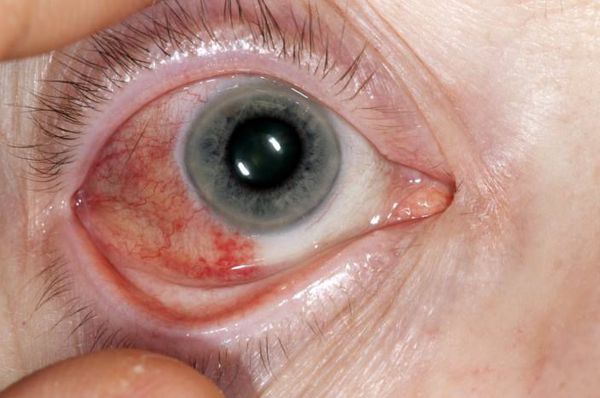
Эписклерит
При склерите (воспалении склеры глаза) и склерокератите (воспалении склеры и роговицы глаза) появляется выраженная боль и покраснение склеры. Характерен для этого заболевания и синдром сухого глаза, который является следствием скопления лимфоцитов в слёзных железах и обычно рассматривается в рамках синдрома Шегрена.
Патология почек проявляется диффузным гломерулонефритом (поражением клубочкового аппарата почек), распространённым амилоидозом (скоплением белка амилоида) с преимущественным поражением почек или лекарственной нефропатией (повреждением ткани и клубочкового аппарата почек). Последняя обусловлена приёмом нестероидных противовоспалительных средств (НПВС), например диклофенака, или комбинированных анальгетиков с фенацетином, что приводит к развитию интерстициального нефрита (воспаления в межуточной ткани почек).
Система крови реагирует на аутоиммунный воспалительный процесс развитием анемии, тромбоцитоза (увеличения содержания в крови тромбоцитов), нейтропении (снижения количества нейтрофилов). Возможны также вторичные, лекарственно обусловленные осложнения:
- в ответ на приём цитостатиков в виде панцитопении (снижения уровня всех видов кровяных клеток);
- на фоне высоких доз глюкокортикостероидов в виде лейкемоидной реакции (увеличения общего количества лейкоцитов).
Система макрофагов часто реагирует на активный воспалительный процесс развитием лимфаденопатии (увеличения лимфатических узлов), спленомегалии (увеличения селезёнки), формированием особой формы ревматоидного артрита в виде синдрома Фелти [2][7].
Поражение желудочно-кишечного тракта (ЖКТ) может быть представлено вторичным амилоидозом, аутоиммунным гепатитом, но наиболее часто выявляется эрозивное поражение вследствие приёма НПВС или глюкокортикостероидов.
У пациентов с высокой активностью ревматоидного артрита может развиваться васкулит:
- дигитальный артериит;
- пальпируемая пурпура (геморрагическая сыпь),
- ретикулярная асфиксия (пурпурный сетчатый сосудистый рисунок на коже);
- периферическая полинейропатия;
- висцеральный артериит: коронариит (воспалительное поражение стенок сосудов, питающих миокард), мезентериальный тромбоз (закупорка сосудов ткани, с помощью которой кишечник крепится к брюшной стенке), инфаркт кишечника, острый пневмонит, альвеолит);
- синдром Рейно (онемение и болевой синдром пальцев рук).
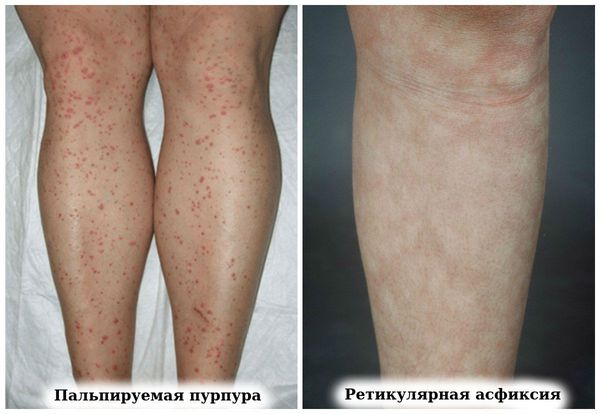
Васкулиты
Эндокринные проявления — в связи с аутоиммунным характером заболевания одновременно могут развиваться аутоиммунный тиреоидит (хроническое заболевание щитовидной железы, при котором происходит постепенное разрушение клеток), синдром Шегрена.
Выделяют также редкие особые клинические формы течения ревматоидного артрита:
Синдром Фелти характеризуется таким симптомокомплексом: нейтропения, спленомегалия, гепатомегалия, тяжёлое поражение суставов, внесуставные проявления (васкулит, нейропатия, лёгочный фиброз, синдром Шегрена), гиперпигментация кожи нижних конечностей, высокий риск инфекционных осложнений. Этот синдром развивается у больных с длительным течением РА.
Болезнь Стилла у взрослых — рецидивирующая фебрильная лихорадка, артрит, макулопапулезная сыпь, высокая лабораторная активность. Он одинаково часто встречается у мужчин и женщин. Для этого синдрома характерна истощающая лихорадка, которая нередко достигает температуры выше 41 °C. Лихорадка носит стойкий характер и парадоксально реагирует на проводимую терапию. Поражение суставов характеризуется доброкачественным течением. При синдроме Стилла наблюдаются лейкоцитоз со сдвигом формулы влево, повышение активности печёночных ферментов, анемия, диспротеинемия (сдвиг белкового состава плазмы крови), ускоренная скорость оседания эритроцитов (СОЭ), повышение С-реактивного белка, который отражает острые воспалительные процессы в организме, гиперферритинемия (повышенный ферритин в крови) [1][8].
Патогенез ревматоидного артрита
В норме синовиальная оболочка имеет толщину всего несколько клеток, она вырабатывает синовиальную жидкость, которая смазывает и питает сустав. Механизм развития ревматоидного артрита можно представить следующим образом.
- Ревматоидный артрит приводит к тому, что иммунные клетки атакуют здоровую синовиальную оболочку. Развивается субсиновиальный отёк, в синовиальной оболочке скапливаются лимфоциты, полиморфно-ядерные лейкоциты, моноциты и плазматические клетки.
- При этом иммунные клетки выделяют защитные белки — цитокины, которые провоцируют разрастание кровеносных сосудов синовиальной оболочки.
- Повышенный кровоток приводит к избыточному росту ткани. Синовиальные клетки быстро размножаются, что приводит к утолщению синовиальной ткани. Такая патологически утолщённая ткань называется «паннус».
- Клетки паннуса выделяют протеолитические ферменты, которые разрушают хрящ.
- Одновременно под воздействием гиперпродукции провоспалительных цитокинов (ФНО-альфа и др.) происходит активация остеокластов (клеток костной ткани, которые уничтожают старую структуру), что ведёт к повреждению костей. В дальнейшем происходит разрушение костной ткани с образованием эрозий.
- Костные эрозивные изменения происходят ещё и в результате активации фибробластов (главных клеток рыхлой соединительной ткани), которые начинают вырабатывать ферменты, способные разрушать суставной хрящ [1][2].
- Прогрессирование заболевания приводит к тому, что паннус превращается в зрелую фиброзную ткань, что ведёт к сращению суставных поверхностей.
Классификация и стадии развития ревматоидного артрита
Международная классификация болезней 10-го пересмотрм (МКБ-10):
- М05 — Серопозитивный ревматоидный артрит.
- М06 — Другие ревматоидные артриты.
- М05.0 — Синдром Фелти.
- М06.1 — Болезнь Стилла у взрослых.
- М06.9 — Ревматоидный артрит неуточнённый.
Рабочая классификация ревматоидного артрита (проект 2002):
Серопозитивный ревматоидный артрит (М 05).
- Полиартрит (М05).
- Ревматоидный васкулит (М 05.2) (дигитальный артериит, хронические язвы кожи, синдром Рейно и др.).
- Ревматоидные узлы (М 05.3).
- Полинейропатия (М 05.3).
- Ревматоидная болезнь лёгких (М 05.1) (альвеолит, ревматоидные лёгкие).
- Синдром Фелти (М 05.1).
Серонегативный ревматоидный артрит (М 06.0).
- Полиартрит (М 06.0).
- Синдром Стилла взрослых (М 06.1) [14].
В течение длительного времени для установления достоверного диагноза РА использовались критерии 1987 года.
Пересмотренные диагностические критерии РА (ARA 1987):
- Утренняя скованность (не менее 1 часа).
- Артрит трёх или более суставных зон.
- Артрит суставов кистей.
- Симметричный артрит.
- Ревматоидные узелки.
- Ревматоидный фактор.
- Рентгенологические изменения.
Достоверный диагноз РА устанавливают при наличии четырёх из семи вышеперечисленных критериев, причём первые четыре должны существовать не менее шести недель.
В настоящее время доказана возможность изменения отрицательного прогноза РА в случае раннего начала патогенетической базисной терапии. Поэтому длительное время разрабатывались методы ранней диагностики РА. В 2010 году ассоциацией американских и европейских ревматологов были приняты критерии ранней диагностики РА, в которых клинические и лабораторные показатели выражены в баллах. При суммарной величине более 6 баллов может быть установлен достоверный диагноз ранней стадии РА, что предполагает возможность начала патогенетической терапии базисными препаратами [1][2][6].
| А. Поражение суставов | Баллы |
|---|---|
| 1 большой сустав | 0 |
| 2-10 больших суставов | 1 |
| 1-3 малых суставов | 2 |
| 4-10 малых суставов | 3 |
| Больше 10 суставов | 4 |
| В. Серологический тест | |
| Отрицательные РФ АЦП | 0 |
| Слабо + тесты на РФ и АЦП | 1 |
| Высоко + тесты на РФ и АЦП | 2 |
| С. Маркеры острой фазы воспаления | |
| Нормальный СРБ и СОЭ | 0 |
| Аномальные СОЭ и СРБ | 1 |
| D. Длительность симптомов | |
| Меньше 6 недель | 0 |
| Больше 6 недель | 1 |
Наличие 6 из 10 баллов указывает на определённый РА.
В 2007 году Ассоциации ревматологов России приняла новую классификацию РА, включающую несколько разделов.
Основной диагноз:
- Ревматоидный артрит серопозитивный (М05.8).
- Ревматоидный артрит серонегативный (М06.0).
- Особые клинические формы ревматоидного артрита:
- синдром Фелти (М05.0);
- болезнь Стилла, развившаяся у взрослых (М06.1).
- Ревматоидный артрит вероятный (М05.9, М06.4, М06.9).
Клиническая стадия:
- Очень ранняя стадия: длится меньше 6 месяцев.
- Ранняя стадия: длится от 6 месяцев до года.
- Развёрнутая стадия: длится больше года при наличии типичной симптоматики ревматоидного артрита.
- Поздняя стадия: длится 2 года и более, протекает с выраженным повреждением мелких (III-IV рентгенологическая стадия) и крупных суставов, наличие осложнений.
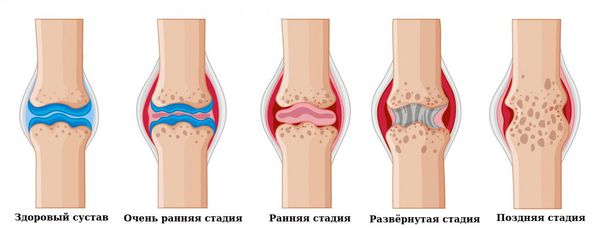
Клинические стадии ревматоидного артрита
Активность болезни:
- 0 = ремиссия: DAS28 < 2,6 (DAS28 — индекс активности болезни).
- 1 = низкая: 2,6 < DAS28 <3,2.
- 2 = средняя: DAS28 = 3,2-5,1.
- 3 = высокая (DAS28 > 5,1).
Внесуставные (системные) проявления:
- Ревматоидные узелки.
- Кожный васкулит (язвенно-некротический васкулит, инфаркты ногтевого ложа, дигитальный артериит, ливедо-ангиит).
- Васкулит других органов.
- Нейропатия (мононеврит, полинейропатия).
- Плеврит (сухой, выпотной), перикардит (сухой, выпотной).
- Синдром Шегрена.
- Поражение глаз (склерит, эписклерит, васкулит сетчатки).
Инструментальная характеристика:
- Наличие эрозий (с использованием рентгенографии, возможно МРТ, УЗИ):
- неэрозивный;
- эрозивный.
- Рентгенологическая стадия (по Штейнброкеру, модификация):
- I — околосуставной остеопороз.
- II — остеопороз + сужение суставной щели, возможны единичные эрозии.
- III — признаки предыдущей стадии + множественные эрозии + подвывихи в суставах.
- IV — признаки предыдущей стадии + костный анкилоз.
Дополнительная иммунологическая характеристика — антитела к циклическому цитрулинированному пептиду (АЦЦП). Цитруллинированный пептид — это белок, который вырабатывается в результате обменных процессов в организме. В норме цитруллин полностью выводится из организма. При развитии РА концентрация ЦЦП повышается, иммунная система воспринимает его как чужеродный и начинает вырабатывать к нему антитела.
- АЦЦП — присутствуют (+);
- АЦЦП — отсутствуют (-).
Функциональный класс:
- I — пациент выполняет все три жизненно-важные функции: самообслуживание, профессиональные и непрофессиональные обязанности.
- II — пациент ограничен только в непрофессиональной деятельности (все элементы досуга, отдых, развлечения, занятия спортом).
- III — ограничена непрофессиональная и профессиональная деятельность (работа и учёба, ведение домашнего хозяйства), но сохранена возможность самообслуживания.
- V — утрачены все три жизненно-важные функции, даже возможность самообслуживания [14].
Осложнения ревматоидного артрита
- Амилоидоз почек возможен при длительном течении ревматоидного артрита. Проявляется отёками, повышением артериального давления, большим количеством белка в анализах мочи. Т. е. за сутки теряется 3-20 г белка. Диагноз может быть подтверждён биопсией почки.
- Остеонекроз — омертвение участка кости, вызванное нарушением кровоснабжения. Появляется сильная боль в поражённом суставе, ограничение объёма движений в нём. Для подтверждения диагноза необходимо сделать рентгенографию, компьютерную томографию сустава.
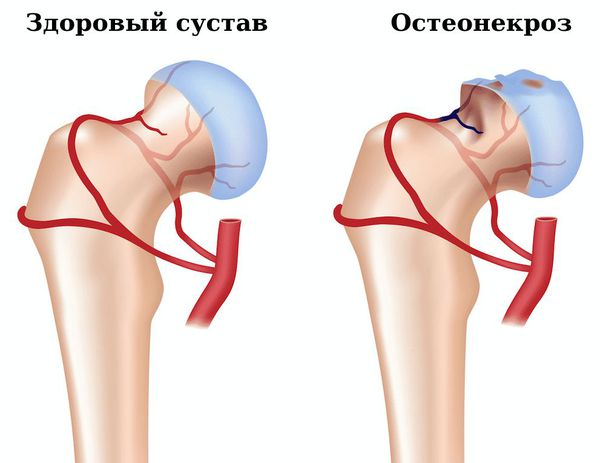
Остеонекроз
- Вторичный остеоартроз — появление болей в суставе, хруст при движении в нём, может быть отёчность. Для подтверждения диагноза надо сделать рентген сустава.
- Туннельные синдромы — неврологическое заболевание, проявляющиеся длительной болью и онемением пальцев кисти. Причиной заболевания является сдавление срединного нерва между костями, поперечной кистевой связкой и сухожилиями мышц запястья.
- Кардиоваскулярные проявления — для пациентов с ревматоидным артритом характерно раннее развитие атеросклероза. Поэтому возможно возникновения инсульта и инфаркта [12].
- Медикаментозные ятрогении (токсические и аллергические) — это патологические состояния, вызванные медицинским вмешательством. Т. е. под влиянием медицинских воздействий могут возникнуть новые заболевания у пациента, либо осложнение, либо ухудшение уже имеющегося заболевания.
Также к осложнениям относятся рак желудочно-кишечного тракта, остеопороз, синдром Сикки, синдром Фелти, лимфома и др. [12].
Диагностика ревматоидного артрита
Лабораторные исследования, рекомендуемые для обследования пациентов с подозрением на ревматоидный артрит [2]:
- Общий анализ крови с подсчётом количества тромбоцитов.
- Биохимический анализ крови (общий белок, альбумин, глобулиновые фракции, общий билирубин, мочевина, креатинин, электролиты, кальций, холестерин, липидный спектр крови, С-реактивный белок, ревматоидный фактор).
- Исследование уровня антител к циклическому цитруллинированному пептиду (АЦЦП).
- Общий анализ мочи, определение белка в моче.
- Исследование сывороточных иммуноглобулинов
Ранняя диагностика подразумевает исследование уровня АЦЦП:
- АЦЦП — обязательно выполняется для ранней диагностики ревматоидного артрита, т. к. является более чувствительным и специфичным серологическим маркером раннего ревматоидного артрита, чем ревматоидный фактор (РФ). (РФ — белки, которые вырабатываются иммунной системой человека и атакуют собственные клетки, ошибочно воспринимая их как чужеродные.)
- АЦЦП выявляются у 40-50 % больных ревматоидным артритом с отрицательным РФ.
- АЦЦП «+» является показанием к началу антиревматической терапии на ранней стадии (менее шести месяцев), что позволяет эффективно затормозить прогрессирующее поражение суставов.
- АЦЦП «+» значимо для дифференциальной диагностики и прогнозирования течения ревматоидного артрита.
Инструментальные методы диагностики, рекомендуемые для обследования пациентов с подозрением на ревматоидный артрит:
- рентгенография суставов;
- УЗИ суставов;
- МРТ суставов;
- артроскопия;
- диагностическая пункция сустава: иммунологическое, цитологическое исследование, бактериальный посев синовиальной жидкости.
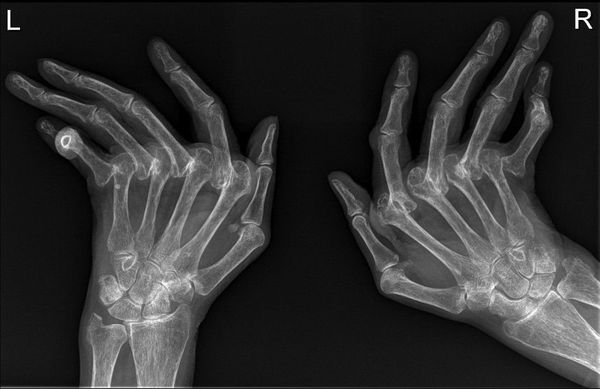
Рентгенография суставов
Дифференциальный диагноз следует проводить со следующими заболеваниями: остеоартроз, системная красная волчанка, подагра, псориатический артрит, анкилозирующий спондилит, реактивный артрит, бактериальный эндокардит, септический артрит, вирусные артриты, системная склеродермия, идиопатические воспалительные миопатии, смешанное заболевание соединительной ткани, болезнь Лайма, амилоидоз, саркоидоз, рецидивирующий полихондрит, фибромиалгия.
Лечение ревматоидного артрита
Цели: уменьшение или устранение симптомов артрита и внесуставных проявлений, контроль над воспалительной активностью, предотвращение прогрессирования костно-суставной деструкции, сохранение и существенное улучшение качества жизни, увеличение продолжительности жизни до среднего уровня в популяции [3][5][10].
Treat to Target (T2T) — лечение до достижения цели (рекомендации EULAR)
Общие рекомендации:
- Исключение стрессов.
- Исключение чрезмерного облучения солнечной радиацией. Интенсивное солнце тоже провоцирует развитие ревматических заболеваний.
- Активное лечение сопутствующих инфекций, при необходимости вакцинация.
- Профилактика атеросклероза: употребление пищи с малым содержанием жира, холестерина и высоким содержанием полиненасыщенных жирных кислот, отказ от курения, контроль массы тела, физические упражнения, приём фолиевой кислоты.
- Профилактика остеопороза: пища с высоким содержанием кальция, приём витамина Д, возможно назначение бисфосфонатов.
Медикаментозное лечение
Базисная терапия ревматоидного артрита
БПВП — базисные противовоспалительные препараты (синонимы: базисные препараты, болезнь-модифицирующие антиревматические препараты, медленно действующие препараты) — главный компонент лечения РА, при отсутствии противопоказаний они должны быть назначены каждому пациенту с этим диагнозом. Особенно важно назначение БПВП сразу после установления диагноза на ранней стадии, когда имеется ограниченный период времени (несколько месяцев) для достижения наилучших отдалённых результатов — так называемое «терапевтическое окно» [9][10].
Метотрексат — один из основных препаратов терапии РА. Цитотоксический препарат из группы антиметаболитов. По структуре аналог фолиевой кислоты. Каждому пациенту с РА при отсутствии явных противопоказаний должна быть назначена терапия метотрексатом.
Метотрексат является препаратом выбора при активном ревматоидном артрите, как на ранней, так и в развёрнутой и поздней стадиях. Этот препарат обладает значительной терапевтической широтой и возможностью индивидуального подбора дозировок, эффективные дозы находятся в диапазоне 15-30 мг/нед, в среднем — 20 мг/нед.
Метотрексат достаточно безопасен, требует минимального лабораторного контроля (общий анализ крови и трансаминазы), целесообразно назначение фолиевой кислоты 3-5 мг/сут в дни без введения препарата [5][11]. Применяют внутрь, подкожно и внутримышечно.
Основные нежелательные явления: М-эрозивный стоматит, эрозивный гастрит, диспепсия, геморрагический энтероколит, гепатоцеллюлярный синдром, нефротоксичность, обструктивная мочекислая нефропатия.
Лефлуномид («Арава») — антивоспалительное, иммуномодулирующее, антипролиферативное действие. Специально был разработан для лечения РА.
Нежелательные явления: желудочно-кишечная токсичность, печёночная токсичность, кожная сыпь, алопеция, цитопении, фиброзирующий альвеолит, снижение веса, лихорадка, почечная токсичность — при их развитии необходим приём холестирамина по 8 г три раза в день в течение 11 дней [5][10][11].
Биологическая терапия РА
Введение ГИБП (генно-инженерных биологических препаратов) стало главным прорывом в лечении ревматических заболеваний. ГИПБ представляют собой искусственные антитела (белки из группы иммуноглобулинов). С появлением биологических препаратов появилась возможность достичь длительной и стойкой ремиссии у больных с ревматоидным артритом. В настоящее время ГИБП разделены на группы по их механизму действия:
- препараты, направленные на подавление продукции ФНО-альфа (фактора некроза опухоли): инфликсимаб, этанерцепт, адалимумаб, цертолизумаб пегол, голимумаб [1][5][8].
- ингибиторы иммуноглобулинов: ИЛ-1, ИЛ-6.
- абатацепт — растворимый белок, направленный на подавление ко-стимуляции Т-клеток,
- препараты, блокирующие действие В-клеток (ритуксимаб и белимумаб), применяются при ревматоидном артрите и системной красной волчанке.
В последнее время в лечении серонегативных спондилоартритов, включая псориатический артрит, широко используются устекинумаб (блокатор ИЛ-12\23) и секукинумаб (ингибитор ИЛ-17) [8][9].
Побочные эффекты. Биологические препараты помимо положительных свойств обладают и отрицательными:
- Снижение противоинфекционного и (потенциально) противоопухолевого иммунитета. Общими для всех антагонистов ФНО-альфа нежелательными побочными реакциями (НПР) является повышение восприимчивости к инфекциям, включая возможность обострения гистоплазмоза (грибкового заболевания) и гепатита В. Появляется риск развития демиенилизирующих заболеваний, волчаночноподобного синдрома (лекарственной волчанки, которая возникает в результате приёма медикаментозных препаратов), злокачественных новообразований, тромбоэмболии (закупорки кровеносного сосуда тромбом), реакции гиперчувствительности. Среди наиболее частых НПР фигурируют назофарингит (воспаление слизистой оболочки носоглотки), инфекции мочевых и верхних дыхательных путей, боль в животе, диарея, появление АНФ (антинуклеарного фактора, который показывает наличие или отсутствие аутоиммунного заболевания) и антител к двуспиральной ДНК. Особенно возрастает восприимчивость организма к туберкулёзу. При применении антагонистов ФНО-альфа туберкулёз может давать атипичную клиническую картину. Учитывая это, до начала терапии ГИБП все пациенты должны быть обследованы на предмет как активной так и латентной туберкулёзной инфекции: проба Манту, Диаскин-тест [3][6].
- Риск развития аллергических реакций и иммуногенность, т. е. реакция собственной иммунной системы на ГИБП, которые содержат чужеродный мышиный белок. Вырабатываемые при этом нейтрализующие антитела к ГИБП снижают эффективность проводимой терапии и способствуют развитию инфузионных\постинъекционных реакций. Чаще всего эти антитела образуются к инфликсимабу, содержащему больше мышиного компонента, чем гуманизированные анти-ФНО-альфа препараты. Частота их появления при РА составляет от 7 до 53 % в зависимости от дозы. Назначение инфликсимаба в комбинации с метотрексатом снижает вероятность образования антител. При лечении этанерцептом и адалимумабоб антитела выявляются реже (5-17 %). При применении адалимумаба в комбинациии с метотрексатом частота возникновения антител минимальна и составляет около 1 % [1][4][6].
Действие антагонистов ФНО альфа вызывает небольшое, но длительно сохраняющееся увеличение содержания холестерина ЛПВП (так называемый «хороший» холестерин). Которое, в свою очередь, может оказать благоприятный эффект на сердечно-сосудистые риски у пациентов с хроническим артритом. Доказано снижение частоты сердечно-сосудистой патологии и летальности в группе больных РА, получавших лечение анти-ФНО-альфа препаратами, по сравнению с пациентами, в комплексной терапии которых данная группа препаратов не использовалась. С другой стороны, следует иметь в виду, что у больных РА с застойной сердечной недостаточностью антагонисты ФНО-альфа должны применяться с особой осторожностью. Поскольку они способны приводить к декомпенсации кровообращения и увеличению летальности. Выраженная хроническая сердечная недостаточность является противопоказанием для назначения ГИБП [4][9].
Класс малых молекул
Тофацитиниб («Яквинус») — препарат нового класса для терапии РА. Он может использоваться как в качестве монотерапии, так и в сочетании с метотрексатом или другими БПВП вне зависимости от приёма пищи [4][6].
Симптоматическая терапия
НПВП — нестероидные противовоспалительные препараты. Их особенность — быстрое наступление терапевтического эффекта, активное подавление боли и воспаления (диклофенак, «Нимесил», «Найз», «Аркоксия» и др.)
ГКС — глюкокортикостероиды. Применяются в следующих случаях:
- при максимальной активности воспалительного процесса;
- при интенсивных болях, не купирующихся НПВП;
- при генерализованном артрите с экссудативными проявлениями;
- при системных проявлениях РА;
- как компонент bridge-терапии («Метипред», преднизолон, «Полькортолон»)
Локальная терапия ГКС — внутрисуставно и периартикулярно: бетаметазона дипропионат-дипроспан; триамцинолона ацетонид («Кеналог»); гидрокортизон ацетат.
Немедикаментозное лечение
Несмотря на то, что медикаментозная терапия является главным компонентом лечения РА, немедикаментозные методы играют важную роль в достижении полноценного лечебного эффекта. Цель реабилитационных мероприятий — восстановление нарушенных или утраченных способностей пациента, его адаптация к хроническому заболеванию [3].
Лечебная физкультура и трудотерапия (специальные упражнения, имитирующие движения в процессе самообслуживания, направленные на восстановление моторики) полезны больным РА.
Физиотерапия и бальнеотерапия полезны пациентам с низкой активностью воспаления, они могут заметно уменьшить симптоматику и улучшить подвижность [3].
Прогноз. Профилактика
Прогноз
Показатели смертности у больных РА увеличиваются: средняя продолжительность жизни снижается на 8-15 лет. Около 40 % пациентов в течение трёх лет становятся нетрудоспособными. Примерно у 80 % в течение 20 лет развивается нетрудоспособность средней и тяжёлой степени и в 25 % случаев требуется обширное протезирование суставов.
Факторы неблагоприятного прогноза: женский пол, положительный РФ, поражение плюснефаланговых суставов в начале заболевания.
РА является дорогостоящим заболеванием. Это связано как со стоимостью медицинских расходов, так и со снижением работоспособности больного вплоть до её полной потери. Особенно высоки прямые и непрямые затраты при неэффективности лечения [5][7]. Однако современные методы лечения, особенно комбинированная терапия активными синтетическими и биологическими противовоспалительными препаратами, могут снизить краткосрочные и долгосрочные затраты на лечение тяжёлого РА. Эти данные следует учитывать при рассмотрении плана лечения конкретного больного.
Профилактика
Этиология РА неизвестна, первичная профилактика не проводится [1]. Скрининг не проводится.
Ревматоидный артрит — тяжёлое заболевание, которое меняет жизнь человека. Многие пациенты впадают в отчаяние и думают, что так тяжело будет всегда. Но это не так. Важно лечиться, выполнять назначения врача, не бояться информации о своей болезни. Нужно уметь расслабляться, соблюдать режим, не стесняться делиться своими эмоциями, страхами, переживаниями, наблюдениями. Нужно всегда помнить, что душевное равновесие, внутреннее спокойствие и позитивный настрой — лучшие союзники в борьбе с болезнью [3].
Важно иметь в виду, что предварительные результаты свидетельствуют о выявлении иммунологических нарушений (увеличение титров РФ, анти-ЦБ, и СРБ) за несколько месяцев или лет до появления клинических симптомов РА [1].
Лечение ревматоидного артрита (РА) на современном этапе предполагает назначение базисных противовоспалительных препаратов (БПВП) в ранние сроки болезни, в идеале – сразу после установления диагноза [1]. В этой связи были пересмотрены диагностические критерии РА, предложенные Американским колледжем ревматологов (АКР) в 1987 году [2]. Эти критерии диагностики РА включали признаки, которые выявляются в дебюте болезни примерно у 1/4–1/3 больных – эрозии головок суставных костей, выявление в сыворотке крови ревматоидного фактора (РФ). В настоящий момент предлагаются новые критерии, ориентированные на как можно более раннее установление диагноза и начало терапии БПВП. В эти критерии включены 4 группы параметров: семиотика суставного поражения, длительность симптомов, наличие или отсутствие РФ и/или антител к циклическому цитрулиннированному пептиду (АЦЦП), уровень СОЭ и/или С–реактивного белка (СРБ) (табл. 1). Варианты каждого параметра оцениваются в баллах. При сумме баллов ? 6 устанавливается диагноз РА, что позволяет начать терапию БПВП. Учитывая, что предложенные критерии еще не прошли испытания временем, оговаривается, что терапию БПВП следует начинать осторожно. И РА, и диффузные болезни соединительной ткани (ДБСТ) могут дебютировать симметричным полиартритом с небольшой утренней скованностью, отсутствием достоверных лабораторных маркеров (например, антинуклеарного фактора и др.).
Плаквенил давно используется в лечении различных ревматических заболеваний, в первую очередь больных РА и системной красной волчанкой (СКВ). Еще в конце XIX века английский врач J.P. Payne впервые выявил клинический эффект хинина при красной волчанке. Тем не менее препарат до сих пор продолжают достаточно широко использовать при СКВ. В лечении РА аминохинолиновые препараты в настоящее время стали применять реже. Несмотря на разнообразие механизмов противовоспалительного действия Плаквенила, включающее подавление синтеза цитокинов (ИЛ–1, ИЛ–6, ФНО–?), ингибицию разрушения хряща, индуцированного ИЛ–1, подавление синтеза интерферона ? активированными Т–лимфоцитами, что в определенной степени будет модифицировать активность воспалительного процесса [3–7]), медленное развитие эффекта препарата (до 6 месяцев), меньшая выраженность противовоспалительного эффекта поставила его в группу препаратов 2–й линии после более быстро и активно действующих цитостатиков.
В 2008 году АКР опубликовал обновленное соглашение по использованию БПВП и генноинженерных биологических препаратов (ГИБП) [8]. Авторы предлагают при выборе БПВП учитывать основные параметры РА:
1. Длительность РА, которая подразделяется на 3 группы: ранний РА – длительность болезни <6 месяцев, средняя длительность болезни 6–24 месяца и устоявшийся (длительный) РА при длительности симптомов более 24 месяцев.
2. Активность болезни, которая подразделяется при помощи различных индексов (табл. 2 и 3).
3. Прогностически неблагоприятные признаки: активная болезнь (большое число болезненных и припухших суставов), наличие эрозий на ранней стадии, повышение РФ и/или АЦЦП [9,10], повышение СОЭ и/или СРБ [11,12].
Плохой прогноз при РА означает рентгенологическое прогрессирование деструкции суставов, утрату функции и увеличение смертности, а также увеличение риска необходимости проведения хирургических операций на суставах. В соответствии с рекомендациями АКР (2008) [8] лечение БПВП проводится в виде монотерапии или двойных и тройных комбинаций (рис. 1А,Б,В) в зависимости от длительности терапии и наличия факторов неблагоприятного прогноза. Терапия БПВП, по мнению авторов, может начинаться или проводиться на этапах болезни в виде монотерапии, двойных, тройных комбинаций БПВП. В соответствии с рекомендациями АКР 2008 года Плаквенил (ПЛ) назначается больным без признаков неблагоприятного прогноза и при длительности РА ?24 месяца в виде монотерапии. При более высокой активности и/или при наличии факторов неблагоприятного прогноза Плаквенил предлагают использовать в комбинации с другими БПВП.
Двойная комбинация БПВП – используется при высокой активности РА у больных с наличием признаков плохого прогноза [13,14]. Комбинация метотрексата (МТ) и ПЛ рекомендуется при большой длительности РА и низкой активности (уровень доказательности С). Комбинацию метотрексата (МТ) и лефлуномида (Леф) рекомендуется назначать при средней длительности (>6 месяцев) и наличии факторов плохого прогноза, а проводить терапию так долго, как долго будет сохраняться высокая активность [15]. МТ в комбинации с сульфасалазином (СС) предлагается назначать при любой длительности РА, высокой активности, наличии признаков плохого прогноза (уровень доказательности А для длительности РА < 6 месяцев и более 24 месяцев; уровень доказательности С для средней длительности РА) [13,16–18]. Комбинация СС и ПЛ в соответствии с этими рекомендациями используется только в одной ситуации: средняя длительность РА (6–24 месяца) с высокой активностью, но без наличия признаков плохого прогноза.
Тройная комбинация БПВП – МТ+ПЛ+СС – назначается при наличии факторов плохого прогноза и при умеренной/высокой активности болезни не зависимо от длительности болезни [13,18].
Другие БПВП являются препаратами 2 и 3–й линии и используются при неэффективности или непереносимости этих 4–х БПВП (метотрексат, лефлуномид, Плаквенил, сульфасалазин).
Большинство комбинаций БПВП подбирались эмпирически или предлагались в ходе клинических испытаний новых лекарственных средств. Комбинации глюкокортикоидов (ГК), СС, МТ и аминохинолиновых препаратов оценивались при развернутой и ранней стадиях РА [18–20]. В части этих исследований было показано, что некоторые (но не все) комбинации препаратов с малым молекулярным весом более эффективны, чем монотерапия. Комбинация МТ и СС не выявила преимуществ перед изолированным назначением МТ [19]. Более того, некоторые комбинации ассоциируются с увеличением токсичности лечения, как, например, комбинация МТ и лефлуномида приводит к увеличению частоты тяжелых реакций непереносимости со стороны печени [20], а комбинация МТ и СС – к увеличению частоты развития фолиево–дефицитной анемии у больных РА [18]. Jansen и соавт. [21] также отметили и отсутствие нарастания эффекта при комбинации МТ и СС и увеличение токсичности такой комбинации.
Предполагалось, что комбинация БПВП будет способствовать повышению эффективности, более быстрому началу терапевтического действия и уменьшению токсичности по сравнению с монотерапией базисным препаратом [22]. Кроме того, назначение 2–го БПВП может помочь уменьшить развитие резистентности к ранее назначенному БПВП [22,23]. Известно, что для многих БПВП длительность непрерывного приема для 50% больных составляет 1–2 года [24]. Исключением является МТ: более половины больных, начавших лечение этим препаратом, продолжают принимать его в течение 5 лет [24]. По данным литературы следует, что для уменьшения частоты побочных эффектов должны использоваться препараты с минимальной токсичностью и хорошей длительной переносимостью.
Нами сравнивалась комбинация МТ и ПЛ с монотерапией МТ в 12–месячном открытом исследовании. Наш выбор препаратов для комбинации основывался на известной относительно низкой токсичности МТ и ПЛ в лечении РА, доступности этих препаратов для больных. Монотерапию МТ (7,5–12,5 мг/нед.) получали 26 больных и 21 получал комбинированную терапию МТ в таких же дозах и ПЛ (200 мг/сут.) [25]. Из них 12 больных начали прием МТ и ПЛ одновременно, а 9 больных Плаквенил был присоединен к ранее проводимой и недостаточно эффективной терапии МТ.
В таблице 4 представлены количественные параметры, отражающие активность РА через 6 и 12 месяцев лечения. Как видно из таблицы 4, к 6 месяцам лечения клиническое улучшение наблюдалось в обеих группах больных и проявлялось в достоверном снижении большинства анализируемых показателей (9 из 10 в I группе и 8 из 10 – во II). При этом в I группе отмечено наиболее значимое уменьшение болезненности в мелких и крупных суставах, припухлости в крупных суставах и СОЭ (p<0,001). Во II группе наиболее отчетливо (p<0,001) уменьшились боль и болезненная пальпация в крупных суставах, достоверного снижения СОЭ в этой группе через 6 месяцев не отмечено. При продолжении лечения до 12 месяцев в группе получавших МТ у 7 (39%) больных отмечалось усиление выраженности ряда признаков воспаления суставов, в большинстве случаев в пределах одной степени активности. Чаще всего отмечалось увеличение болей и припухлости в мелких суставах, так что в целом на группу достоверно снижались только 4 из 10 показателей. При использовании комбинации МТ и ПЛ через 12 месяцев нарастание выраженности параметров поражения суставов (также в пределах одной степени активности) было лишь у 3 (20%) больных. В целом во II группе сохранялось достоверное снижение 8 из 10 показателей. Степень положительного влияния на припухлость крупных и мелких суставов даже нарастала (p<0,001).
Таким образом, в первые 6 месяцев монотерапия МТ приводила к более выраженному влиянию на параметры воспаления в суставах, но при продолжении лечения отмечалась нестабильность эффекта и уменьшение числа достоверно снизившихся параметров. Комбинированная терапия МТ и ПЛ продемонстрировала более стабильное влияние на показатели воспаления суставов. Количественная оценка динамики числа эрозий в мелких суставах кистей и стоп, проведенная модифицированным методом Шарпа, показала, что и монотерапия МТ, и комбинация МТ с ПЛ замедляла прогрессирование эрозивного артрита через 12–24 месяца непрерывной терапии.
Следует отметить, что переносимость комбинированного применения МТ и ПЛ не была лучше, чем монотерапия МТ. В I группе побочные проявления мы наблюдали у 35% больных, а во II – у 57%. Отмена терапии из–за непереносимости произведена соответственно у 2 (22%) и 3 (33%) больных. Наибольшая частота симптомов непереносимости отмечена в первые месяцы лечения. При этом и среди больных, получавших комбинацию МТ и ПЛ, наиболее часто наблюдалось повышение уровня печеночных ферментов (у 58% больных), что противоречит данным J. Fries и соавт. о лучшей переносимости комбинации этих базисных препаратов [26]. При последовательном назначении МТ и ПЛ (с разрывом в 3 и более мес.) частота побочных эффектов была несколько ниже, чем при одновременном их назначении, что уже отмечалось другими авторами [27,28]. В литературе наряду с уменьшением гепатотоксичности МТ при его комбинации с ПЛ [26] отмечают увеличение продолжительности ремиссии после отмены препарата и сокращение частоты и длительности обострений [22]. Описано и уменьшение биодоступности МТ при комбинированном использовании его с ПЛ [29], что диктует необходимость приема ПЛ в те дни, когда МТ не принимается, что может увеличить эффективность терапии.
Таким образом, комбинация МТ и ПЛ оказывает более стабильный эффект во времени. Плаквенил может присоединяться к терапии МТ при появлении признаков так называемой вторичной неэффективности (снижении эффекта), что позволяет сохранить достигнутое улучшение. При достижении ремиссии на фоне комбинации МТ и ПЛ возможна отмена МТ и сохранение терапии ПЛ, что позволяет пролонгировать ремиссию.
Суммируя данные литературы и собственный опыт, можно сформулировать следующие показания для назначения Плаквенила при РА:
1. Монотерапия: ранняя стадия суставного поражения (недифференцированный артрит).
2. Монотерапия: ранняя стадия РА при низкой активности и отсутствии признаков неблагоприятного прогноза.
3. Комбинированная терапия: снижение эффекта МТ либо недостаточность эффекта (улучшение по критериям АКР >20% и менее 50%).
4. Комбинированная терапия: достижение минимальной активности РА и недостаточная переносимость МТ.
5. Комбинированная терапия: достижение ремиссии РА и отмена МТ после 6 месяцев комбинации его с ПЛ.
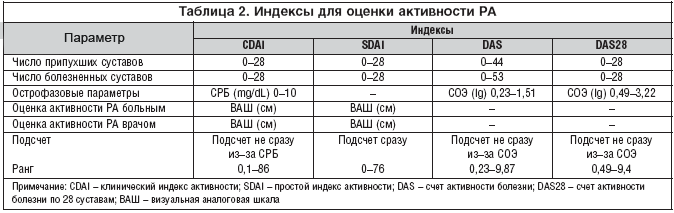
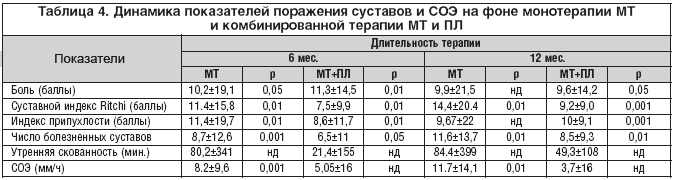
Литература
1. ACR Subcommittee of Rheumatoid Arthritis Guidelines «Guidelines for the management of rheumatoid arthritis: 2002 update» Arthr. Rheum., 2002, 46:328–346
2. Arnrett F.C., Edworth S.M., Bloch D.A., et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum., 1988;31:315–324
3. Picot S. «Chloroquine inhibits tumor necrosis factor production by human macrophages in vitro» J. Infect. Dis., 1991, V.164:830–831
4. Baker D.G., Baumgarten D.F., Dwyer J.P. «Chloroquine inhibits of production of mononuclear cell factor by inhibits of lectin binding» Arthr. Rheum., 1984, V.27: 888–896
5. Rainsford K.D. «Effects of anti–inflammatory drugs on catabolic–induced cartilage destruction in vitro».
6. Sperber K., Quraishi H., Kalb T.H., et.al. «Selective regulation of cytokine secretion by hydroxychloroquine: inhibition of interleukine 1 alpha (IL–1 alpha) and interleukine 6 in human monocyte and T cell» J. Rheum., 1993, V.20: 803–808
7. Landewe R.B.M., Dijkmans B.A.C., van der Woude F.J., et.al. «Long–term cyclosporine in patients with rheumatoid arthritis» Arthr. Rheum., 1994, V.37 (suppl): S–361
8. Saag K.G., Teng G.G., Patkar N.M. et.al. «American College of Rheumatology 2008 Recommendations for the Use of Nonbiologic and Biologic Disease–Modifying Antirheumatic Drugs in Rheumatoid Arthritis» Arthr. Care and Res., 2008, 59: 762–784
9. Agrawal S, Misra R, Aggarwal A. «Autoantibodies in rheumatoid arthritis: association with severity of disease in established RA» Clin. Rheumatol., 2007, 26: 201–204.
10. Ates A, Kinikli G, Turgay M, Akay G, Tokgoz G. «Effects of rheumatoid factor isotypes on disease activity and severity in patients with rheumatoid arthritis: a comparative study» Clin Rheumatol., 2007, 26: 538–545.
11. Emery P, Breedveld FC, Dougados M. et.al. «Early referral recommendation for newly diagnosed rheumatoid arthritis: evidence based development of a clinical guide» Ann. Rheum. Dis. 2002, 61: 290–297.
12. Gossec L, Dougados M, Goupille P. et al. «Prognostic factors for remission in early rheumatoid arthritis: a multiparameter prospective study» Ann. Rheum. Dis., 2004, 63: 675–680.
13. Hurst S, Kallan MJ, Wolfe FJ. et.al. «Methotrexate, hydroxychloroquine, and intramuscular gold in rheumatoid arthritis: relative area under the curve effectiveness and sequence effects» J. Rheumatol., 2002, 29: 1639–1645.
14. Strand V, Cohen S, Schiff M. et al., and the Leflunomide Rheumatoid Arthritis Investigators Group. «Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate» Arch. Intern. Med., 1999, 159: 2542–2550.
15. Boers M, Verhoeven AC, Markusse HM. et al. «Randomized comparison of combined step–down prednisolone, methotrexate and sulphasalazine with sulphasalazine alone in early rheumatoid arthritis» [published erratum appears in Lancet 1998; 351:220]. Lancet, 1997, 350: 309–318.
16. Kremer J. et.al. Combination leflunomide and methotrexate therapy for patients with active rheumatoid arthritis failing methotrexate therapy: open label extension of a randomized, double–blind placebo controlled trial. J. Rheum., 2004, 31: 1521–31.
17. Smolen JS, Kalden JR, Scott DL. et al, and the European Leflunomide Study Group. «Efficacy and safety of leflunomide compared with placebo and sulphasalazine in active rheumatoid arthritis: a double–blind, randomized, multicentre trial» Lancet, 1999, 353:259–266.
18. O’Dell J.R., Leff R., Paulsen G. et.al. «Treatment of rheumatoid arthritis with methotrexate and hydroxychloroquine, methotrexate and sulphasalazine, or a combination of the three medications: results of a two–year randomized, double–blind, placebo–controlled trial» Arthr. Rheum., 2002, 46: 1164–1170
19. O’Dell J.R. «Conventional DMARD option for the patients with a suboptimal response of methotrexate» J. Rheum. Suppl., 2001, 62: 21–26
20. Weiblatt M.E., Dixon J.A., Falchuk K.R. et.al. «Serious liver disease in a patient receiving methotrexate and leflunomide» Arthr. Rheum., 2000, 43: 2609–2611
21. Jansen G., van der Heijden J., Oerlemans R. et.al. «Sulphasalazine is a potent inhibitor of the reduced folate carrier: implications for combination therapies with methotrexate in rheumatoid arthritis» Arthr. Rheum., 2004, 50: 2130–2139
22. Paulus H.E. «Protocol Development for combination therapy with disease–modifying antirheumatic drugs» Sem. Arthr. Rheum., 1993, V.23, Suppl. 1: 19–25
23. Farr M., Bacon P.A. «How and when combination therapy should be used? The role of an anchor drug» Brit. J. Rheum., 1995, V.34, Suppl.2: 100–103
24. Pincus T., Marcum S.B., Callahan L.F. «Long–term drug therapy for rheumatoid arthritis in seven rheumatology private practices» J. Rheum., 1992, V.19:1885–1894
25. Е.Л. Насонов «Метотрексат. Перспективы применения в ревматологии» Москва, 2005. стр. 67–69
26. Fries J.F., Singh G., Lenert L., Futsr D.E. «Aspirin, hydroxychloroquine, and hepatic enzyme abnormalities with methotrexate in rheumatoid arthritis» Arthr. Rheum, 1990, 33: 1611–1619
27. Farr M., Kitas G.D., Bacon P.A. «Combination chemotherapy in rheumatoid arthritis» Br. J. Rheum., 1987, 27: 73–74
28. Scott D.L., Dwes P.T., Tunn E. et al. «Combination therapy with gold and hydroxichloquine in rheumatoid arthritis: a prospective, randomized, placebo–controlled study» Br. J. Rheum., 28: 128–133
29. Seideman P., Albertoni R., Beck O. et al. «Chloroquine reduced bioavailability of methotrexate in patients with rheumatoid arthritis» Arthr. Rheum., 1993, 37: 830–833
- Увеличить
WestLake SW608 -
Увеличить
WestLake SW608 - Увеличить
WestLake SW608
- Производитель
- WestLake (Китай)
- Группа
- ZC Rubber
- Тип автомобиля
- Легковые автомобили
- Сезонность
- Зимние
- Шипы
- —
- В продаже с
- 2015 г.
- Класс шин
- C
- Расход топлива
- C…E
- Управляемость
- C…C
- Шумность
- 70…73
Описание WestLake SW608
Зимняя легковая шина WestLake SW608 является одной из новейших разработок известнейшего китайского производителя. Отличительной особенностью новинки от шинной индустрии Поднебесной является высокая производительность на любых зимних покрытиях, продолжительный срок службы и, конечно же, крайне привлекательная стоимость.
V-образный дизайн протекторного рисунка
Данная модель создавалась в тесном сотрудничестве с европейскими шинными производителями, свидетельством чему служит V-образный симметричный протекторный рисунок. Он содержит пять продольных ребер отделенных друг от друга широкими дренажными канавками. Такое строение обеспечивает шине отличную курсовую устойчивость на любой скорости. Немало этому способствует и строение центральной части протектора, которая состоит из двух ребер, которые за счет отсутствия каких-либо разрывов обладают высокой жесткостью и стойкостью к динамической деформации.
Прекрасные тягово-сцепные свойства на снегу
Еще одной особенностью протекторного рисунка данной модели является его блочное строение, аналогичное тому, что мы привыкли видеть на зимних шинах ведущих европейских производителей. Протектор содержит множество отдельных блоков, формирующих в процессе движения множество разнонаправленных кромок сцепления. Благодаря этому шина демонстрирует уверенное поведение на снежных покрытиях. Помимо этого в плечевых зонах имеется большое количество так называемых «захватывателей снега». Эти крестообразные канавки обеспечивают дополнительное сцепление на снегу.
Отличное сцепление на льду
Несмотря на отсутствие шипов WestLake SW608 демонстрирует неплохие тягово-сцепные свойства на обледенелых покрытиях. Это стало возможным благодаря специальным ламелям волнообразной формы, расположившимся по всей поверхности протекторного рисунка. В процессе движения они формируют огромное количество дополнительных кромок сцепления, которые, располагаясь в различных направлениях, позволяют уверенно передвигаться по льду.
Основные особенности WestLake SW608
— пять продольных ребер в сочетании с V-образным расположением протекторных элементов обеспечивают отличную курсовую устойчивость, особенно на скользких покрытиях;
— большое количество массивных блоков, благодаря чему шина демонстрирует хорошие тягово-сцепные свойства на снегу;
— быстрые и точные реакции на повороты руля за счет двух жестких продольных ребер, расположенных в центральной части;
— крестообразные канавки в плечевых зонах обеспечивают дополнительное сцепление на снегу;
— хорошее сцепление на льду, благодаря множеству кромок, формируемых в процессе движения многочисленными волнообразными ламелями.

