ОБОСНОВАНИЕ
В настоящее время для лечения остеопороза (ОП) используются разные классы препаратов, эффективность которых доказана в рандомизированных плацебо-контролируемых исследованиях (РКИ). Одним из важных достижений фармакологической промышленности является разработка «таргетных» препаратов, представляющих собой моноклональные антитела к определенным белкам, которые находят все более широкое применение в терапии различных заболеваний. Таким препаратом, зарегистрированным в Российской Федерации в 2011г для лечения ОП, является Деносумаб. Деносумаб представляет собой полностью человеческое моноклоналное антитело к RANK-лиганду и осуществляет свое действие в регуляции цепи RANKL-RANK-OPG, основного регулятора костной резорбции, аналогично остеопротегерину.
Высокая эффективность деносумаба в снижении риска как позвоночных, так и периферических переломов у женщин в постменопаузе продемонстрирована в основном РКИ FREEDOM. В продлённой фазе этого исследования, помимо неуклонного роста минеральной плотности кости (МПК) во всех отделах скелета и стойкого подавления маркеров костного обмена, был также отмечен благоприятный профиль переносимости длительного (10-летнего) лечения деносумабом [1]. В мета-анализе, где сравнивалась эффективность деносумаба и, в основном, пероральных бисфосфонатов (БФ) (только одно исследование с парентеральными БФ) была показана равнозначная эффективность препаратов в отношении риска переломов и сходный профиль безопасности. Однако по силе антирезорбтивного эффекта и степени прироста МПК в позвоночнике, проксимальном отделе бедра (ПОБ) и предплечье деносумаб значимо превосходил БФ [2]. Особенность действия деносумаба на костную ткань заключается в том, что он реализует свое антирезорбтивное действие (препятствует образованию зрелых остеокластов), циркулируя в межклеточной жидкости, не связываясь с гидроксиапатитом костной ткани и не накапливаясь в ней, подобно БФ, что обусловливает отсутствие пролонгированного эффекта препарата и его обратимость. Клинически это может проявляется в быстрой потере МПК, увеличении концентрации маркеров костного метаболизма в крови и развитии переломов в течение первого года после выведения препарата из кровеносного русла [3-5]. Этот феномен получил название «синдром отмены» или «синдром рикошета».
Назначение деносумаба предпочтительно в ряде ситуаций: пациентам с почечной недостаточностью вне зависимости от скорости клубочковой фильтрации, поскольку деносумаб не влияет на почечную функцию [6], при более выраженном снижении МПК в ПОБ или предплечье, где доминирует кортикальная кость [7]. Кроме того, в РКИ показано, что деносумаб, назначенный пациентам, получавшим ранее терапию БФ, способен обеспечить им дополнительный эффект в плане повышения МПК и снижения концентрации маркеров костного метаболизма в большей степени, чем у пациенток, продолжавших лечение БФ, при аналогичном профиле переносимости [8][9]. После прекращения лечения деносумабом при повторном его назначении через 1 год отмечалось увеличение МПК до уровня, который был на момент отмены препарата, и снижение концентрации костных маркеров [10].
В настоящее время продолжаются поиски оптимальных схем и режимов терапии ОП, использующих преимущества тех или иных препаратов для достижения максимальной эффективности лечения. В систематическом обзоре Европейского общества кальцифицированных тканей (European Calcifi es Tissue Society, ECTS) в 2017г было рекомендовано оценивать эффективность терапии деносумабом не менее чем через 3 года, а у пациентов с высоким риском переломов продолжать лечение до 10 лет. При этом, у пациентов, достигших на фоне терапии деносумабом целевых значений Т-критерия в шейке бедра (-2,0 SD) и при отсутствии новых переломов, можно отменить терапию, но для предотвращения потери костной массы и развития переломов необходимо рассмотреть назначение БФ [11]. Аналогичная позиция в отношении тактики ведения пациентов была принята отечественными экспертами. Рекомендовано через 6 месяцев после прекращения лечения деносумабом (6 месяцев от последней инъекции) всем пациентам назначать таблетированные БФ или золедроновую кислоту. При назначении золедроновой кислоты требуется дополнительный перерыв до 65 дней [12].
Показаниями для назначения деносумаба являются: а) лечение постменопаузального ОП и ОП у мужчин при повышенном риске переломов; б) лечение потери костной массы у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы, и у мужчин с раком предстательной железы, получающих гормон-депривационную терапию, при повышенном риске переломов; в) лечение потери костной массы, связанной с длительной терапией системными глюкокортикоидами, у взрослых пациентов при повышенном риске переломов.
Возможные различия в результатах спланированных РКИ и реальной клинической практики побудили нас проанализировать длительную терапию деносумабом у пациенток с ОП различного генеза и сопутствующими заболеваниями.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить эффективность длительного приема деносумаба по влиянию на МПК и маркеры костного метаболизма, переносимость и последствия отмены препарата у пациенток с ОП различной этиологии.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. ФГБУ «Национальный медицинский исследовательский центр терапии и профилактической медицины» МЗ РФ (НМИЦ ТПМ).
Время исследования. Январь 2010 – декабрь 2020.
Изучаемые популяции (одна или несколько)
Популяция женщин из числа обратившихся в консультативное отделение НМИЦ ТПМ с целью диагностики и лечения ОП.
Критерии включения:
- женский пол;
- установленной диагноз ОП различной этиологии;
- регулярное введение деносумаба 60 мг 1 раз в 6 месяцев подкожно за период от 1 до 10 лет (минимум 2 инъекции).
Критерии исключения: пропуск введения очередной дозы препарата.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Произвольный.
Дизайн исследования
Одноцентровое одновыборочное интервенционное динамическое ретроспективное исследование. Проведен ретроспективно анализ амбулаторных карт женщин с ОП, которым было назначено лечение деносумабом и продолжалось в течение от 1 до 10 лет.
Методы
Всем пациенткам проводились: осмотр и антропометрическое исследование; оценка риска переломов с использование калькулятора FRAX перед началом терапии; опрос о наличии нежелательных явлений; двухэнергетическая рентгеновская абсорбциометрия (DXA) поясничного отдела позвоночника (L1-L4) в задне-передней проекции и ПОБ на аппаратах Hologic Delpfi W (США) и Lunar Expert (США). Диагноз «остеопороз» устанавливали согласно классификации ВОЗ при Т-критерии -2,5 SD и ниже. Измерения в динамике выполнялись 1 раз в год на одном и том же приборе. Была проведена перекрестная калибровка оборудования, показатели МПК были унифицированы и приведены к показателям, используемым в базе Hologic с помощью поправочных коэффициентов. Определение общего кальция, общей щелочной фосфатазы и креатинина проводилось на биохимическом анализаторе Architectc8000 (Abbott, США). Маркер костной резорбции С-концевой телопептид коллагена 1 типа (СТх) исследовали в сыворотке крови методом твердофазного иммуноферментного анализа (β-crosslaps).
Статистический анализ
Статистическая обработка результатов проводилась при помощи программы SPSS 20.0 с использованием общепринятых методов параметрического и непараметрического анализа. Количественные переменные описывались числом параметров, средним арифметическим значением (М), стандартным отклонением от среднего арифметического значения (SD). Качественные переменные описывались абсолютными и относительными частотами (процентами). Достоверность различий между показателями оценивали с помощью стандартных критериев значимости: χ² Пирсона, парный и непарный критерий Стьюдента. Для параметров, распределение которых отличалось от нормального, использовали непараметрические тесты: при сравнении двух групп использовали парный корреляционный анализ по методу Спирмена, с определением двухсторонней значимости показателей. Различия считались статистически значимыми при р<0,05.
Этическая экспертиза
Исследование основано на ретроспективном анализе амбулаторных карт пациентов, которые официально получали консультацию в поликлинических условиях и назначение препарата согласно показаниям и установленному диагнозу, что не предусматривает этической экспертизы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После отбора амбулаторных карт согласно принятым критериям, в исследование было включено 148 женщин, регулярно принимавших деносумаб 60 мг 1 раз в 6 месяцев в течение периода от 1 до 10 лет. Только 4 пациентки получили инъекции через больший интервал времени (8-10 месяцев). 2 пациентки начали лечение деносумабом в других странах до регистрации препарата в РФ, а наблюдение проводилось в ФГБУ «НМИЦ ТПМ» МЗ РФ.
Для повышения эффективности и безопасности лечения, до начала терапии всем была определена концентрация витамина D (25(ОН)D) в сыворотке крови, после чего пациенткам с его недостаточностью или дефицитом проведено насыщение, согласно рекомендациям Российского общества по остеопорозу и Эндокринологического общества (50 000 МЕ в неделю в течение 4-8 недель) с последующим переходом на поддерживающий прием (800-2000 МЕ/сут) в зависимости от степени недостаточности витамина D. Также все пациенты принимали препараты кальция, его суточное потребление составляло не менее 1000-1200 мг [13][14].
Были выявлены следующие сопутствующие хронические заболевания: сахарный диабет 2 типа у 16 человек; язвенная болезнь желудка или 12-ти перстной кишки в стадии ремиссии у 14; целиалкия у 2; синдром «раздражённого кишечника» у 2; гипертоническая болезнь у 61; различные нарушения ритма сердца у 23; ИБС у 34; заболевания почек с клиренсом креатинина ≤30 мл/мин у 8; гипотиреоз, требующий приёма левотироксина в максимальной дозе 75 мкг, у 14 человек; 6 женщин принимали ингибиторы ароматазы после мастэктомии по поводу рака молочной железы. Глюкокортикоидный ОП выявлен у 6 человек с ревматоидным артритом, у 2 с бронхиальной астмой и у 1 с миастенией.
Все пациентки были разделены на 2 группы: 1 группа – не принимали антиостеопоретическую терапию (АТ) до назначения деносумаба, 2 группа – принимали ранее АТ. Почти все пациентки из 2 группы принимали до начала лечения деносумабом БФ в среднем 2,5 года и только четверо получали ранелат стронция или миакальцик в течение 3-4 лет. Среди них 70% получали пероральные БФ, 30% – парентеральные (золедроновую и ибадроновую кислоту). Смена терапии была обусловлена снижением МПК на фоне отмены препаратов или отсутствием положительной динамики МПК при приеме БФ, а также при развитии новых переломов. Медиана 10-летней вероятности основных переломов по FRAX у 98 пациенток, не получавших ранее АТ, составила 19,4 %, перелома шейки бедра (ШБ) – 4,9%, т.е. в исследование были включены пациенты с высоким и очень высоким риском переломов.
Общая характеристика пациентов представлена в таблице 1. Средний возраст пациенток составил 65,4±8,9 лет. Пациенты обеих групп были сопоставимы по основным параметрам на базовом уровне перед началом лечения деносумабом.
Таблица 1. Клинико-инструментальная характеристика пациенток.
|
Параметр |
Общая группа (n=148) М±SD |
1 группа (n=98) М±SD |
2 группа (n=50) М±SD |
р |
|
Возраст, лет |
65,4 ± 8,9 |
66,2 ± 8,7 |
63,3 ± 8,8 |
0,15 |
|
Возраст менопаузы, лет |
49,2 ± 2,4 |
49,5 ± 2,5 |
48,6 ± 2,06 |
0,52 |
|
Возраст установленного диагноза ОП, лет |
59,3 ± 8,9 |
61,3 ± 9,0 |
55,3 ± 7,3 |
0,06 |
|
Т-критерий L1-L4, SD |
-3,1 ± 1,05 |
-3,07 ± 1,02 |
-3,27 ± 1,10 |
0,27 |
|
МПК L1-L4, г/см2 |
0,724 ± 0,13 |
0,719 ± 0,12 |
0,735 ± 0,15 |
0,50 |
|
Т-критерий ШБ, SD |
-2,3 ± 0,62 |
-2,28 ± 0,58 |
-2,4 ± 0,67 |
0,14 |
|
МПК ШБ, г/см2 |
0,618 ± 0,11 |
0,610 ± 0,12 |
0,634± 0,08 |
0,22 |
|
Т-критерий ПОБ (Total), SD |
-1,8 ± 0,66 |
-1,7 ± 0,65 |
-1,9 ± 0,66 |
0,22 |
|
МПК ПОБ (Total), г/см2 |
0,728 ± 0,09 |
0,733 ± 0,09 |
0,720 ± 0,09 |
0,45 |
|
Обще количество переломов, n |
139 |
85 |
54 |
0,09 |
|
Переломы позвонков, n |
65 (46,7%) |
36 (42,4%) |
29 (53,7%) |
0,25 |
|
Переломы бедра, n |
6 (4,3%) |
4 (4,7%) |
2 (3,7%) |
0,88 |
|
Переломы лучевой кости, n |
41 (29,5%) |
25 (29,4%) |
16 (29,6%) |
0,62 |
|
Другие переломы (ребра, голеностоп, локтевая кость), n |
27 (19,4%) |
20 (23,5%) |
7 (13%) |
0,51 |
|
Креатинин, мкмоль/л |
87 ± 8,2 |
86 ± 7,8 |
88 ± 9,6 |
0,64 |
|
Кальций общий, ммоль/л |
2,45 ± 0,08 |
2,46 ± 0,09 |
2,43 ± 0,07 |
0,52 |
|
Общая щелочная фосфатаза, Ед/л |
84 ± 19 |
85 ± 22 |
82 ± 18 |
0, 61 |
|
СТx в сыворотке крови, нг/мл |
0,520 ± 0,29 |
0,544 ± 0,28 |
0,470 ± 0,29 |
0,17 |
Примечание: p – между 1 и 2 группой; ОП – остеопороз; SD – стандартное отклонение; МПК – минеральная плотность кости; ШБ – шейка бедра; ПОБ – проксимальный отдел бедра; СТx – С-концевой телопептид коллагена 1 типа.
Динамика МПК и маркера костной резорбции СТx была прослежена на протяжении разного периода времени: от 1 до 10 лет. За весь период наблюдения отмечался неуклонный достоверный прирост МПК во всех обследованных участках скелета (рис. 1).
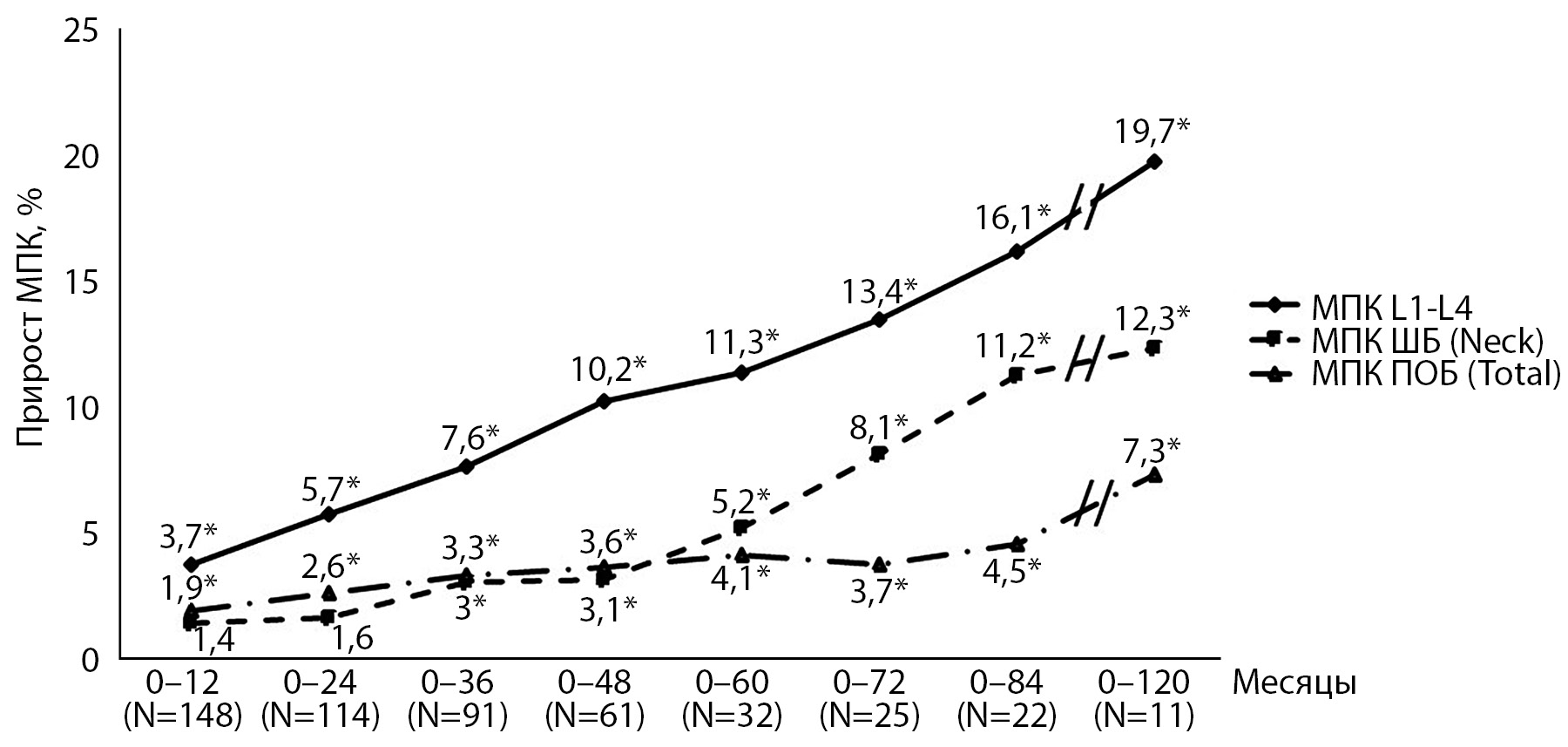
Рис. 1. Динамика МПК за период наблюдения.
Примечание: * – p<0,001 в сравнении с базовым измерением МПК.
У 11 пациенток, наиболее длительно принимавших терапию деносумабом (9,3 года), прирост МПК был максимальным и составил в позвоночнике 19,7%, в ШБ – 12,3%. Эти результаты согласуются с данными продленной фазы исследования FREEDOM, наблюдавшей 4550 пациенток, продолживших прием деносумаба в течение еще 7 лет после основного 3-х летнего лечения, где прирост МПК за 10 лет в позвоночнике составил 21,7%, в ШБ – 9,0% [1].
Прослежена динамика МПК у пациенток с подтвержденным ОП в отдельных участках скелета. По результатам DXA позвоночника, среди 148 человек, низкие значения МПК по Т-критерию (ниже -2,5 SD) выявлены у 120 человек, медиана Т-критерия составила —3,1 SD. За период наблюдения у 62 (54%) пациенток показатели МПК в позвоночнике достигли значений, соответствующих остеопении. У 58 пациентов МПК в позвоночнике сохранялась по Т-критерию ниже -2,5 SD. До начала лечения Т-критерий у них для области позвоночника был более низким, чем у пациенток, достигших остеопении, его медиана составила -3,9 SD и повысилась через 36 месяцев до -3,5 SD. Повышение МПК у этой категории пациентов было достоверным и расценивалось как положительная динамика, несмотря на отсутствие перехода в зону остеопении. У 69 пациенток были выявлены низкие значения МПК по Т-критерию (ниже -2,5 SD) в ШБ. За весь период наблюдения 30 (43,4%) женщин достигли целевых значений МПК в ШБ (Т-критерий -2,0 SD и выше).
Также были проанализированы изменения МПК у пациенток, принимавших и не принимавших АТ (табл. 2). До начала лечения деносумабом показатели МПК по Т-критерию как в позвоночнике, так и в ШБ в обеих группах не различались.
Таблица 2. Динамика МПК у пациенток, принимавших и не принимавших препараты для лечения ОП до назначения деносумаба.
|
Период |
L1-L4 |
Neck (шейка бедра) |
||||||
|
1 группа |
2 группа |
p |
1 группа |
2 группа |
p |
|||
|
T-Критерий, SD |
n |
Т-критерий, SD |
n |
Т-критерий, SD |
Т-критерий, SD |
|||
|
0 |
-3,10 |
97 |
-3,2 |
51 |
0,27 |
-2,28 |
-2,44 |
0,14 |
|
12 |
-2,79 |
97 |
-3,0 |
51 |
0,22 |
-2,16 |
-2,35 |
0,05 |
|
24 |
-2,61 |
77 |
-2,77 |
37 |
0,32 |
-2,06 |
-2,27 |
0,05 |
|
36 |
-2,59 |
65 |
-2,63 |
26 |
0,41 |
-2,01 |
-2,21 |
0,14 |
|
48 |
-2,66 |
39 |
-2,55 |
22 |
0,15 |
-2,14 |
-2,22 |
0,57 |
|
60 |
-2,38 |
22 |
-2,46 |
10 |
0,21 |
-2,02 |
-2,11 |
0,55 |
|
72 |
-2,24 |
17 |
-2,32 |
8 |
0,23 |
-2,08 |
-1,91 |
0,26 |
|
84-96 |
-2,22 |
14 |
-2,30 |
8 |
0,56 |
-1,82 |
-1,81 |
0,17 |
Динамика СТх на фоне лечения деносумабом у пациенток, не принимавших и принимавших АТ, представлена на рисунке 2. Через 6 месяцев после начала терапии деносумабом наблюдалось выраженное снижение этого показателя на 48% (р<0,001) как у не принимавших, так и у принимавших ранее препараты для лечения ОП, а через 12 месяцев – на 67% (р<0,001) у не принимавших и на 58% (р<0,001) у получавших ранее АТ. Различий между группами не выявлено.
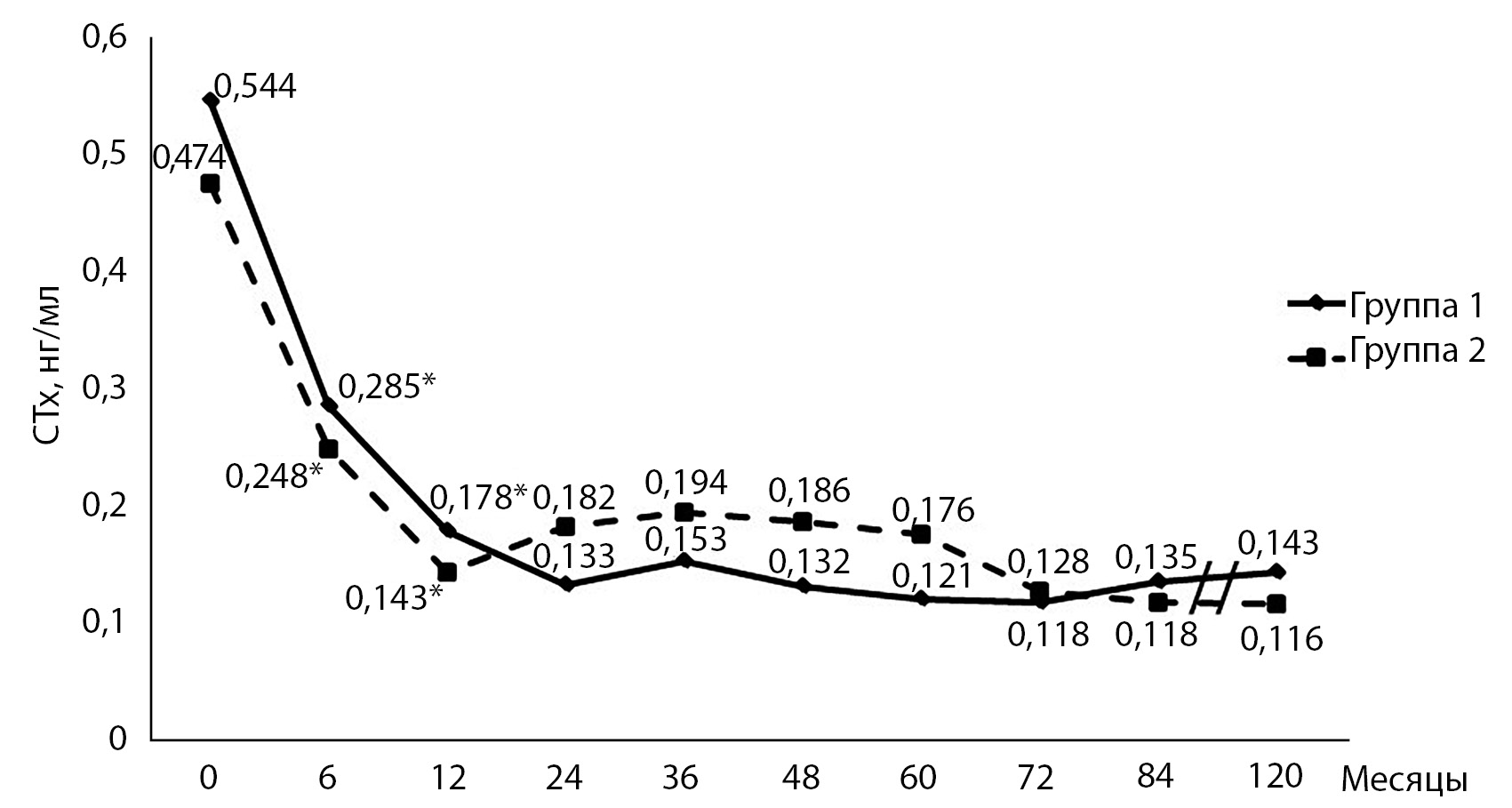
Рис. 2. Динамика СТх у пациенток, не принимавших и принимавших антиостеопорозную терапию до начала лечения деносумабом.
Примечание: * – р<0,001 между значениями CTx внутри группы.
У всех пациенток уровни общего кальция, общей щелочной фосфатазы и креатинина на момент включения в исследование находились в пределах референсных значений, за период наблюдения клинически значимых достоверных изменений этих показателей не наблюдалось.
За период наблюдения рентгенологически подтверждённые переломы позвонков были выявлены у 3-х пациенток в первые четыре месяца терапии. Следует отметить, что у этих пациенток наблюдались очень низкие значения МПК в позвоночнике и Т-критерий у них составил -3,7, -4,9, -5,0 SD. У одной пациентки произошел перелом лучевой кости, также в первый год терапии. Переломов ШБ и других периферических переломов зарегистрировано не было. В другом исследовании, где оценивалось применение деносумаба в реальной клинической практике, было отмечено, что статистически значимое снижение частоты переломов на фоне терапии деносумабом (на 51%; 95% ДИ 42-59%) наблюдалось к концу 12 месяцев терапии, по сравнению с первыми тремя месяцами после её начала [15].
Переносимость терапии деносумабом была хорошая, не было зарегистрировано отмены препарата по причине нежелательных явлений. Результаты данного исследования согласовывались с исследованием Рожинской Л.Я. и соавт., в котором безопасность лечения деносумабом наряду со значимым повышением МПК в позвоночнике, ПОБ и лучевой кости была продемонстрирована у пациенток с постменопаузальным, глюкокортикоидным ОП и снижением костной массы на фоне первичного гиперпаратиреоза [16].
По данным проведенных РКИ, выявлено, что у тех пациенток, которым после отмены деносумаба не была назначена терапия БФ, отмечается потеря МПК уже в течение первого года. Так, в исследовании рost-FREEDOM потеря МПК в позвоночнике у таких пациенток составила 8,1%, в ШБ – 6 %, в бедре в целом – 8,4%, а в среднем в течение первого года после прекращения терапии потеря МПК во всех участках скелета составляла 5–11% [17]. А в РКИ II фазы с участием 674 женщин, отмена деносумаба после 4-х летнего приёма, на фоне которого наблюдалось увеличение МПК поясничного отдела позвоночника с 9,4% до 11,8%, бедра с 4,0% до 6,1%, привела к снижению МПК на 6,6% в поясничном отделе позвоночника и на 5,3% в ПОБ также в течение первых 12 месяцев после прекращения лечения. При возобновлении терапии деносумабом МПК поясничного отдела позвоночника вновь увеличилась на 9,0%. Изменения МПК сопровождались соответствующей динамикой концентрации костных маркеров в крови: повышением их на фоне отмены препарата и снижением при возобновлении терапии [9].
В нашем исследовании 4 пациентки, получавшие деносумаб в течение 3-х лет и достигшие целевых значений МПК в ШБ (Т-критерий ≥-2 SD), для закрепления полученного эффекта принимали алендронат 70 мг в неделю в течение 3-6 месяцев и отменили самостоятельно из-за появления нежелательных эффектов со стороны ЖКТ (изжога, боль в эпигастрии, эрозивный гастрит). Пациенты также прекратили прием кальция и витамина D. При повторной денситометрии через год после отмены деносумаба потеря МПК в позвоночнике составила 4,4-8,2%, что послужило причиной возобновления терапии деносумабом, на фоне которой через 12 месяцев у всех пациенток наблюдалось увеличение МПК в позвоночнике на 4,3-6,8%.
У 5 пациенток после достижения целевых значений МПК в ШБ и дальнейшем назначении инфузии Акласты через 6 месяцев +65 дней, спустя год после введения препарата отмечалось недостоверное снижение МПК на 2,5% в позвоночнике и на 1% в ШБ, переломов не зафиксировано. Пациенты находятся под наблюдением и продолжают принимать кальций и витамин D в поддерживающих дозах.
Динамика МПК также была прослежена у 6 пациенток, которые отменили введение деносумаба после 2-4 инъекций по разным причинам, в том числе связанным с заболеванием новой коронавирусной инфекцией. Пациенты продолжали принимать препараты кальция и витамина D. При измерении МПК через 16-18 месяцев после последней инъекции отмечалось снижение костной массы на 4-8,5% в позвоночнике и на 1,5-2% в ШБ. У 1 пациентки произошел перелом позвонка при падении с высоты своего роста.
Таким образом, в результате проведенного анализа длительной терапии деносумабом у женщин в постменопаузе можно сделать следующие выводы:
У пациентов с различными сопутствующими заболеваниями, способствующими снижению костной массы или не влияющими на нее, отмечался значимый прирост МПК в позвоночнике и ПОБ, а также снижение маркера костной резорбции СТх, что отражает выраженный антирезорбтивный эффект препарата.
В течение длительного периода введения препарата (максимально допустимого) не было отмечено нежелательных эффектов, повлекших отмену препарата.
Сравнение групп пациентов, получающих и не получающих антиостеопорозную терапию до назначения деносумаба, не выявило различий в динамике МПК, маркера костной резорбции СТх и переносимости препарата.
Единичные случаи отмены препарата не позволили провести полноценную статистическую обработку и показать частоту новых переломов, однако был подтвержден эффект отмены препарата, заключающийся в быстром снижении МПК и повышении СТх.
Назначение БФ после отмены деносумаба не сохраняло МПК на достигнутом уровне, но снижало скорость потерь костной массы.
ЗАКЛЮЧЕНИЕ
Опыт применения деносумаба в амбулаторной практике подтвердил высокую эффективность и хорошую переносимость длительного применения препарата у пациенток с ОП различного генеза. Терапия деносумабом эффективно повышала МПК в обследованных участках скелета как у нелеченых пациенток, так и у тех, кто ранее получал АТ. Выраженное снижением уровня СTx свидетельствует о мощной антирезорбтивной активности препарата. Однако, учитывая механизм действия деносумаба, пациент должен быть проинформирован о риске возникновения «синдрома рикошета» при нарушении режима лечения и самостоятельной отмене препарата. При необходимости прекращения терапии деносумабом пациент обязательно должен проконсультироваться с врачом и обсудить возможные варианты дальнейшей тактики ведения.
Ограничения исследования
Небольшое число женщин, прослеженных после прекращения лечения деносумабом, не позволило статистически обосновано оценить эффекты отмены препарата и поэтому этот фрагмент носит описательный характер.
Направления дальнейших исследований
Перспективы дальнейшего развития темы заключаются в наблюдении за пациентами, которые прекратили терапию деносумабом, и оценке динамики МПК и переломов в разные сроки после отмены препарата.
Список литературы
1. Bone HG, Wagman RB, Brandi ML, et al. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol. 2017;5(7):513-523. https://doi.org/10.1016/S2213-8587(17)30138-9
2. Wu J, Zhang Q, Yan G, et al. Denosumab compared to bisphosphonates to treat postmenopausal osteoporosis: a meta-analysis. J Orthop Sur and Res. 2018;13(1):194. https://doi.org/10.1186/s13018-018-0865-3
3. Tsourd E, Zillikens MC. Certainties and Uncertainties About Denosumab Discontinuation. Calcif Tissue Int. 2018;103(1):1-4. https://doi.org/10.1007/s00223-018-0436-y
4. Brown JP, Dempster DW, Ding B, et al. Bone remodeling in postmenopausal women who discontinued denosumab treatment: Off-treatment biopsy study. J Bone Miner Res. 2011;26(11):2737-2744. https://doi.org/10.1002/jbmr.448
5. Anastasilakis AD, Makras P. Multiple clinical vertebral fractures following denosumab discontinuation. Osteoporos Int. 2016; 27(5):1929-1930. https://doi.org/10.1007/s00198-015-3459-5
6. Block GA, Bone HG, Fang L, et al. A single-dose study of denosumab in patients with various degrees of renal impairment. J Bone Miner Res. 2012;27(7):1471-1479. https://doi.org/10.1002/jbmr.1613
7. Bolognese MA, Teglbjærg CS, Zanchetta JR, et al. Denosumab significantly increases DXA BMD at both trabecular and cortical sites: results from the FREEDOM study. J Clin Densitom. 2013;16(2):147-153. https://doi.org/10.1016/j.jocd.2012.02.006
8. Muschitz C, Fahrleitner-Pammer A, Huber J, et al. Update on denosumab in postmenopausal osteoporosis—recent clinical data. Wien Med Wochenschr. 2012;162(17-18):374-379. https://doi.org/10.1007/s10354-012-0116-x
9. Kendler DL, Roux C, Benhamou CL, et al. Effects of denosumab on bone mineral density and bone turnover in postmenopausal women transitioning from alendronate therapy. J Bone Miner Res. 2010;25(1):72-81. https://doi.org/10.1359/jbmr.090716
10. Miller PD, Bolognese MA, Lewiecki EM, et al. Amg Bone Loss Study Group. Effect of denosumab on bone density and turnover inpostmenopausal women with low bone massafter long-term continued, discontinued, and restarting of therapy: a randomized blinded phase 2 clinical trial. Bone. 2008;43(2):222-229. https://doi.org/10.1016/j.bone.2008.04.007
11. Tsourdi E, Langdahl B, Cohen-Solal, et al. Discontinuation of Denosumab therapy for osteoporosis: A systematic review and position statement by ECTS. Bone. 2017;105:11-17. https://doi.org/10.1016/j.bone.2017.08.003
12. Белая Ж.Е., Bilezikian J.P., Ершова О.Б., и др. Возможности длительной терапии постменопаузального остеопороза: обзор результатов исследований деносумаба и резолюция совета экспертов российской ассоциации по остеопорозу (РАОП) // Остеопороз и остеопатии. — 2018. — T. 21. — № 1. — C. 17-22. https://doi.org/10.14341/osteo9760
13. Рекомендации Российской ассоциации по остеопорозу. Профилактика, диагностика и лечение дефицита витамина D и кальция среди взрослого населения и у пациентов с остеопорозом. M.: ГЭОТАР-Медиа, 2016.
14. Пигарова Е.А., Рожинская Л.Я., Белая Ж.Е., и др. Клинические рекомендации Российской ассоциации эндокринологов по диагностике, лечению и профилактике дефицита витамина D у взрослых // Проблемы Эндокринологии. — 2016. — Т. 62. № 4. — С. 60-84. https://doi.org/10.14341/probl201662460-84
15. Yusuf АА, Cummings SR, Nelson B, et al. Real-world effectiveness of osteoporosis therapies for fracture reduction in postmenopausal women. Arch of Osteoporos. 2018;13(1):32-42. https://doi.org/10.1007/s11657-018-0439-3
16. Рожинская Л.Я., Гронская С.А., Мамедова Е.О., и др. Применение деносумаба для лечения остеопороза различного генеза в клинической практике // Остеопороз и остеопатии. 2020. — Т. 23. — №1. — С. 4-13. https://doi.org/10.14341/osteo12415
17. Zanchetta MB, Boailchuk J, Massari F, et al. Significant bone loss after stopping long-term denosumab treatment: a post FREEDOM study. Osteoporos Int. 2018;29(1):41-47. https://doi.org/10.1007/s00198-017-4242-6
Швейцарские врачи бьют тревогу — популярный препарат против остеопороза деносумаб (Пролиа) после прекращения терапии может вызывать парадоксальный эффект отмены.
Сомнительная безопасность терапии
С 2015 года клиницисты стали подозревать, что деносумаб ассоциирован с появлением боли в костях и повышением риска спонтанных переломов позвонков после завершения курса терапии.
После отмены препарата у пациентов отмечается повышение маркеров костного ремоделирования и быстрое снижение минеральной плотности костной ткани.
- Результаты исследований показывают, что после окончания терапии деносумабом костная резорбция быстро восстанавливается и ее активность в течение 12 месяцев после последней инъекции выше в 2 раза, чем до терапии.
- Швейцарский фармакологический надзор, Swissmedic, продолжает расследование по безопасности терапии. Это уже нашло отражение — в 2017 году изменена инструкция к препарату Пролиа.
Комментарии разных сторон
- Компания-производитель деносумаба — Amgen, отказывается давать комментарии журналистам. Представители компании заявляют, что повышение риска переломов по окончанию терапии является для них большим сюрпризом. Как такое возможно, говорят они, ведь препарат призван бороться с остеопорозом и имеет большое преимущество перед другими лекарствами — он вводится всего 1 раз в 6 месяцев.
- А вот мнение специалистов в области клинической фармакологии прямо противоположно. Так, профессор Университетской Клиники в Лозанне, Thierry Buclin, отмечает, что это напоминает скандальную историю с противодиабетическим препаратом Медиатор, который использовался у пациентов с сахарным диабетом в качестве средства уменьшающего массу тела. Препарат на протяжении длительного периода применялся во Франции, хотя на фоне терапии были неоднократно зафиксированы признаки вальвулопатии. После длительной тяжбы выяснилось, что основной компонент Медиатор относится к группе амфетаминов, которые являются сильнейшими психостимуляторами, что и объяснило большое число нежелательных реакций, в том числе и со стороны сердца.
Швейцарские врачи надеются, что в компании Amgen задумаются о безопасности терапии и проведут дополнительные исследования.
Источники:
Olivier Lamy, Elena Gonzalez-Rodriguez, Delphine Stoll, Bérengère Aubry-Rozier. Rev Med Suisse 2017; volume 13. 863-866.
Juliette Galeazzi. L’ostéoporose au coeur d’un scandale découvert à Lausanne. www.rts.ch
Остеопоротические переломы являются основной причиной нарушения функциональных возможностей пациентов с остеопорозом (ОП) и высокой стоимости лечения данного заболевания. Так, по данным нашего исследования усредненная стоимость лечения при осложненном течении ОП в течение одного года после перелома достигала 61 151 рубля, при этом 44% приходилось на госпитальные затраты, 12% — на социальные выплаты и всего 7% — на противоостеопоротические препараты, что связано с их редким назначением врачами первичного звена здравоохранения и низкой приверженностью больных медикаментозной терапии [1]. Одними из важнейших показателей приверженности лечению являются настойчивость в лечении (прием препарата в течение всего назначенного периода) и соблюдение режима дозирования. Несоблюдение рекомендаций по длительности лечения и режима дозирования приводит к снижению эффективности лечения любым противоостеопоротическим препаратом и увеличивает риск переломов у пациентов с ОП на 17–39% [2–4]. На приверженность лечению у больных хроническими заболеваниями влияют не только его эффективность и безопасность, но и способ введения, а также частота приема препарата.
В настоящее время для лечения ОП применяется генно-инженерный препарат для подкожного введения с режимом дозирования 1 раз в 6 месяцев — деносумаб, представляющий из себя полное человеческое моноклональное антитело. Он уменьшает костную резорбцию за счет снижения созревания, функционирования и выживания остеокластов — клеток, ответственных за разрушение старой кости в организме.
Цель работы: оценить эффективность, переносимость и приверженность лечению у женщин с постменопаузальным остеопорозом, начавших лечение деносумабом в ходе проспективного наблюдения в клинической практике.
Материал и методы исследования
В наблюдение включены 48 женщин в постменопаузе (средний возраст 65,2 ± 9,1 года), у которых диагностирован ОП по критериям ВОЗ хотя бы в одном из отделов осевого скелета (Т-критерий ≤ –2,5 стандартных отклонения (СО) или остеопения (–1 СО < Т-критерий < –2,5 СО) при наличии в анамнезе перелома при низком уровне травмы в возрасте после 40 лет и которым в ФГБНУ НИИР им. В. А. Насоновой (Центр остеопороза МЗ РФ) было рекомендовано лечение деносумабом. Набор пациентов осуществлялся с апреля 2013 по март 2014 г. В исследование вошли 16 (33,3%) женщин с впервые диагностированным ОП и 32 (66,7%) — у которых диагноз был поставлен ранее (средняя длительность заболевания 4,9 ± 1,7 года). Всем пациенткам в начале исследования и каждые последующие полгода делался анализ крови на кальций, креатинин и щелочную фосфатазу. Кроме того, всем женщинам проведено исследование уровня витамина D, при выявлении его дефицита всем пациенткам рекомендовался прием 50 000 МЕ колекальциферола, а в последующем доза его составляла 2000 МЕ. Все женщины дополнительно получали препараты кальция (500–1000 мг/день) и витамина D (800–2000 МЕ).
Подкожное введение препарата в течение первого года 1 раз в 6 месяцев проводилось в процедурном кабинете консультативного отделения ФГБНУ НИИР им. В. А. Насоновой. Остальные инъекции могли быть сделаны как в Институте, так и самостоятельно или по месту жительства. При последующем приходе в клинику пациентка приносила упаковку препарата с датой его введения.
Эффективность оценивалась по динамике минимальной плотности кости (МПК) в трех отделах скелета (поясничный отдел позвоночника, проксимальный отдел бедра и дистальный отдел предплечья не доминантной руки). Переломы регистрировались как нежелательное явление. Характеристика женщин представлена в табл. 1.

Приверженность терапии оценивалась по двум параметрам: настойчивость пациента, которая считалась приемлемой, если вторая инъекция делалась в пределах 6 месяцев + 8 недель после предыдущего введения; и соблюдение режима дозирования, если последующая инъекция делалась в пределах 6 месяцев ± 4 недели после предыдущего введения.
Для включения в программу наблюдения все пациентки подписали информированное согласие на обработку обезличенных данных их медицинской документации.
Статистическую обработку проводили с помощью пакета прикладных программ Statistica for Windows 8.0 StatSoft с использованием параметрических и непараметрических методов сравнения. Статистически значимыми считались различия при р < 0,05.
Результаты и обсуждение
Динамика МПК на фоне лечения через 6, 12 и 24 месяца наблюдения представлена в табл. 2. Нами был отмечен достоверный прирост МПК в осевом скелете (позвоночнике и проксимальном отделе бедра), который наблюдался уже через 6 месяцев наблюдения. В дистальном отделе предплечья статистически значимое увеличение МПК наблюдалось через 2 года после начала терапии деносумабом.
При анализе динамики показателей МПК у женщин, получавших какую-либо противоостеопоротическую терапию до назначения деносумаба, и в группе «наивных» пациентов (без предшествующего лечения ОП) не было получено достоверных различий между этими пациентами ни по одной области измерения МПК. Также нами не выявлены различия в динамике МПК при статистической обработке отдельно по каждой группе препаратов, которые они принимали в течение последнего года до включения в проспективное наблюдение, по сравнению с «наивными» больными. В то же время следует отметить, что в течение первого года лечения наиболее низкой в среднем динамика МПК была у лиц, принимавших бисфосфонаты 3 и более лет до перевода их на деносумаб, однако достоверные различия получены были только для прироста МПК поясничного отдела позвоночника (р = 0,05), что согласуется с данными D. L. Kendler и соавт., которые показали, что увеличение МПК у женщин с постменопаузальным ОП зависело от длительности предшествующего лечения бисфосфонатами [5]. В то же время через 2 года лечения эти различия практически нивелировались (рис. 1).

Не было получено различий в динамике МПК в зависимости от исходного уровня витамина D в сыворотке крови.
За время наблюдения случаев гипокальциемии зафиксировано не было, средний уровень кальция в крови во всей группе статистически значимо не изменился.
На фоне лечения во всей группе выявлено достоверное снижение уровня общей щелочной фосфатазы уже через 6 месяцев, при этом наиболее выражено, хотя и статистически недостоверно, оно было у «наивных» пациенток по сравнению с женщинами, получавшими бисфосфонаты до начала терапии деносумабом (на 23% и 9% соответственно, p > 0,05). Уровень щелочной фосфатазы оставался более низким по сравнению с его значениями на момент включения больных в исследование и при контроле через 12 и 24 месяца терапии, что косвенно может служить доказательством снижения костного обмена на фоне проводимого лечения, при этом оно наиболее выражено было у лиц, впервые начавших терапию деносумабом.
Показатели креатинина за весь период наблюдения достоверно не изменялись (табл. 3).
За двухлетний период не было случаев периферических переломов или переломов позвоночника, манифестирующих выраженным острым болевым синдромом, при низком уровне травмы. Показатели роста у пациентов оставались стабильными, не было зафиксировано снижения роста на 2 см и более ни у одной из участниц данного исследования. Одна больная сообщила о высыпаниях на коже через месяц после первой инъекции, однако связь с подкожным введением деносумаба врач отметил как сомнительную. При повторном введении препарата кожных высыпаний не было.
В первый год наблюдения 44 (92%) больных получили вторую подкожную инъекцию деносумаба в течение 6 месяцев + 8 недель после первого введения и были отнесены к настойчивым пациентам. Режим дозирования выполнили 43 (90%) женщины. Четыре женщины сделали только по одному введению препарата, а затем отказались продолжить лечение, что было связано с высокой его стоимостью.
Три инъекции получили 42 (87,5%) пациентки, а четыре — 39 (81,25%). Все пациентки сделали инъекции также в период 6 месяцев ± 4 недели после предыдущего введения, таким образом, они были настойчивыми и соблюли режим дозирования. В течение второго года от продолжения терапии деносумабом отказались 4 женщины, что также было связано с невозможностью приобретения препарата по экономическим причинам (3 человека) или улучшением показателей МПК до уровня остеопении и отсутствием переломов в анамнезе (1 пациентка). Таким образом, 92% больных были привержены терапии ОП в течение года, а чуть более 81% — в течение двух лет терапии деносумабом. Наши данные согласуются с результатами, полученными в четырех странах Европы (Германия, Австрия, Греция и Бельгия), в которых приверженность составила 87–95,3% в течение года после выданных больному рекомендаций [6]. В то же время на более большой когорте больных из Германии данный показатель был ниже и составил через год 55,9% и 39,8% соответственно через 1 и 2 года лечения для деносумаба и 33,8% и 20,9% для золедроновой кислоты [7]. Возможно, более высокий показатель приверженности у наших больных связан с тем, что пациентки наблюдались в специализированном Центре остеопороза, что могло повлиять на полученные нами результаты.
Нами проведен одновариантный анализ факторов, которые потенциально могли воздействовать на приверженность лечению в течение 24 месяцев, однако мы не получили связи ни с одним из них (возраст, семейное положение, уровень образования, время на дорогу до клиники, наличие переломов бедра у родителей, переломы в анамнезе и их локализация, длительность ОП и предшествующая его терапия, значение Т-критерия в любой из измеренных областей скелета не выявили их влияния на приверженность лечению в течение 12 месяцев).
Таким образом, деносумаб эффективное и безопасное средство для лечения больных с постменопаузальным ОП с хорошей приверженностью пациентов в течение двухлетнего периода.
Клинический случай
Больная М. М. Ю., 1940 года рождения, впервые обратилась в Центр остеопороза НИИР им. В. А. Насоновой в 2004 г. с жалобами на выраженные боли в грудном и поясничном отделах позвоночника, усиливающие при статической нагрузке. Менопауза в 50 лет. Переломов не было. В анамнезе узловой зоб и аутоиммунный тиреоидит (эутиреоидное состояние). Наследственность: у отца — перелом лодыжки в возрасте после 50 лет, переломов бедра у родственников I степени родства не было. Проведено денситометрическое обследование аксиальных отделов скелета, МПК (по Т-критерию): Л1-Л4 = –5,4 СО, ш. б. = –2,9 СО, общ. б. = –3,4 СО, — выявлен ОП. По данным магнитно-резонансной томографии (МРТ) грудного отдела позвоночника: правосторонний сколиоз, усиление кифоза, межпозвонковый остеохондроз, узелки Шморля замыкательных пластинок тел Т5-8, Л1 позвонков, спондилез, мелкие гемангиомы тел Т6 и Т9 позвонков. Начато лечение альфакальцидолом в дозе 1,0 мкг/сутки, которое чередовалось с препаратами кальция и витамина D.
В 2005 г. при падении с высоты роста у больной произошел перелом дистального отдела правого предплечья, что послужило поводом для визита к врачу для коррекции терапии ОП. В течение 9 месяцев 2005–2006 гг. она принимала ибандроновую кислоту в дозе 150 мг 1 раз в месяц. В последующем — не регулярно препараты кальция и витамина D.
В связи с усилением болей в позвоночнике пациентка вновь обратилась в Центр остеопороза в 2011 г. При контроле денситометрии показатели МПК (Т-критерий): Л1-Л4 = –4,9 СО, ш. б.= –3,5 СО, общ. б. = –3,7 СО. Рентгенографическое исследование грудного и поясничного отделов позвоночника не выявило значимых изменений по сравнению с исследованием МРТ, проведенного в 2004 г. Больной были даны рекомендации, в соответствии с которыми она в течение трех лет принимала, но нерегулярно, алендроновую кислоту в дозе 70 мг 1 раз в неделю в сочетании с препаратами кальция и витамина D.
В 2014 г. на очередном визите в Центр остеопороза при контроле денситометрии выявлена положительная динамика показателей МПК как в позвоночнике, так и в проксимальном отделе бедра: Л1-Л4 = –4,5 СО, ш. б. = –3,1 СО, общ. б. = –3,5 СО. Однако, учитывая сохраняющиеся боли в позвоночнике, была сделана компьютерная томография (КТ) грудного и поясничного отделов позвоночника, на КТ-снимках обнаружена деформация Т12 позвонка. Уровень 25ОН витамина D в сыворотке крови 32,8 нмоль/л, кальций общий — 2,29 ммоль/л, щелочная фосфатаза — 148 ед/л, креатинин — 86 мкмоль/л.
В связи с недостаточной комплаентностью и возникновением перелома позвонка пациентка переведена на подкожное введение деносумаба в дозе 60 мг 1 раз в 6 месяцев в сочетании с 800 МЕ нативного витамина D и 1000 мг кальция в сутки.
С марта 2014 г. по апрель 2016 г. больная получила 4 инъекции деносумаба. Переносимость препарата была хорошей: нежелательных явлений, связанных с его использованием, не было, уровень кальция в сыворотке крови оставался в пределах нормальных значений. Через 2 года лечения отмечена дальнейшая положительная динамика МПК как в позвоночнике, так и проксимальном отделе бедра (рис. 2). Новых переломов за указанный период выявлено не было. Больная продолжила лечение деносумабом.

Литература
- Добровольская О. В., Торопцова Н. В., Лесняк О. М. Экономические аспекты осложненного остеопороза: стоимость лечения в течение первого года после перелома // Современная ревматология. 2016. Т. 10, № 3. С. 29–34.
- Huybrechts K. F., Ishak K. J., Caro J. J. Assessment of compliance with osteoporosis treatment and its consequences in a managed care population // Bone. 2006; 38 (6): 922–928.
- Höer A., Seidlitz C., Gothe H., Schiffhorst G., Olson M., Hadji P., Häussler B. Influence on persistence and adherence with oral bisphosphonates on fracture rates in osteoporosis // Patient Prefer Adherence. 2009; 3: 25–30.
- Van den Boogaard C. H., Breekveldt-Postma N. S., Borggreve S. E., Goettsch W. G., Herings R. M. Persistent bisphosphonate use and the risk of osteoporotic fractures in clinical practice: a database analysis study // Curr Med Res Opin. 2006, 22: 1757–1764.
- Kendler D. L., Roux C., Benhamou C. L., Brown J. P., Lillestol M., Siddhanti S., Man H.-S., San Martin J., Bone H. G. Effects of Denosumab on Bone Mineral Density and Bone Turnover in Postmenopausal Women Transitioning From Alendronate Therapy // J Bone Miner Res. 2010; 25 (1): 72–81.
- Hadji P., Papaioannou N., Gielen E., Feudjo Tepie M., Zhang E., Frieling I., Geusens P., Makras P., Resch H., Möller G., Kalouche-Khalil L., Fahrleitner-Pammer A. Persistence, adherence, and medication-taking behavior in women with postmenopausal osteoporosis receiving denosumab in routine practice in Germany, Austria, Greece, and Belgium: 12-month results from a European non-interventional study // Osteoporos Int. 2015; 26 (10): 2479–289. DOI: 10.1007/s00198–015–3164–4.
- Hadji P., Kyvernitakis I., Kann P. H., Niedhart C., Hofbauer L. C., Schwarz H., Kurth A. A., Thomasius F., Schulte M., Intorcia M., Psachoulia E., Schmid T. GRAND-4: the German retrospective analysis of long-term persistence in women with osteoporosis treated with bisphosphonates or denosumab // Osteoporos Int. 2016, Oct; 27 (10): 2967–2978. DOI: 10.1007/s00198–016–3623–6. Epub 2016, May 12.
Н. В. Торопцова1, доктор медицинских наук
О. А. Никитинская, кандидат медицинских наук
Т. А. Короткова, кандидат медицинских наук
Н. В. Демин
ФГБНУ НИИР им. В. А. Насоновой, Москва
1 Контактная информация: torop@irramn.ru
Состав
1 шприц (1 мл) включает 60 мг деносумаба.
Дополнительно: 47 мг сорбитола, 0.1 мг полисорбата 20, 1 мг ледяной уксусной кислоты, до 1 мл воды д/ин, до рН 5.0-5.5 гидроксида натрия.
Форма выпуска
Пролиа выпускается в форме инъекционного раствора для п/к (подкожного) введения, в шприцах по 1мл №1 во вторичной упаковке.
Фармакологическое действие
Ингибирующее (угнетающее) костную резорбцию.
Фармакодинамика и фармакокинетика
Активный ингредиент препарата Пролиа – деносумаб – полностью является моноклональным антителом человека и принадлежит к иммуноглобулиновому подклассу IgG2. Данное вещество характеризуется высокой специфичностью и сродством к рецепторному лиганду κВ (RANKL) – активатору нуклеарного фактора и, связываясь с ним, блокирует активизацию единственного находящегося на поверхности остеокластов, а также их предшественников RANK-рецептора – активатора нуклеарного фактора κВ (RANK). Вследствие этого, взаимодействия RANKL/RANK не происходит, что приводит к подавлению образования, активизации и продолжительности функционирования остеокластов и в свою очередь снижает костную резорбцию (разрушение), а также увеличивает прочность и массу трабекулярного и кортикального слоев кости.
При подкожном (п/к) введении 60 мг деносумаба наблюдалось быстрое снижение плазменных концентраций 1С-телопептида (СТХ), являющегося маркером резорбции костной ткани, примерно на 70% на протяжении 6-ти часов после инъекции и на 85% в течение следующих 3-х суток. Стабильно пониженный уровень СТХ сохранялся на протяжении полугода. При снижении плазменной концентрации деносумаба скорость понижения сывороточного содержания СТХ в некоторой степени уменьшалась, что свидетельствует об обратимости воздействия деносумаба на костное ремоделирование. Такие эффекты отмечались в течение всего терапевтического курса.
В процессе ремоделирования костной ткани в соответствии с физиологической взаимосвязью между ее образованием и резорбцией, после первой инъекции деносумаба в течение первого месяца отмечалось снижение количества маркеров костного образования (например, P1NP и костноспецифической ЩФ). Маркеры костного ремоделирования (образования кости и ее резорбции) обычно приходили к уровню, наблюдаемому до начала терапии, по прошествии не более 9-ти месяцев после введения последней дозы деносумаба. При возобновлении введения деносумаба уровень снижения СТХ соответствовал таковому в начале лечебного курса.
В проведенных исследованиях замены терапии с приема алендроновой кислоты (продолжительность лечения в среднем – 3 года) на введение деносумаба, проходившие с привлечением женщин с малой костной массой в постменопаузе доказали дополнительное уменьшение сывороточного уровня СТХ при применении деносумаба в сравнении с приемом алендроновой кислоты. При этом плазменные концентрации кальция в обеих исследуемых группах были аналогичными.
Также при проведении данных исследований, подавление взаимодействия RANK/RANKL параллельно со связыванием Fc-фрагмента (OPG-Fc) с остеопротегерином приводило к торможению костного роста и замедлению прорезывания зубов. Вследствие этого применение деносумаба у детей может негативно влиять на прорезывание зубов и развитие костей, обладающих открытыми ростовыми зонами.
В связи с тем, что деносумаб является человеческим моноклональным антителом, его применение, как и прочих препаратов белковой природы, теоретически может привести к иммуногенности. Используя иммунологический анализ в сочетании с методом чувствительной электрохемилюминесценции, были произведены обследования более 13000 больных на предмет формирования у них связывающих антител. Менее чем в 1% случаев применение деносумаба на протяжении 5-ти лет приводило к определению антител (включая растущие, транзиторные и существовавшие ранее). Серопозитивные пациенты в дальнейшем прошли обследования с целью выявления нейтрализующих антител. В культуре клеток in vitro методом хемилюминисцентного анализа таких антител обнаружено не было. Также не наблюдалось изменений клинического ответа, фармакокинетического и токсического профиля, зависимых от образования антител.
У женщин с диагностированным постменопаузальным остеопорозом применение Пролиа усиливало минеральную костную плотность, тем самым снижая частоту невертебральных и вертебральных переломов, а также переломов шейки бедра. Профили безопасности и эффективности деносумаба при терапии постменопаузального остеопороза полностью доказаны в ходе исследований, проведенных на протяжении 3-х лет. По результатам данных исследований применение Пролиа по сравнению с введением «плацебо» существенно снижает риск любых переломов, возникающих в постменопаузе у женщин с остеопорозом. В исследовании принимали участие 7808 женщин, у 23,6% из них ранее часто отмечались переломы позвонков. Все три заключительные точки эффективности касательно переломов приходили к статистически значимым показателям, которые оценивали по предварительно разработанному последовательному плану тестирования.
Применение Пролиа на протяжении более 3-х лет показало значимое и стабильное уменьшение риска появления вертебральных переломов. Снижение такого риска наблюдалось в независимости от 10-летней вероятности образования остеопоротических крупных переломов, ранее происходящих частых переломов позвонков, возраста пациентов, невертебральных переломов, минеральной плотности костей, степени костного ремоделирования и предыдущего лечения остеопороза.
У пациенток в постменопаузе в возрасте 75-ти лет и старше применение Пролиа приводило к снижению частоты новых эпизодов вертебральных переломов, а также по данным проведения post hoc анализа сокращало частоту случаев переломов бедренной шейки.
Снижение частоты появления невертебральных переломов также не зависело от 10-летней вероятности образования остеопоротических крупных переломов. Лекарство Пролиа в сравнении с применением «плацебо» существенно повышало минеральную костную плотность, определяемую каждый год проведения 3-х летнего лечения во всех без исключения анатомических областях. Схожее воздействие препарата на минерализацию костей было выявлено в поясничном районе позвоночника и не зависело от расовой принадлежности пациента, его возраста, ИМТ (индекс массы тела), значений минеральной костной плотности и ремоделирования кости. Проведенные гистологические исследования доказали нормальную структуру костей и, в сравнении с «плацебо«, понижение их ремоделирования. Патологических изменений, в том числе остеомаляции, фиброза и нарушений костной структуры отмечено не было.
Безопасность и эффективность препарата Пролиа, назначаемого для терапии снижения костной массы по причине уменьшения содержания андрогенов, также были обоснованы в ходе 3-х летнего исследования с привлечением 1468 больных, страдающих неметастатическим раком простаты. Значимое повышение костной минеральной плотности выявляли в поясничном отделе, бедренной кости ее вертеле и шейке спустя 30 суток после первой инъекции препарата. Увеличение минеральной костной плотности в поясничном отделе возникало в независимости от расовой принадлежности, возраста, ИМТ, географического региона, начальных показателей минеральной костной плотности и костного ремоделирования, а также наличия предшествующих вертебральных переломов и длительности гормондепривационной терапии.
На протяжении 3-х летнего применения Пролиа наблюдалось существенное уменьшение риска образования свежих вертебральных переломов, оцениваемое через 12 и 24 месяца после назначения препарата. Также введение Пролиа уменьшало риск появления свыше одного перелома остеопоротического характера любой локализации.
Безопасность и эффективность Пролиа при терапии потери костной массы, по причине проведения адъювантной терапии с использованием ингибитора ароматазы, определялась в ходе 2-х летнего исследовании с привлечением 252 женщин с диагностированным раком молочной железы (неметастатическим). Применение Пролиа, в сравнении с введением «плацебо«, значительно повышало минеральную костную плотность во всех исследуемых анатомических областях на протяжении 2-х лет. В поясничном отделе наращивание минеральной костной плотности было отмечено спустя 30 суток после введения первой дозы и сохранялось на протяжении всего лечения независимо от возраста пациентки, ИМТ, продолжительности применения ингибитора ароматазы, предыдущей химиотерапии и применения СМРЭ, а также времени, прошедшего от наступления менопаузы.
Фармакокинетика деносумаба при его п/к введении нелинейная и дозозависимая в широком дозировочном диапазоне, характеризующаяся повышением экспозиции препарата в дозировках 60 мг (или 1 мг/кг) и более. При введении 60 мг препарата через 10 суток (с вариабельностью 2-28 дней) его биодоступность была 61%, плазменная Cmax составляла 6 мкг/мл (с вариабельностью 1-17 мкг/мл). По достижению Cmax сывороточная концентрация уменьшалась с T1/2 26 суток (с вариабельностью 6-52 дня) и в дальнейшем на протяжении 3-х месяцев (с вариабельностью 1,5-4,5 месяца). Через 6 месяцев после введения последней дозы Пролиа у 53% пациентов деносумаба в плазме уже не обнаруживалось. При многократном введении 60 мг деносумаба через каждые полгода не отмечалось его кумуляции и изменений фармакокинетики.
Как и обыкновенный иммуноглобулин, деносумаб состоит из углеводов и аминокислот. По результатам проведенных доклинических исследований предполагается, что его метаболические преобразования и дальнейшее выведение будут проходить по пути обычного клиренса и выведения иммуноглобулинов, с распадом на отдельные аминокислоты и короткие пептидные цепи.
Фармакокинетика деносумаба при его применении пациентами в возрасте 28-87 лет не подвергается значимым изменениям. Расовая принадлежность больных также не влияет на фармакокинетику препарата.
Наличие у пациентов патологий почек, по данным исследований с привлечением 55-ти больных с различной степенью тяжести почечной недостаточности, в том числе находящихся на гемодиализе, не приводило к изменениям фармакодинамики и фармакокинетики деносумаба, что говорит об отсутствии необходимости корректировки дозировочного режима.
Влияние печеночных патологий на фармакокинетические параметры деносумаба не изучалось.
Показания к применению
Назначение Пролиа показано для терапии постменопаузального остеопороза, а также потери массы костной ткани у женщин с раком молочной железы, проходящих лечение с применением ингибиторов ароматазы и у мужчин с раком простаты, находящихся на гормондепривационной терапии.
Противопоказания
Применение Пролиа противопоказано при наличествующей гипокальциемии и персональной гиперчувствительности к деносумабу и/или прочим ингредиентам ЛС.
Побочные действия
При проведении контролируемых клинических исследований наблюдали следующие негативные реакции: часто – формирование катаракты у пациентов мужского пола с раком простаты, проходящих андрогендепривационную терапию, болевые ощущения в конечностях; нечасто – развитие экзем (в том числе, включая аллергические, контактные и атопические дерматиты), воспалительные процессы в подкожной клетчатке; редко – челюстной остеонекроз; эпизодически – возникновение гипокальциемии.
Пролиа, инструкция по применению (Способ и дозировка)
Проведение п/к инъекций препаратом Пролиа рекомендуют проводить дважды в год (1 раз в 6 месяцев) в дозе 60 мг. На протяжении всего курса лечения советуют параллельно принимать витамин D и препараты кальция.
К самостоятельному введению Пролиа можно приступить только после предварительной консультации у лечащего врача, в ходе которой он должен подробно объяснить пациенту все нюансы техники проведения инъекций.
С целью снижения риска случайных уколов каждый уже заполненный шприц оснащен защитным предохранителем для иглы, активирующимся автоматически для ее закрытия сразу после выполнения инъекции.
Не следует пытаться разобрать шприц или активизировать защитный предохранитель. Нельзя использовать шприцы с отсутствующим колпачком или активизированным предохранителем иглы.
Для проведения инъекции препаратом Пролиа самостоятельно вам понадобится новый заполненный шприц и спиртовые салфетки.
Непосредственно перед самим введением следует достать из холодильника шприц, при этом, не беря его за защитный колпачок или поршень, так как это может привести к повреждению устройства.
Для комфортного введения необходимо оставить на некоторое время шприц при комнатной температуре, но не под воздействием солнечных лучей (не следует подогревать шприц в горячей воде, микроволновой печи и т.д.). Не нужно встряхивать шприц и удалять защитный колпачок до начала инъекции.
Далее необходимо убедиться в соответствии срока годности препарата Пролиа, указанного на упаковке, и визуально проверить инъекционный раствор на посторонние включения и изменения цвета (допускается введение только прозрачного, бесцветного или светло-желтого раствора). Разрешено введение раствора с небольшими пузырьками воздуха.
Выбрать хорошо освещенное, комфортное место с близко расположенной чистой поверхностью, на которой разместить необходимые для инъекции материалы и тщательно вымыть руки.
Инъекции лучше всего проводить в верхнюю область бедра или живота. В случае проведения процедуры другим лицом может быть использована тыльная поверхность рук. При отечности или покраснении предполагаемой области введения следует выбрать иное место для инъекции.
Продезинфицировать выбранное место спиртовой салфеткой.
Аккуратно снять защитный колпачок, не вращая его, а просто потянув вверх. Следует избегать касания к игле и нажима на поршень.
Взять шприц в удобную руку и, не сдавливая, зажать кожу между указательным и большим пальцами другой руки. Ввести иглу в основание складки кожи под углом 45° на глубину около 15 мм.
Удерживая кожную складку плавно и медленно, надавить на поршень до полного введения раствора. Защитный предохранитель иглы закроется только тогда, когда шприц полностью опустеет.
Не меняя давления на поршень, следует удалить иглу из кожной складки, после чего отпустить поршень и позволить защитному предохранителю целиком закрыть иглу.
В случае несрабатывания предохранителя возможно неполное введение дозы препарата, что потребует дополнительной консультации у врача.
При появлении крови в месте введения нужно аккуратно удалить ее ватной салфеткой. Не следует растирать кожу в районе инъекции. Место прокола можно заклеить пластырем.
Один шприц предназначен для проведения только одной инъекции. Оставшийся препарат повторно применять запрещено.
Использованный шприц закрывать колпачком не следует. Утилизировать все его части нужно в соответствии с рекомендуемыми врачом правилами.
Передозировка
В ходе проведенных клинических исследований введение ежемесячной дозы Пролиа 180 мг на протяжении полугода (в сумме 1080 мг за 6 месяцев) не выявило каких-либо негативных симптомов.
Взаимодействие
Направленных изысканий взаимодействия деносумаба с прочими ЛС не проводилось. Не стоит смешивать препарат с другими растворами.
Условия продажи
Купить Пролиа возможно только по рецепту.
Условия хранения
Длительная сохранность препарата требует температуры 2-8°С. Хранить шприцы следует в упаковке завода-производителя, в холодильнике, не замораживая. После изъятия Пролиа из холодильника срок его хранения при температуре до 25°С ограничен 30-ю сутками.
Срок годности
При условии соблюдения температуры 2-8°С препарат можно использовать на протяжении 3-х лет.
Особые указания
Пожилые пациенты и больные с патологиями почек не требуют корректировки дозировочного режима деносумаба.
Влияние патологий печени на безопасность и эффективность Пролиа не изучалось.
Во время терапии препаратом Пролиа рекомендуют параллельно принимать витамин D и препараты кальция, в особенности пациентам с патологиями почек.
Перед началом лечения корректировка наличествующей гипокальциемии может быть произведена приемом адекватных доз витамина D и препаратов кальция. У пациентов с повышенным риском формирования гипокальциемии следует следить за содержанием кальция.
В некоторых случаях применение Пролиа приводило к развитию кожных инфекций и ее придатков (как правило, наблюдаются воспалительные процессы в подкожной клетчатке), которые иногда могут потребовать госпитализации. В проведенных исследованиях возникновение таких реакций чаще наблюдалось в группе применения деносумаба (0,4%) в сравнении с группой введения «плацебо» (0,1%). В случае возникновения кожных инфекций пациенты должны незамедлительно сообщить об этом своему врачу.
У больных с распространенным раком, которые проходили лечение с ежемесячным введением 120 мг деносумаба, изредка наблюдали развитие остеонекроза челюсти. Также существуют отдельные сообщения о формировании данной патологии при применении схемы терапии деносумабом – 60 мг дважды в 12 месяцев.
При наличии у пациента аллергии на латекс следует избегать касаний к колпачку иглы.
Аналоги
Совпадения по коду АТХ 4-го уровня:
Аналоги Пролиа представлены препаратами: Бивалос, Остеохель С, Остеогенон, Стромос, Остеокеа, Остеолат.
Детям
Безопасность и эффективность Пролиа в педиатрии не изучались, в связи с чем его не назначают в детской возрастной группе.
При беременности и лактации
Каких-либо достоверных данных о применении Пролиа во время беременности не существует, из-за чего его назначение в этот период не рекомендуется.
Возможность проникновения деносумаба в молоко кормящей матери до конца не изучено, однако есть свидетельства его негативного влияния на грудных детей. По этой причине при кормлении грудью применять препарат Пролиа не рекомендуют.
Отзывы
Отзывы о Пролиа относительно эффективности укрепления и наращивания плотности костной ткани при остеопорозе немногочисленные и неоднозначные. Некоторые пациенты, все-таки решившиеся приобрести этот препарат и прошедшие всего одну инъекцию, уже через полгода на очередной денситометрии отмечали положительную динамику своего болезненного состояния, при этом все они строго придерживались предписаний врача на протяжении этого времени и дополнительно принимали витамин D и препараты кальция. Другие больные не ощутили у себя положительных изменений или остались недовольны их значимостью.
Сами врачи, ссылаясь на результаты исследований деносумаба, рекомендуют Пролиа к применению, но предупреждают, что абсолютной гарантии значимого положительного эффекта по отношению ко всем пациентам быть не может. Несмотря на это стоит заметить, что объективно отрицательных отзывов о препарате Пролиа у применявших его пациентов, кроме его стоимости, очень немного.
Цена, где купить
Цена на Пролиа 60 мг/1 мл №1 варьируется в районе 21000-23000 рублей.
- Интернет-аптеки РоссииРоссия
ЗдравСити
-
Пролиа раствор для п/к введ. шприц с системой защиты иглы 60мг/мл 1млАмджен Мэньюфэкчуринг Лимитед/Добролек ООО
-
Пролиа раствор для п/к введ. шприц с защитным устройством иглы 60мг/мл 1млАмджен Мэньюфэкчуринг Лимитед/Добролек ООО
показать еще
ВВЕДЕНИЕ
Остеопороз (ОП), согласно определению Всемирной организации здравоохранения (ВОЗ), является системным заболеванием скелета, которое сопровождается снижением костной массы, изменением микроархитектоники костной ткани, что способствует повышению хрупкости костей и, как следствие, увеличивает риск переломов. Процесс снижения костной массы постепенно начинается у лиц старше 40 лет. Согласно данным Международного фонда остеопороза (International Osteoporosis Foundation, IOF), начиная с возраста старше 50 лет у каждой третьей женщины и каждого пятого мужчины происходит хотя бы один перелом, причиной которого является ОП1 [1]. ОП — глобальная мировая проблема, он занимает четвертое место по распространенности среди неинфекционных заболеваний (после сердечно-сосудистых, онкологических заболеваний и сахарного диабета) и ведущее место в структуре заболеваемости, причин инвалидности, снижения качества жизни и преждевременной смертности лиц пожилого возраста.
Особенно часто при ОП происходят переломы тел позвонков, проксимального отдела бедренной кости (шейка бедра и чрезвертельная область), дистального отдела предплечья и проксимального отдела плечевой кости2. Наиболее серьезными считаются переломы бедренной кости, так как они практически всегда предполагают необходимость стационарного лечения, приводят к летальному исходу приблизительно в 20% случаев и являются причиной постоянной инвалидности примерно у половины пациентов3. Летальность вследствие осложнений, обусловленных остеопорозными переломами, в популяции женщин европеоидной расы старше 50 лет составляет 2,8%, что соответствует показателю летальности от рака молочной железы, при этом риск перелома проксимального отдела бедренной кости у женщин равен суммарному риску рака молочной железы, рака матки и рака яичников, а у мужчин риск этого перелома превышает риск рака предстательной железы4 [2].
Рост распространенности ОП является социально значимой проблемой, так как увеличение продолжительности жизни и количества пожилых людей ведет к общему старению населения в мире [3]. В 2018 г. прямые и непрямые медицинские затраты на лечение основных типов остеопорозных переломов в России составили около 40 млрд рублей (в ценах 2014 г.) [4]. С учетом прогнозируемого роста продолжительности жизни в России в ближайшие годы будет наблюдаться рост количества случаев остеопорозных переломов. Ожидаемое число пациентов с ОП в России к 2050 г. предположительно достигнет 22 млн человек, что вместе с предполагаемыми случаями остеопении у 28 млн пациентов увеличит количество людей с высоким риском переломов до 50 млн человек [5].
Основные лекарственные препараты (ЛП) для лечения ОП можно условно разделить на преимущественно подавляющие костную резорбцию — антирезорбтивные средства (бисфосфонаты, деносумаб) и преимущественно усиливающие образование костной ткани — анаболические средства (терипаратид) [1].
Препаратами первой линии терапии для предупреждения переломов и повышения минеральной плотности костей у пациентов с первичным ОП уже достаточно длительное время считаются бисфосфонаты [6][7]. ЛП данной группы имеют доказанную эффективность, тем не менее более высокая вероятность развития нежелательных реакций, а также режим применения (в зависимости от ЛП один раз в неделю/месяц строго за 30/60 минут до еды, обязательное вертикальное положение после приема препарата) приводят со временем к снижению комплаентности к препаратам этой группы.
Деносумаб — высокоэффективный ЛП, относящийся к классу гуманизированных моноклональных антител, был зарегистрирован в России в 2011 г. Деносумаб назначают при лечении постменопаузального ОП и первичного ОП у мужчин, для предупреждения потери костной массы и переломов при отсутствии костных метастазов у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы, а также мужчинам при раке предстательной железы, получающим гормон-депривационную терапию5.
Деносумаб не накапливается в костной ткани, имеет удобный режим приема (1 раз в 6 месяцев) и меньшую частоту развития нежелательных реакций по сравнению с другими препаратами для лечения ОП, что определяет его преимущество при выборе терапии. Однако серьезной проблемой при лечении деносумабом является так называемый «синдром рикошета» — отсроченный эффект после отмены лечения, который заключается в повышенной потере костной массы (до исходного уровня плотности и ниже), вследствие чего повышается риск переломов [8–10]. Для того чтобы предотвратить развитие синдрома рикошета, необходимо изучить механизмы возникновения этой нежелательной реакции с учетом данных современных исследований процесса образования костной ткани.
Цель работы — систематизация актуальной информации о механизме развития синдрома рикошета и возможностях предотвращения потери костной массы при отмене деносумаба.
Потенциально релевантные исследования в отношении остеопороза, применения деносумаба и синдрома рикошета были выявлены путем поиска в электронных базах данных MEDLINE, SCOPUS, PubMed, Google Scholar и Кокрейновской базе данных систематических обзоров, используя термины: остеопороз, патофизиология остеопороза, терапия остеопороза, антирезорбтивная терапия, бисфосфонаты, деносумаб, длительное применение деносумаба, нежелательные реакции при отмене деносумаба, остеокласты, влияние деносумаба на изменение остеокластов, остеоморфы. Были оценены отдельные статьи, содержащие результаты рандомизированных клинических исследований, метаанализы, систематические клинические обзоры. Исключены статьи с описанием ОП, являющегося вторичным вследствие различных заболеваний и у пациентов с постовариэктомическим синдромом, терапии остеопороза исключительно с помощью эстрогенов и витамина D, а также статьи, в которых были проанализировано применение деносумаба в педиатрической популяции.
Также нами были проанализированы сообщения о нежелательных реакциях, выявленных при приеме деносумаба, поступивших в базу данных «Фармаконадзор 2.0» Автоматизированной информационной системы Росздравнадзора с ноября 2020 по март 2024 г. За указанный период было зафиксировано 61 первичное сообщение о развитии синдрома рикошета, из них 34 сообщения связаны с назначением деносумаба при лечении первичного ОП, в том числе в одном из них были представлены данные из статьи [10], описывающей случай синдрома рикошета с последующим смертельным исходом.
ОСНОВНАЯ ЧАСТЬ
Патофизиология изменений костной ткани при остеопорозе
В процессах моделирования и ремоделирования костной ткани участвуют три типа клеток: остеоциты, остеобласты и остеокласты. ОП возникает в результате резорбции костей остеокластами, которая не компенсируется образованием остеобластов. Избыток остеокластов при необходимости ремоделирования или недостаток остеобластов при необходимости восстановления созданной остеокластами полости резорбции являются основными патофизиологическими изменениями при ОП [11].
Остеоциты — наиболее распространенный тип клеток в кости (90–95%), они являются терминально дифференцированными клетками линии остеобластов. Первоначально считалось, что остеоциты не участвуют в костном метаболизме, однако в дальнейшем было выявлено, что они способны как ремоделировать костную ткать (периостеоцитарное резорбционное разрушение), так и синтезировать новый костный материал [11]. В настоящее время показано, что остеоциты регулируют обмен кальция и фосфатов, процессы ремоделирования кости путем управления образованием и активностью остеобластов и остеокластов как напрямую, так и с помощью образования эффекторных белков [12], и в итоге оказывают влияние на поддержание гомеостаза организма [13]. В частности, остеоциты являются основным источником лиганда рецептора-активатора ядерного фактора-kB (receptor activator of nuclear factor kappa B ligand, RANKL) — ключевого фактора дифференцировки остеокластов.
Остеобласты — образующие костную ткань клетки, формируются из мезенхимальных стволовых клеток и в дальнейшем могут либо продолжать осуществлять свою функцию, либо трансформироваться в остеоциты, либо подвергаться апоптозу [14–17]. Остеобласты секретируют многие компоненты внеклеточного матрикса, и характерной именно для них является комбинация белков остеокальцин, костный сиалопротеин и фермента щелочная фосфатаза, выделяющихся в межклеточное пространство [18].
Остеокласты — высокоспециализированные многоядерные клеточные структуры моноцитарного ряда, обладающие резорбтивной способностью. Эмбриональный источник развития этих клеток с самого начала их открытия был темой дискуссии. В настоящее время одним из источников развития остеокластов считаются ранние и поздние эмбриональные эритромиелоидные предшественники (ЭМП) желточного мешка, которые обеспечивают ремоделирование и нормальные остеогенез в онтогенезе плода и в период после рождения (продолжительность их жизни — не менее 6 месяцев после рождения). Также источником развития остеокластов являются фетальные гемопоэтические клетки (ГПК), одна из линий дифференцировки которых приводит к образованию общего предшественника макрофагов/остеокластов/дендритных клеток, которые идут по линии дифференцировки остеокластов за счет взаимодействия с RANKL и макрофагальным колониестимулирующим фактором (macrophage colony-stimulating factor, M-CSF). RANKL обеспечивает процесс дифференцировки остеокластов, процесса слияния и времени жизни активных остеокластов, M-CSF нужен для направления дифференцировки ГПК, способствует пролиферации и увеличивает время жизни предшественников остеокластов [19].
Остеокласты, развившиеся из ЭМП, постепенно заменяются мононуклеарными предшественниками моноцитов, происходящих из ГПК, но некоторые клетки-предшественники могут сливаться с уже долго живущими остеокластами из ЭМП, тем самым поддерживая их популяцию на протяжении всей жизни. Следующим шагом в остеокластогенезе является этап слияния мононуклеарных предшественников остеокластов, включающий в себя миграцию, распознавание, адгезию и слияние мембран. Это избирательный процесс, зависящий от зрелости, подвижности, нуклеарности клеток и других факторов [20]. Важно отметить постоянное взаимодействие остеокластов с разными клетками, которое обеспечивает дальнейшее созревание и направляет развитие остеокластов.
Решающую роль в дифференцировке остеокластов играет путь RANKL/RANK/OPG, включающий:
- RANKL — мембранный белок, цитокин семейства факторов некроза опухоли, который способствует дифференцировке остеокластов и может существовать в мембраносвязанной и растворимой форме;
- RANK — рецептор к RANKL у остеокластов;
- остеопротегерин (osteoprotegerin, OPG) — гликопротеин, являющийся рецептором-ловушкой для RANKL, предотвращающий взаимодействие RANKL-RANK и блокирующий остеокластогенез [21].
Согласно признанной ранее теории остеокласты считались короткоживущими клетками (менее 6 недель), которые после резорбции кости сразу подвергаются апоптозу. Однако результаты новых исследований [22][23], проведенных методом прижизненной визуализации, показали, что зрелые остеокласты способны делиться на более мелкие клетки — остеоморфы. Остеоморфы — ядросодержащие дочерние мелкие клетки, отделяющиеся от поликариона и сливающиеся с соседними остеокластами или, в некоторых случаях, с такими же остеоморфами. Этот процесс получил название рециркуляции остеокластов. Важно отметить, что остеоморфы, возникающие в результате деления остеокластов кости, транскрипционно отличаются от остеокластов и макрофагов. Гены, активные у остеоморфов, играют важную роль в структуре и функции костей. При рециркуляции остеокластов ингибирование работы OPG приводит к накоплению остеоморфов [22][23].
Ремоделирование происходит в четыре фазы. Первая фаза (фаза активации) индуцирует дифференцировку остеокластов из предшественников в зрелые клетки и рекрутинг их на поверхность кости. Во вторую фазу (фаза резорбции) зрелые остеокласты резорбируют кость, во время третьей (реверсивной) фазы происходит гибель остеокластов и рекрутинг предшественников остеобластов. Во время последней фазы (фаза формирования) закладывается новый костный матрикс с последующей его минерализацией [24][25].
Нарушение баланса между этими процессами приводит к аномальному ремоделированию, способствующему развитию ОП [26–28]. Традиционные патофизиологические теории ОП связывают этот процесс с дефицитом эстрогенов или витамина D, а также со вторичным гиперпаратиреозом, однако в последние десятилетия появились теории, описывающие участие в развитии ОП иммунологического механизма, микробиома кишечника, а также системного старения клеток [3].
Снижение уровня эстрогенов является важной предпосылкой для развития ОП — как в случае ускоренной потери костной массы у женщин в ранней менопаузе, так и при медленной потере костной массы у женщин и у пожилых мужчин [29]. В некоторой степени это можно объяснить прямым влиянием эстрогенов на рецепторы, находящиеся на остеоцитах, остеобластах и остеокластах, в частности, снижение уровня эстрогенов способствует изменению соотношения остеокластов и остеобластов, уменьшая число последних [30]. Снижение уровня эстрогенов приводит также к увеличению образования RANKL, вследствие чего костная резорбция усиливается.
Кроме того, при дефиците эстрогенов происходит активация высвобождения остеокластогенных цитокинов, в том числе провоспалительных [31]. Основным источником противовоспалительных цитокинов при ОП считаются Т-клетки [31–33]. Более подробно механизм, связывающий потерю эстрогена с возникновением вялотекущего воспаления со стороны Т-клеток у мышей с удаленными яичниками, был описан в работе A. Cline-Smith и соавт. [34].
В-клетки также оказывают важное воздействие на развитие ОП, так как продуцируют RANKL и OPG, участвуя таким образом в регуляции пути RANKL/RANK/OPG. Однако точный механизм, связывающий дефицит эстрогена с В-клетками и потерей костной массы, наблюдаемый у женщин в постменопаузе, до настоящего момента понятен не полностью [35].
Характеристика и механизм действия деносумаба
Деносумаб является первым ингибитором RANKL, одобренным Управлением по контролю за качеством продуктов питания и лекарственных средств США (Food and Drug Administration, FDA) в 2010 г.
Первоначально для терапии ОП планировалось использовать OPG, так как он ингибирует RANKL-зависимую дифференцировку остеокластов, что способствует снижению остеокластогенеза и, как следствие, уменьшению резорбции кости. Однако исследования были прекращены из-за возможного развития нейтрализующего иммунного ответа на эндогенный OPG, и была начата разработка антитела к RANKL — деносумаба, являющегося аналогом OPG по действию. Деносумаб, взаимодействуя с RANKL, способствует блокировке процесса дифференцировки преостеокластов в остеокласты и подавляет резорбцию костной ткани, но, в отличие от OPG, обеспечивает высокоспецифичное ингибирование RANKL, при этом не связываясь с другими членами семейства факторов некроза опухоли [36].
Лечение деносумабом уменьшает количество переломов и устойчиво увеличивает минеральную плотность костей в течение периода лечения. Так, согласно данным исследования FREEDOM (Fracture Reduction Evaluation of Denosumab in Osteoporosis Every 6 Months), деносумаб снижал риск новых рентгенологических переломов позвонков по сравнению с плацебо на 68%, риск невертебральных переломов — на 20%, из них переломов бедра — на 40% [37]. Деносумаб является достаточно безопасным препаратом, и такие нежелательные реакции, как гипокальциемия, остеонекроз челюсти, атипичный перелом бедра, при его применении регистрируются относительно редко6.
Тем не менее существует достаточно серьезный риск, связанный с деносумабом: его отмена приводит к развитию синдрома рикошета — повышенной потере костной массы, часто ниже исходного уровня ее плотности [8–10]. В настоящее время данная проблема по безопасности применения деносумаба является актуальной и регулируется рутинными мерами минимизации риска: сообщением в листке-вкладыше лекарственного препарата о том, что отмена лечения деносумабом невозможна без консультации с лечащим врачом.
Механизм развития синдрома рикошета при отмене деносумаба
Увеличение резорбции кости характеризуется повышенным содержанием маркеров костного метаболизма, таких как N-концевой пропептид проколлагена 1-го типа, C-концевой телопептид и TRAP-5b (tartrate-resistant acid phosphatase 5b). Усиление ремоделирования костной ткани сопровождается повышением уровня RANKL в сыворотке крови и снижением уровня OPG [38]. Гистоморфометрические исследования показали практически полное отсутствие не только остеокластов, но и остеобластов на поверхности кости при лечении деносумабом, причиной чего является снижение уровня OPG, однако механизм повышения уровня RANKL остается не выясненным [39].
Считается, что применение деносумаба приводит к блокированию остеокластогенеза. Ингибирование RANKL либо эндогенным OPG, либо моноклональным антителом, таким как деносумаб, ингибирует процесс рециркуляции остеокластов и вызывает накопление преостеокластов и остеоморфов (рис. 1А). Таким образом, во время лечения деносумабом создается пул индуцированных клеток, из которых при отмене препарата достаточно быстро и в большом количестве образуются остеокласты, обеспечивающие резорбцию кости. Отмена деносумаба напрямую приводит к накоплению RANKL и способствует возобновлению дифференцировки остеокластов (рис. 1B) [40]. Одним из доказательств данного мнения служит выявление в крови у женщин в менопаузе, получающих деносумаб, увеличенного количества предшественников остеокластов и остеоморфов [41]. Снижение количества остеобластов, а также жизнеспособных остеоцитов после отмены лечения деносумабом также снижает скорость ремоделирования кости.

Рис. 1. Процессы, происходящие в костной ткани в присутствии деносумаба (А) и при его отмене (В)
А — механизм действия деносумаба. (1) RANKL синтезируется остеоцитами и остеобластами. Одновременно остеобласты синтезируют OPG. (2) Деносумаб связывается с RANKL, что приводит к предотвращению взаимодействия RANKL с RANK (3), ингибированию развития остеокластов из преостеокластов (4), процесса рециркуляции остеокластов (5) и дальнейшему нарушению функции и выживания дифференцированных остеокластов, однако одновременно это вызывает накопление преостеокластов и остеоморфов;
В — механизм возникновения нарушений при отмене деносумаба (синдром рикошета). Отмена деносумаба (1) напрямую приводит к накоплению RANKL при сниженном уровне OPG. Возобновляется образование остеокластов (2), дифференцировка и слияние остеоморфов в остеокласты (3), и активированные остеокласты (4) резорбируют кость
Fig. 1. Processes taking place in bone tissue with (A) and without (B) denosumab
A. Mechanism of action of denosumab: (1) Osteocytes and osteoblasts produce RANKL. At the same time, osteoblasts express OPG. (2) Denosumab binds to RANKL, resulting in (3) the prevention of RANKL interaction with RANK, (4) the inhibition of osteoclast development from pre-osteoclasts, (5) the process of osteoclast recycling, and further impairment of the function and survival of differentiated osteoclasts. At the same time, this causes the accumulation of preosteoclasts and osteomorphs.
B. Mechanism of the adverse effect (rebound effect) after denosumab discontinuation. The discontinuation (1) directly leads to the accumulation of RANKL with decreased OPG levels. The formation of osteoclasts (2) and the differentiation and fusion of osteomorphs into osteoclasts (3) resume, and activated osteoclasts (4) resorb bone.
Исследования на трансгенных мышах позволили предположить, что превышение уровня резорбции костной ткани при отмене деносумаба над показателями, которые были достигнуты в результате лечения, также может быть связано с недостатком OPG. Измерения нескольких типов мРНК показали значительное снижение мРНК OPG, но не RANKL. Вероятно, это связано с отсутствием остеобластов, способных продуцировать OPG, на момент отмены деносумаба [42].
Возможности предотвращения последствий отмены деносумаба
Согласно данным литературы, для снижения процессов костной резорбции и предупреждения переломов после прекращения терапии деносумабом возможно использование таких ЛП, как ромосозумаб, бисфосфонаты (алендронат и золедроновая кислота).
Ромосозумаб, гуманизированное моноклональное антитело, можно рассматривать как альтернативу деносумабу при отмене последнего [43], однако в литературе описан случай отсутствия эффективности ромосозумаба для предотвращения множественных спонтанных клинических переломов позвонков после отмены деносумаба [44].
Перспективным является применение бисфосфонатов [9][36][39][45–48] — аналогов неорганических пирофосфатов, в которых атом кислорода в соединении Р–О–Р заменен на атом углерода (Р–С–Р) для получения стабильной связи, что обеспечивает высокое сродство связывания молекулы с гидроксиапатитом кости. Бисфосфонаты подразделяются на азотсодержащие и не содержащие в структуре атомов азота, препараты этих подгрупп имеют разный механизм действия. В настоящее время шире применяют азотсодержащие бисфосфонаты (алендронат, ризедронат, ибандронат, памидронат и золедроновая кислота), прежде всего благодаря более сильному антирезорбтивному действию, чем у препаратов другой подгруппы.
Важнейшей фармакологической особенностью всех бисфосфонатов является их достаточно высокое сродство к костной ткани, что позволяет активно накапливаться в ней, концентрируясь в местах активного костного обмена [49][50]. Когда происходит резорбирование кости, высвобождающийся препарат ингибирует фермент фарнезилпирофосфатсинтазу мевалонатного пути и ухудшает работу остеокластов путем снижения способности последних образовывать рифленые границы и вырабатывать протоны, необходимые для резорбции кости, а также ускоряет апоптоз остеокластов, не оказывая, по-видимому, прямого влияния на процесс их рециркуляции [51], и таким образом снижает потерю костной ткани.
ЗАКЛЮЧЕНИЕ
Синдром рикошета, тяжелая нежелательная реакция при отмене деносумаба, может возникнуть у пациентов, принимавших препарат, несмотря на утвержденные меры минимизации риска. Отмена терапии деносумабом возможна только после консультации с лечащим врачом.
Изучение механизма развития синдрома рикошета позволило установить, что ингибирование RANKL деносумабом приводит к накоплению предшественников остеокластов и остеоморфов, из которых при прекращении действия препарата довольно быстро образуются остеокласты, резорбирующие костную ткань. Продолжение изучения процессов остеогенеза и, в частности, роли остеоморфов в регуляции резорбции кости будет иметь важное значение для понимания возможности влияния на патологические процессы, поиска новых мишеней фармакологического воздействия при ОП и разработки новых препаратов.
Для предупреждения переломов и повышения минеральной плотности костей после отмены деносумаба целесообразно применять бисфосфонаты. Однако для оценки возможностей терапии антирезорбтивными препаратами с целью предотвращения потери костной массы после отмены деносумаба необходимо проведение дальнейших исследований, в том числе направленных непосредственно на изучение влияния бисфосфонатов на рециркуляцию остеокластов.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Н.Ю. Вельц — планирование исследования, написание и редактирование текста рукописи, формулировка выводов; О.В. Вельц — идея, написание отдельных разделов рукописи; Р.Н. Аляутдин — написание и редактирование текста рукописи, утверждение окончательной версии рукописи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Nataliya Yu. Velts planned the study, drafted and edited the manuscript, and formulated the conclusions. Olga V. Velts conceived the idea of the study and drafted individual sections of the manuscript. Renad N. Alyautdin drafted and edited the manuscript and approved the final version for publication.
Список литературы
1. Белая ЖЕ, Белова КЮ, Бирюкова ЕВ, Дедов ИИ, Дзеранова ЛК, Драпкина ОМ и др. Федеральные клинические рекомендации по диагностике, лечению и профилактике остеопороза. Остеопороз и остеопатии. 2021;24(2):4–47. https://doi.org/10.14341/osteo12930
2. Доброхотова ЮЭ, Дугиева М.З. Постменопаузальный остеопороз: препараты кальция в современной стратегии профилактики и лечения. РМЖ. 2017;25(15):1135–9.
3. Srivastava RK, Sapra L. The rising era of “immunoporosis”: role of immune system in the pathophysiology of osteoporosis. J Inflamm Res. 2022;15:1667–98. https://doi.org/10.2147/JIR.S351918
4. Закроева АГ, Бабалян ВН, Габдулина ГХ, Лобанченко ОВ, Ершова ОБ, Исаева СМ и др. Состояние проблемы остеопороза в странах Евразийского региона. Остеопороз и остеопатии. 2020;23(4):19–29. https://doi.org/10.14341/osteo12700
5. Lesnyak O, Ershova O, Belova K, Gladkova E, Sinitsina O, Ganert O, et al. Epidemiology of fracture in the Russian Federation and the development of a FRAX model. Arch Osteoporos. 2012;7:67–73. https://doi.org/10.1007/s11657-012-0082-3
6. Park SY, Kim SH, Lee YK, Shin JH, Ha YC, Chung HY. Position statement: postmenopausal osteoporosis treatment strategies in Korea. J Bone Metab. 2023;30(4):289–95. https://doi.org/10.11005/jbm.2023.30.4.289
7. Сметник ВП. Постменопаузальный остеопороз: патофизиология, диагностика, приверженность лекарственной терапии — оригинальные препараты или дженерики. Медицинский Совет. 2013;(8):88–93.
8. Drejer LA, El-Masri BM, Ejersted C, Andreasen CM, Thomsen LK, Thomsen JS, et al. Trabecular bone deterioration in a postmenopausal female suffering multiple spontaneous vertebral fractures due to a delayed denosumab injection — a post-treatment re-initiation bone biopsy-based case study. Bone Rep. 2023;19:101703. https://doi.org/10.1016/j.bonr.2023.101703
9. Ricart Torres E. Fracturas vertebrales múltiples tras el efecto rebote de denosumab en una mujer con posmenopausia. Aten Primaria. 2024;56(2):102810. Ricart Torres E. Multiple vertebral fractures after rebound effect of denosumab in postmenopausal woman. Aten Primaria. 2024;56(2):102810 (In Spanish). https://doi.org/10.1016/j.aprim.2023.102810
10. De Vincentis S, Domenici D, Ansaloni A, Boselli G, D’Angelo G, Russo A, et al. COVID-19 lockdown negatively impacted on adherence to denosumab therapy: incidence of non-traumatic fractures and role of telemedicine. J Endocrinol Invest. 2022;45(10):1887–97. https://doi.org/10.1007/s40618-022-01820-8
11. Аврунин АС. Остеоцитарное ремоделирование: история вопроса, современные представления и возможности клинической оценки. Травматология и ортопедия России. 2012;1(63):128–34. EDN: OWZWNN
12. Dallas SL, Prideaux M, Bonewald LF. The osteocyte: an endocrine cell … and more. Endocr Rev. 2013;34:658–90. https://doi.org/10.1210/er.2012-1026
13. Schaffler MB, Cheung WY, Majeska R, Kennedy O. Osteocytes: master orchestrators of bone. Calcif Tissue Int. 2014;94(1):5–24. https://doi.org/10.1007/s00223-013-9790-y
14. Karsenty G, Kronenberg HM, Settembre C. Genetic control of bone formation. Annu Rev Cell Dev Biol. 2009:25:629–48. https://doi.org/10.1146/annurev.cellbio.042308.113308
15. Long F. Building strong bones: molecular regulation of the osteoblast lineage. Nat Rev Mol Cell Biol. 2011;13(1):27–38. https://doi.org/10.1038/nrm3254
16. Harada S, Rodan GA. Control of osteoblast function and regulation of bone mass. Nature. 2003;423(6937):349–55. https://doi.org/10.1038/nature01660
17. Plotkin LI, Bellido T. Osteocytic signalling pathways as therapeutic targets for bone fragility. Nat Rev Endocrinol. 2016;12(10):593–605. https://doi.org/10.1038/nrendo.2016.71
18. Blair HC, Larrouture QC, Li Y, Lin H, Beer-Stoltz D, Liu L, et al. Osteoblast differentiation and bone matrix formation in vivo and in vitro. Tissue Eng Part B Rev. 2017;23(3):268–80. https://doi.org/10.1089/ten.TEB.2016.0454
19. Boyce BF, Xing L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Arch Biochem Biophys. 2008;473(2):139–46. https://doi.org/10.1016/j.abb.2008.03.018
20. Yahara Y, Nguyen T, Ishikawa K, Kamei K, Alman BA. The origins and roles of osteoclasts in bone development, homeostasis and repair. Development. 2022;149(8):dev199908. https://doi.org/10.1242/dev.199908
21. Kim JM, Lin C, Stavre Z, Greenblatt MB, Shim JH. Osteoblast-osteoclast communication and bone homeostasis. Cells. 2020;9(9):2073. https://doi.org/10.3390/cells9092073
22. Sølling AS, Harsløf T, Jørgensen NR, Langdahl B. Changes in RANKL and TRAcP 5b after discontinuation of denosumab suggest RANKL mediated formation of osteoclasts results in the increased bone resorption. Osteoporos Int. 2023;34(3):599–605. https://doi.org/10.1007/s00198-022-06651-0
23. McDonald MM, Kim AS, Mulholland BS, Rauner M. New insights into osteoclast biology. JBMR Plus. 2021;5(9):e10539. https://doi.org/10.1002/jbm4.10539
24. Langdahl B, Ferrari S, Dempster DW. Bone modeling and remodeling: potential as therapeutic targets for the treatment of osteoporosis. Ther Adv Musculoskelet Dis. 2016;8(6):225–35. https://doi.org/10.1177/1759720X16670154
25. Crockett JC, Rogers MJ, Coxon FP, Hocking LJ, Helfrich MH. Bone remodelling at a glance. J Cell Sci. 2011;124(Pt 7):991–8. https://doi.org/10.1242/jcs.063032
26. Khosla S, Oursler MJ, Monroe DG. Estrogen and the skeleton. Trends Endocrinol Metab. 2012;23(11):576–81. https://doi.org/10.1016/j.tem.2012.03.008
27. Sobacchi C, Schulz A, Coxon FP, Villa A, Helfrich MH. Osteopetrosis: genetics, treatment and new insights into osteoclast function. Nat Rev Endocrinol. 2013;9(9):522–36. https://doi.org/10.1038/nrendo.2013.137
28. Mirza F, Canalis E. Management of endocrine disease: secondary osteoporosis: pathophysiology and management. Eur J Endocrinol. 2015;173(3):R131–51. https://doi.org/10.1530/EJE-15-0118
29. Riggs BL, Khosla S, Melton LJ 3rd. A unitary model for involutional osteoporosis: estrogen deficiency causes both type I and type II osteoporosis in postmenopausal women and contributes to bone loss in aging men. J Bone Miner Res. 1998;13(5):763–73. https://doi.org/10.1359/jbmr.1998.13.5.763
30. Clarke BL, Khosla S. Physiology of bone loss. Radiol Clin North Am. 2010;48:483–95. https://doi.org/10.1016/j.rcl.2010.02.014
31. Zhao R, Wang X, Feng F. Upregulated cellular expression of IL-17 by CD4+ T-cells in osteoporotic postmenopausal women. Ann Nutr Metab. 2016;68:113–8. https://doi.org/10.1159/000443531
32. Pietschmann P, Mechtcheriakova D, Meshcheryakova A, Foger-Samwald U, Ellinger I. Immunology of osteoporosis: a mini-review. Gerontology. 2016;62:128–37. https://doi.org/10.1159/000431091
33. Rauner M, Sipos W, Pietschmann P. Osteoimmunology. Int Arch Allergy Immunol. 2007;143:31–48. https://doi.org/10.1159/000098223
34. Cline-Smith A, Axelbaum A, Shashkova E, Chakraborty M, Sanford J, Panesar P, et al. Ovariectomy activates chronic low-grade inflammation mediated by memory T cells, which promotes osteoporosis in mice. J Bone Miner Res. 2020;35:1174–87. https://doi.org/10.1002/jbmr.3966
35. Ukon Y, Makino T, Kodama J, Tsukazaki H, Tateiwa D, Yoshikawa H, et al. Molecular-based treatment strategies for osteoporosis: a literature review. Int J Mol Sci. 2019;20(10):2557. https://doi.org/10.3390/ijms20102557
36. Appelman-Dijkstra NM, Oei HLDW, Vlug AG, Winter EM. The effect of osteoporosis treatment on bone mass. Best Pract Res Clin Endocrinol Metab. 2022;36(2):101623. https://doi.org/10.1016/j.beem.2022.101623
37. Chavassieux P, Portero-Muzy N, Roux JP, Horlait S, Dempster DW, Wang A, et al. Reduction of cortical bone turnover and erosion depth after 2 and 3 years of denosumab: iliac bone histomorphometry in the FREEDOM trial. J Bone Miner Res. 2019;34(4):626–31. https://doi.org/10.1002/jbmr.3631
38. McClung MR, Wagman RB, Miller PD, Wang A, Lewiecki EM. Observations following discontinuation of long-term denosumab therapy. Osteoporos Int. 2017;28(5):1723–32. https://doi.org/10.1007/s00198-017-3919-1
39. Kim AS, Girgis CM, McDonald MM. Osteoclast recycling and the rebound phenomenon following denosumab discontinuation. Curr Osteoporos Rep. 2022;20(6):505–15. https://doi.org/10.1007/s11914-022-00756-5
40. McDonald MM, Khoo WH, Ng PY, Xiao Y, Zamerli J, Thatcher P, et al. Osteoclasts recycle via osteomorphs during RANKL-stimulated bone resorption. Cell. 2021;184(5):1330–1347.e13. https://doi.org/10.1016/j.cell.2021.02.002
41. Fontalis A, Gossiel F, Schini M, Walsh J, Eastell R. The effect of denosumab treatment on osteoclast precursor cells in postmenopausal osteoporosis. Bone Reports. 2020;13:100457. https://doi.org/10.1016/j.bone.2016.08.010
42. Fu Q, Bustamante-Gomez NC, Reyes-Pardo H, Gubrij I, Escalona-Vargas D, Thostenson JD, et al. Reduced osteoprotegerin expression by osteocytes may contribute to rebound resorption after denosumab discontinuation. JCI Insight. 2023;8(18):e167790. https://doi.org/10.1172/jci.insight.167790
43. Ebina K, Hirao M, Tsuboi H, Nagayama Y, Kashii M, Kaneshiro S, et al. Effects of prior osteoporosis treatment on early treatment response of romosozumab in patients with postmenopausal osteoporosis. Bone, 2020;140:115574. https://doi.org/10.1016/j.bone.2020.115574
44. Kashii M, Ebina K, Kitaguchi K, Yoshikawa H. Romosozumab was not effective in preventing multiple spontaneous clinical vertebral fractures after denosumab discontinuation: а case report. Bone Reports. 2020;13:100288. https://doi.org/10.1016/j.bonr.2020.100288
45. Grassi G, Chiodini I, Palmieri S, Cairoli E, Arosio M, Eller-Vainicher C. Bisphosphonates after denosumab withdrawal reduce the vertebral fractures incidence. Eur J Endocrinol. 2021;185(3):387–96. https://doi.org/10.1530/EJE-21-0157
46. Tutaworn T, Nieves JW, Wang Z, Levin JE, Yoo JE, Lane JM. Bone loss after denosumab discontinuation is prevented by alendronate and zoledronic acid but not risedronate: a retrospective study. Osteoporos Int. 2023;34(3):573–84. https://doi.org/10.1007/s00198-022-06648-9
47. Laura I, Felicia B, Alexia C, Aude M, Florence B, Murielle S, et al. Which treatment to prevent an imminent fracture? Bone Rep. 2021;15:101105. https://doi.org/10.1016/j.bonr.2021.101105
48. Kong SH, Kim JH, Kim SW, Jeong AJ, Lee SH, Ye SK, Shin CS. Effect of denosumab on the change of osteoclast precursors compared to zoledronate treatment in postmenopausal women with osteoporosis. J Bone Metab. 2022;29(2):93–101. https://doi.org/10.11005/jbm.2022.29.2.93
49. Pavone V, Testa G, Giardina SMC, Vescio A, Restivo DA, Sessa G. Pharmacological therapy of osteoporosis: a systematic current review of literature. Front Pharmacol. 2017;8:803. https://doi.org/10.3389/fphar.2017.00803
50. Drake MT, Clarke BL, Khosla S. Bisphosphonates: mechanism of action and role in clinical practice. Mayo Clin Proc. 2008;83(9):1032–45. https://doi.org/10.4065/83.9.1032
51. Barnsley J, Buckland G, Chan PE, Ong A, Ramos AS, Baxter M, et al. Pathophysiology and treatment of osteoporosis: challenges for clinical practice in older people. Aging Clin Exp Res. 2021;33(4):759–73. https://doi.org/10.1007/s40520-021-01817-y
