Исследование эффективности, переносимости и безопасности препарата Хондрогард у пациентов с остеоартрозом
Статьи
Опубликовано в журнале:
«ФАРМАТЕКА»; № 7; 2013; стр. 60-64.
Л.И. Алексеева, С.Г. Аникин, Е.М. Зайцева, Н.Г. Кашеварова, Т.А. Короткова, Е.П. Шарапова, Н.В. Чичасова, Г.Р. Имаметдинова, Н.В. Бадокин, С.А. Колова
ФГБУ НИИР РАМН, Москва
Представлены результаты исследования по оценке эффективности, переносимости и безопасности внутримышечного введения хондроитина сульфата (ХС) больным остеоартрозом (ОА) коленных суставов. В 2-месячном проспективном исследовании приняли участие 70 человек, 67 (96 %) женщин и 3 (4 %) мужчины в возрасте 45-70 лет с первичным ОА коленных суставов II (79 %) и III (21 %) рентгенологических стадий по Kellgren-Lawrence, нуждавшихся в приеме нестероидных противовоспалительных средств (НПВС). Препарат ХС Хондрогарт вводили внутримышечно через день (всего 30 инъекций), исследование завершили 66 (94 %) человек. Результаты исследования показали, что терапевтический эффект наступал в среднем на 23-й день от начала лечения. Таким образом, Хондрогард обладает достоверным симптоматическим эффектом, уменьшая боль, скованность и улучшая функциональные показатели. Преимуществом препарата являются быстрое наступление эффекта, возможность отмены или снижения дозы НПВС на фоне лечения и хорошая переносимость. Препарат Хондрогард может быть рекомендован лицам, страдающим ОА, в качестве первого средства, дающего более быстрый эффект с последующей заменой его на пероральные формы.
Ключевые слова: остеоартроз, нестероидные противовоспалительные средства, хондроитина сульфат
The results of the study aimed to evaluation the efficacy, tolerability and safety of intramuscular administration of chondroitin sulfate (CS) in patients with osteoarthrosis (OA) of the knee are presented. The 2-month prospective study involved 70 patients, 67 (96 %) women and 3 (4 %) men aged 45-70 years with primary OA of knee joints II (79 % ) and III (21 %) radiographic stages by Kellgren-Lawrence, who were in need of administration of nonsteroidal anti-inflammatory drugs (NSAIDs). The drug Chondrogard was administered intramuscularly each alternate day (a total of 30 injections); 66 (94 %) patients have completed the study. The results showed that the therapeutic effect occurred at the 23th day of treatment on average. Thus, Chondrogard has significant symptomatic effect, reducing pain, stiffness, and improving functional performance. The advantages include the rapid onset of drug effect, potential for the withdrawal or reducing the NSAID dose during treatment, and good tolerability. The drug Chondrogard can be recommended to the OA patients as a first-line drug with a more immediate effect, with subsequent replacement by oral forms of drug.
Key words: osteoarthrosis, nonsteroidal anti-inflammatory drugs, chondroitin sulfate
Введение
Остеоартроз (ОА) — заболевание суставов, характеризующееся клеточным стрессом и деградацией экстрацеллюлярного матрикса, возникаютттих при макро- и микроповреждениях, которые активируют ненормальные адаптивные процессы восстановления, включая провоспалительные реакции иммунной системы, костного ремоделирования и образования остеофитов [1]. Основными клиническими проявлениями ОА являются боль различной степени выраженности, как правило механического стартового характера, умеренно выраженная непродолжительная скованность в суставах и нарушение функции. Терапия ОА носит комплексный характер и зависит от выраженности воспалительной реакции, степени функциональной недостаточности, структурных изменений и наличия сопутствующих заболеваний. В клинической практике наиболее часто для купирования симптомов ОА применяют нестероидные противовоспалительные средства (НПВС). Однако их применение может оказывать токсическое действие на органы желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы, почек и печени. Российские, Европейские и Американские руководства рекомендуют использовать НПВС короткими курсами в минимальных эффективных дозах [2, 3]. В 2003 г. Европейская антиревматическая лига (EULAR — The European League Against Rheumatism) отдельно выделила группу лекарственных средств, определяемых как препараты замедленного действия для симптоматической терапии ОА (SYSADOA — symptomatic slow acting drugs for osteoarthritis). К настоящему времени накоплен большой научный и клинический опыт, позволивший сделать предварительные выводы и о возможном наличии структурно-модифицирующего эффекта, присущего этим препаратам.
ХС является типичным представителем группы лекарственных средств замедленного действия. Несмотря на то что ХС используется в медицине уже более 30 лет, до настоящего времени не утихают споры о месте и роли этого препарата в терапии пациентов с ОА, что, впрочем, относится ко всей группе лекарственных средств замедленного действия. Отражением этих споров, в частности, являются рекомендации Американской коллегии ревматологов, где авторы условно не рекомендуют использовать ХС и глюкозамин в качестве терапии пациентов с ОА [4]. Тем не менее в большинстве национальных рекомендаций, включая и таких авторитетных организаций, как Международное общество по изучению ОА (OARSI — Osteoarthritis Research Society International) и EULAR, ХС включен в качестве терапевтического средства для лечения пациентов с ОА.
Фармакокинетика и биологическая активность ХС в значительной степени определяются массой молекулы и степенью сульфатирования [10]. В качестве исходного сырья для получения ХС используется хрящевая ткань крупного рогатого скота, свиней, цыплят или рыб [11-14]. Разные источники получения ХС определяют особенности молекулярной структуры ХС, что в свою очередь помимо степени очистки оказывает влияние на эффективность применения того или иного препарата.
Большая часть ХС выпускается в виде форм для перорального применения. При попадании в ЖКТ происходит разрушение большинства молекул ХС, и в системный кровоток, как правило, попадают низкомолекулярные дериваты, обладающие небольшой терапевтической активностью. По некоторым данным, доля нативных молекул в системном кровотоке при пероральном приеме составляет всего 10 %. Максимальная концентрация препарата в крови достигается через 3-4 часа после приема, а в синовиальной жидкости — через 4-5 часов. В целом же биодоступность ХС при пероральном приеме составляет в среднем от 10 до 20 % [15-17].
При внутримышечном введении ХС выявляется в значительных концентрациях в системном кровотоке уже через 30 минут, а максимальная концентрация достигается через час. В синовиальной жидкости препарат выявляется через 15 минут после внутримышечной инъекции, а максимальная концентрация в хрящевой ткани достигается через 48 часов [18]. Внутримышечный способ введения ХС увеличивает биодоступность и долю нативных молекул в системном кровотоке, благодаря чему может повышаться как эффективность проводимой терапии, так и более быстрое развитие симптоматического эффекта.
Целью исследования явилась оценка эффективности, переносимости и безопасности ХС (Хондрогарда) для пациентов с ОА коленных суставов при внутримышечном применении.
Материал и методы
В 2-месячное проспективное когортное исследование были включены 70 человек с диагнозом ОА коленных суставов, среди них были 67 (96 %) женщин и 3 (4 %) мужчины. Диагноз остеоартроза устанавливался на основе классификационных критериев Американской коллегии ревматологов (АКР) 1986 г. [5].
Критерии включения:
В исследование не включали лиц с вторичным гонартрозом, внутрисуставным введением любых препаратов за последние 6 недель до начала исследования, наличием хондрокальциноза, асептического некроза мыщелков бедренных и большеберцовых костей, оперативных вмешательств на коленном суставе, а также с известной повышенной чувствительностью к ХС, тяжелыми сопутствующими заболеваниями, язвой желудка или двенадцатиперстной кишки в течение последнего месяца, кровотечениями в анамнезе, тромбофлебитами, беременностью и периодом лактации, принимавшими препараты с симптоматическими и структурно-модифицирующими свойствами. Разрешалось использование НПВС, которые пациенты принимали на момент включения в исследование. Не допускались внутрисуставные инъекции, в т. ч. глюкокортикоидов и препаратов гиалуроновой кислоты, прием антикоагулянтов, антиагрегантов, фибринолитиков, проведение физиотерапевтических процедур.
В исследование вошли лица в возрасте от 45 до 70 лет, средний возраст составил 61,0 ± 6,4 года, рост — 1,63 ± 0,06 м, масса тела — 81,6 ± 12,9 кг, индекс массы тела (ИМТ) — 31 ± 4,6 кг/м2, медиана длительности заболевания — 9 лет (25-й, 75-й процентили -5 и 12 лет), медиана длительности последнего обострения — 2 месяца (25й, 75-й процентили — 1,4 и 4,0 месяца). Наиболее выраженная симптоматика на момент включения в исследование, как правило, отмечалась в правом коленном суставе (64 %) по сравнению с левым (36 %). При этом большинство (79 %) лиц имели ОА II рентгенологической стадии и 21 % — ОА III стадии.
Характеристика участников исследования представлена в табл. 1.
Таблица 1
Характеристика участников исследования
| Параметры | Мин. | Макс. | Среднее | SD |
| Возраст, годы | 45 | 70 | 61 | 6,4 |
| Рост, м | 1,5 | 1,77 | 1,63 | 0,06 |
| Масса тела, кг | 54 | 110 | 81,6 | 12,9 |
| ИМТ, кг/м2 | 22 | 40 | 31 | 4,6 |
| Длительность болезни |
Медиана — 9 лет, 25-й процентиль — 5 лет, 75-й процентиль — 12 лет |
|||
| Длительность обострения |
Медиана — 2 месяца, 25-й процентиль — 1,4 месяца, 75-й процентиль — 4 месяца |
|||
|
Пол: Ж — 67 (96 %), М — 3 (4 %) |
||||
|
Суставы: правый — 64 %, левый — 36 % |
||||
|
Рентгенологическая стадия: II — 79 %, III — 21 % |
В качестве показателей эффективности использовали динамику индекса WOMAC (Western Ontario and McMaster University) в целом, а также отдельных параметров: значение боли, скованность и функциональная недо статочность (ФН). Оценивали динамику изменений скорости ходьбы на 15 метров, потребность в НПВС на протяжении исследования и общую оценку эффекта пациентом в конце исследования. Также оценивали частоту и характер нежелательных явлений (НЯ), их связь с исследуемым препаратом.
Всем пациентам через день внутримышечно вводили ХС на протяжении 2 месяцев (№ 30). Первые три инъекции выполнялись в дозе 1 мл (100 мг), последующие — в дозе 2 мл (200 мг). В случае необходимости пациенты продолжали терапию НПВС, при этом применения другого НПВС на протяжении исследования не допускалось.
Статистическая обработка данных проведена с помощью программы SPSS 16.0. Результаты представлены в виде среднего значения и стандартного отклонения или медианы и 25-й и 75-й процентилей. Нормальность распределения оценивали с помощью теста Колмогорова-Смирнова. Оценка изменений проведена с помощью однофакторного дисперсионного анализа с повторными измерениями и парного t-теста.
Результаты исследования
Всего в исследовании приняли участие 70 человек, среди них 67 (96 %) женщин и 3 (4 %) мужчины. Полностью завершили исследование 66 (94 %) человек, 4 (6 %) пациента выбыли: трое — в результате появления НЯ и один — из-за отсутствия эффекта от проводимой терапии.
Терапия ХС в виде внутримышечных инъекций была эффективной для большинства больных. Были выявлены статистически значимые улучшения как отдельных показателей: боль, скованность, ФН, так: и WOMAC в целом. Результаты представлены на рис. 1.

Рис 1. Динамика показателей WOMAC, боли, скованности функциональной недостаточности (указаны средние значения), р < 0,001 для всех показателей
Показатели WOMAC значимо уменьшились уже через две недели, в среднем на 167 (14 %) мм (95 % доверительный интервал [ДИ] — 112—219; р < 0,001), а через 2 месяца — на 465 (39 %) мм (95 % ДИ — 387— 569; р < 0,001).
На фоне лечения препаратом Хондрогард отмечено статистически значимое уменьшение боли по шкале WOMAC через две недели на 14 %, или в абсолютных значениях — на 35 мм (95 % ДИ — 21—49; р < 0,001). При продолжении терапии ко второму месяцу положительная динамика достигла 43 %, что соответствовало снижению боли в среднем на 104 мм (95 % ДИ — 85—124; р < 0,001).
Скованность в оцениваемом коленном суставе через 2 недели статистически значимо уменьшилась на 14 мм (95 % ДИ — 8—22; р < 0,001), 15 %, через два месяца — на 39 мм (95 % ДИ —31—51; р < 0,001), 41 %. Отмечено статистически значимое улучшение функциональных показателей через 2 недели на 13 % и снижение ФН на 116 мм (95 % ДИ —78—154; р < 0,001), ко второму месяцу терапии улучшение достигло 37 %, а показатели ФН снизились на 321 мм (95 % ДИ — 265—393; р < 0,001; табл. 2).
Таблица 2
Динамика показателей WOMAC, боли, скованности ФН в процессе лечения
| Параметры | День 0 | 14-й день | 2-й месяц | р |
| WOMAC | 1207 (350) | 1040 (404), 14 % | 742 (412), 39 % | < 0,001 |
| Боль | 245 (65) | 210 (86), 14 % | 141 (87), 43 % | < 0,001 |
| Скованность | 95 (37) | 81 (38), 15 %, 14 мм | 56 (40), 39 мм, 41% | < 0,001 |
| ФН | 866 (265) | 750(297) | 545 (297), 321, 37 % | < 0,001 |
Примечание. Указаны средние значения, в скобках абсолютные значения в мм.
Через две недели терапии достигнуто незначительное увеличение скорости прохождения дистанции 15 метров, время прохождения дистанции снизилось на 0,75 секунды (95 % ДИ — 0,12— 1,38, р = 0,021), 5 %; через 2 месяца — на 1,88 секунды (95 % ДИ — 1,25—2,51, р < 0,001), 13 %.
Из 63 пациентов, отметивших положительный эффект от проводимой терапии, полностью прекратили прием НПВС 28 (44 %) человек, или 40 % от общего числа участников исследования. Уменьшили дозу в 2 раза или стали принимать НПВС не чаще 1 раза в 3 дня 21 (33 %) участник, или 30 % от общего их числа. Отметили улучшение состояния, но продолжали принимать прежнюю дозу НПВС 14 (22 %), или 20 % от общего числа участников. Два человека прекратили прием НПВС, но отметили усиление симптоматики и в дальнейшем выбыли из исследования.
В среднем на 23 ± 10-й день пациенты отмечали эффект от лечения. Из 70 участников исследования эффективность препарата оценили 68 человек (двое выбыли и не принимали участие в общей оценке). Из оставшихся 68 пациентов полностью закончили исследование 66 и 2 выбыли, но также принимали участие в оценке эффективности. Хороший эффект препарата отметил 41 (59 %) пациент, удовлетворительный — 22 (31 %) и 5 (7 %) человек не заметили какого-либо эффекта (рис. 2).
Рис. 2. Общая оценка пациентами эффективности терапии ХС, %
В ходе исследования были выявлены следующие НЯ: небольшие гематомы в месте введения препарата — 8 (11%) пациентов; кожный зуд, папулезную сыпь — 4 (6 %); болезненные уплотнения в месте инъекции — 2 (3 %); чувство жара после инъекции — 1 (1 %); тошноту, диарею — 1 (1%). Серьезные НЯ отсутствовали.
Из-за НЯ выбыли 3 (4 %) человека и 1 — из-за неэффективности лечения. При этом у двоих отмечены папулезная сыпь и кожный зуд, что было расценено исследователями как реакция, связанная с препаратом; у одного пациента — тошнота и диарея, которые купировались после прекращения введения препарата. Эта реакция также была расценена исследователями как связанная с применением препарата.
Обсуждение
ХС относится к группе препаратов замеленного действия для симптоматической терапии ОА, препарат обладает большим спектром биологической активности, оказывая влияние почти на все ключевые моменты патогенеза ОА. Литература располагает массой работ, в которых оценивался симптомагический эффект ХС. В некоторых мета-анализах был выявлен значимый эффект ХС на боль, скованность и ФН. Так, у 372 больных ОА Leeb и соавт. [6] отметили положительный эффект ХС на боль 0,9 (95 % ДИ 0,8—1,0) и функцию суставов 0,74 (95 % ДИ -0,65-0,85). По данным мета-анализа 15 рандомизированных контролируемых исследований (РКИ) McAlindon и соавт. [7] обнаружили достаточно выраженный эффект ХС. Размер общего терапевтического эффекта составил 0,78 (95 % ДИ — 0,6-0,95). Согласно общепринятому подходу, эффект менее 0,2 рассматривается как незначительный, 0,5 — как средний и более 0,8 -как выраженный. Однако при учете только крупномасштабных исследований или исследований, характеризующихся высоким качеством, показатели размера эффекта снижались. Проведя мета-анализ 20 РКИ влияния ХС на боль у 3846 больных ОА коленных и тазобедренных суставов, Reichenbach и соавт. [8] тоже выявили довольно высокие показатели эффективности проведенной терапии — 0,75 (-0,99 до -0,5).
В представленной работе, которая имела дизайн открытого проспективного исследования, авторы выявили статистически значимое улучшение показателей боли, скованности, ФН и общего WOMAC по сравнению с исходными данными уже через две недели, хотя изменения и не достигли уровня клинической значимости (улучшение показателя более чем на 20 %). Однако уже ко второму месяцу терапии все значения индекса WOMAC (боль, скованность, ФН) снизились на 43 %, 41 и 37 % соответственно. Эффект от проводимой терапии отмечен 90 % пациентов, в 3 % случаев присутствовал положительный эффект, однако после отмены НПВС этот эффект исчезал. В РКИ, проведенном в США (n = 1583) [9], авторы в целом не обнаружили клинически значимого влияния ХС и глюкозамина на показатели боли (эффект считался клинически значимым при снижении уровня боли на 20 %) по сравнению с плацебо. Однако комбинированное применение ХС и глюкозамина лицами с умеренными и выраженными болями оказалось более эффективным по сравнению с плацебо (79,2 против 54,3 % соответственно; р = 0,002).
Недостаточная эффективность применения ХС может быть обусловлена различными причинами: особенностью самого препарата, его химической структурой, степенью очистки, способом введения препарата, а также активностью заболевания и степенью деструктивных изменений в суставе.
Следует отметить, что ХС обладает высоким профилем безопасности. Ни в одном из проведенных клинических исследований не было выявлено каких-либо значимых побочных эффектов, в т. ч. и при длительном применении. EULAR рассматривает ХС в качестве одного из самых безопасных лекарственных препаратов терапии ОА. При использовании внутримышечных форм отмечено увеличение числа локальных побочных эффектов по сравнению с пероральными. В нашем исследовании в 8 (11 %) случаях были выявлены небольшие гематомы в месте введения препарата, что указано в инструкции по применению Хондрогарда; кожный зуд; папулезная сыпь — в 4 (6 %); болезненные уплотнения в месте инъекции — в 2 (3 %); чувство жара после инъекции — в 1 (1 %); тошнота, диарея — в 1 (1 %) случае. Серьезные НЯ отсутствовали.
Таким образом, препарат Хондрогард, представляющий собой раствор ХС натрия для внутримышечного применения, обладает достоверным симптоматическим эффектом, уменьшая боль, скованность и улучшая функциональные показатели. Преимущество препарата состоит в быстром наступлении эффекта при внутримышечном применении, возможности отмены или снижения дозы НПВС на фоне лечения и хорошей переносимости. Препарат Хондрогард может быть рекомендован в качестве терапии лицам, страдающим ОА, как первое средство, дающее более быстрый эффект с последующей заменой его на пероральные формы.
ЛИТЕРАТУРА
1. Lane NE, Brandt K, Hawker G и соавт. OARSIFDA initiative: defining the disease state of osteoarthritis. Osteoarthritis Cartilage 2011;19(5):478-82.
2. Клинические рекомендации. Ревматология / Под ред. Е.Л. Насонова. М., 2010. 326 с.
3. Zhang W, Nuki G, Moskowitz RW, et al. OARSI recommendations for the Management of hip and knee osteoarthritis Part III: changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage 2010;18(4): 476-99.
4. Hochberg MC, Altman RD, April KT, et al. American college of Rheumatology 2012 Recommendations for the Use of Nonpharmacologic and Pharmacologic Therapies in Osteoarthritis of the Hand, Hip and Knee. Arthritis Care & Res 2012;64(4):465-74.
5. Клинические рекомендации. Ревматология / Под ред. Е.Л. Насонова. М.,2010. 329 с.
6. Leeb BF, Schweitzer H, Montag K, et al. A metaanalysis of chondroitin sulfate in the treatment of osteoarthritis. J Rheumatol 2000;27(1): 205-11.
7. McAlindon TE, LaValley MP, Gulin JP, Felson DT. Glucosamine and chondroitin for treatment of osteoarthritis: a systematic quality assessment and meta-analysis. JAMA 2000;283(11):1469-75.
8. Reichenbach S, Sterchi R, Scherer M, et al. Meta-analysis: chondroitin for osteoarthritis of the knee or hip. Ann Intern Med 2007;146(8): 580-90.
9. Clegg DO, Reda DJ, Harris CL, et al. Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis. N Engl J Med 2006;354(8):795-808.
10. Volpi N, ed. Chondroitin sulfate: structure, role and pharmacological activity. Amsterdam: Academic Press, 2006.
11. Fuentes EP, Diaz VB. Oligosaccharide mapping of chondroitin sulfate obtained from different animal sources. Acta Farm Bonaerense 1998;17:135-42.
12. Luo XM, et al. Chicken keel cartilage as a source of chondroitin sulfate. Poult Sci 2002;81: 1086-89.
13. Sugahara K, et al. Structural analysis of unsaturated hexasaccharides isolated from shark cartilage chondroitin sulfate D that are substrates for the exolytic action of chondroitin ABC lyase. Eur J Biochem 1996;239:871-80.
14. Lignot B, Lahogue V, Bourseau P. Enzymatic extraction of chondroitin sulfate from skate cartilage and concentration-desalting by ultra filtration. J Biotechnol 2003;103:281-84.
15. Volpi N. Quality of different chondroitin sulfate preparations in relation to their therapeutic activity. J Pharm Pharmacol 2009;61(10): 1271-80.
16. Volpi N. Oral absorption and bioavailability of ichthyic origin chondroitin sulfate in healthy male volunteers. Osteoarthritis Cartilage 2003;11(6):433-41.
17. Volpi N. Oral bioavailability of chondroitin sulfate (Condrosulf) and its constituents in healthy male volunteers. Osteoarthritis Cartilage 2002;10(10):768-77.
18. Ronca F, Palmieri L, Panicucci P, Ronca G. Antiinflammatory activity of chondroitin sulfate. Osteoarthritis Cartilage 1998;6 Suppl A:14-21.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Остеоартроз (остеоартрит) – гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими и клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондрального участка кости, синовиальной оболочки, связок, капсулы, периартикулярных мышц [1]. Основу патогенеза остеоартроза составляют нарушения физиологических процессов деградации и синтеза хондроцитов, внеклеточного матрикса и субхондральной кости [2–4]. Одним из ведущих механизмов патогенеза остеоартроза является дефицит хондроитина сульфата [5, 6]. Европейская антиревматическая лига (EULAR – The European League Against Rheumatism) отдельно выделила группу лекарственных средств, определяемых как препараты замедленного действия для симптоматической терапии остеоартроза (SYSADOA – symptomatic slow acting drugs for osteoarthritis). Хондроитина сульфат является типичным представителем группы лекарственных средств замедленного действия [1, 5, 7].
Оптимальным препаратом для терапии первичного остеоартроза является Хондрогард (хондроитина сульфат для внутримышечного введения в концентрации 100 мг действующего вещества в 1 мл раствора). Хондрогард представляет собой высокомолекулярный мукополисахарид, влияющий на обменные процессы в гиалиновом хряще, препарат уменьшает дегенеративные изменения в хрящевой ткани суставов, ускоряет процессы ее восстановления, стимулирует синтез протеогликанов.
Для оценки эффективности и переносимости препарата Хондрогард на базе ревматологического кабинета ФКУЗ МСЧ МВД РФ по Ульяновской области было проведено открытое клиническое исследование, в которое были включены 60 пациентов (32 женщины и 28 мужчин) с двусторонним первичным гонартрозом (36 пациентов) и двусторонним первичным коксартрозом (24 пациента).
Дизайн исследования соответствовал рекомендациям Европейской антиревматической лиги (EULAR) Outcome Measures in Arthritis Clinical Trials (OMERACT III) и представлял собой рандомизированное двойное слепое контролируемое исследование в параллельных группах с активным контролем. Диагноз «остеоартроз» был установлен в соответствии с критериями ACR 1987 г. [6, 7]. Все пациенты, средний возраст которых составлял 52,36±4,04 года, были разделены на 2 группы (табл. 1). Больные 1-й группы (n=30) получали только Хондрогард в/м в дозе 200 мг ежедневно, на курс 20 инъекций. Больные 2-й группы (n=30) – Хондрогард в/м в дозе 200 мг (на курс 20 инъекций) по интермитирующей схеме (через день); при этом допускалось применение нестероидного противовоспалительного препарата (НПВП) Немулекс по потребности (при интенсивных болях) в суточной дозе не более 200 мг. Соответственно, у пациентов 1-й группы курс терапии составил 20 календарных дней, у пациентов 2-й группы – 40.
У пациентов в обеих группах исследовался суммарный индекс Лекена (индекс тяжести для гонартроза и коксартроза), индекс боли по визуально-аналоговой шкале (ВАШ), терапевтический эффект по мнению пациента и врача, качество жизни (в соответствии с опросником качества жизни SF-36), оценивались побочные эффекты терапии. Клинические показатели определялись до начала терапии и после ее окончания. Критерии включения в исследование: наличие первичного остеоартроза коленных и тазобедренных суставов I–III стадии по Келлгрену-Лоуренсу [8], наличие боли в целевом суставе от 40 мм по ВАШ, индекс Лекена от 4 до 12 баллов, согласие пациента на участие в клиническом исследовании (все пациенты до начала терапии подписали информированное согласие). Критерии исключения из исследования: наличие у пациента помимо первичного остеоартроза воспалительной артропатии или системного заболевания соединительной ткани, предшествующее внутрисуставное введение глюкокортикоидов, физиотерапевтическое лечение в течение предшествующего исследованию месяца.
Статистическая обработка материала проводилась с использованием программ Microsoft Office Excel 2010 и Statistica Base 6.0. Применялись методы описательной статистики, непараметрические методы. Статистическая значимость показателей была определена как р<0,05. При описании признаков применялись медиана (M) и стандартное отклонение (σ – standard deviation). В случае отклонения распределения от нормального закона среднее значение использовать некорректно, т. к. оно является слишком чувствительным параметром к так называемым «выбросам» – нехарактерным для изучаемой выборки, слишком большим или слишком малым значениям. В этом случае для характеристики центральной тенденции в выборке должен применяться другой параметр – медиана. Этот параметр (в отличие от среднего значения) устойчив к «выбросам». Медиана может использоваться и в случае нормального распределения – тогда она совпадает со средним значением [10]. В данном клиническом наблюдении было отдано предпочтение именно медиане, поскольку исследуемые признаки имели нормальное распределение. При сравнении двух зависимых групп по количественному признаку использовался Т-критерий Стьюдента.
Диаграммы рассеяния обычно используются для визуального исследования зависимости двух переменных. Этот тип статистических графиков представляет собой составной график с зависимостью между двумя переменными и распределениями частот для каждой переменной [10]. В данном клиническом наблюдении исследовалась взаимосвязь между исходными данными (индекс Лекена до лечения) и результатами, полученными к концу терапии Хондрогардом. При оценке индекса Лекена у пациентов в обеих группах по окончании курса терапии Хондрогардом выявлено статистически значимое снижение интенсивности боли, увеличение максимальной дистанции при ходьбе, повышение функциональной активности (p*=0,00191, p**=0,00167; рис. 1).
По результатам проведенного клинического исследования в обеих группах пациентов выявлено статистически значимое снижение интенсивности боли по ВАШ (p=0,0009). На столбчатой диаграмме (рис. 2) отображено распределение отдельных измерений параметров, высота каждого столбца указывает на частоту появления значений параметров в выбранном диапазоне, а количество столбцов – на число выбранных диапазонов. Важное преимущество данного графика заключается в том, что он позволяет наглядно представить тенденции изменения измеряемых параметров качества объекта и зрительно оценить закон их распределения.
Качество жизни пациентов оценивалось по анкете оценки качества жизни SF-36 [9]. Этот опросник составляют вопросы, касающиеся взглядов больных на свое здоровье, он содержит 36 вопросов и 8 шкал. По результатам исследования было отмечено значительное улучшение качества жизни у всех участвовавших в исследовании пациентов, а именно: увеличение физической активности, включая самообслуживание, ходьбу, подъем по лестнице; повышение показателей по шкале ролевого физического функционирования (Role Physical); снижение интенсивности болевого синдрома; улучшение общего здоровья и повышение сопротивляемости болезни; повышение показателей шкалы жизнеспособности; повышение уровня социальной активности; повышение уровня ролевого эмоционального функционирования; улучшение психологического здоровья (p<0,0001).
У пациентов во 2-й группе на 10-й день интермитирующей терапии Хондрогардом значительно снизилась потребность в НПВП – 23 пациента отказались от приема Немулекса, что свидетельствует в пользу анальгезирующего эффекта препарата Хондрогард.
Нежелательные реакции (побочные эффекты терапии) по типу кратковременной болезненности в месте инъекции Хондрогарда, вздутия живота и усиления артралгий были отмечены у 3 (10%) пациентов в 1-й группе и у 4 (13%) – во 2-й группе исследуемых. Все нежелательные реакции были купированы назначением симптоматической терапии и не требовали отмены Хондрогарда.
Была отмечена солидарность при оценке эффективности терапии препаратом Хондрогард врачом и пациентами: очень хорошо – 37%, хорошо – 58%, удовлетворительно – 5%, плохо – 0%.
При оценке времени наступления клинического эффекта (в днях) у пациентов 1-й и 2-й групп была выявлена тенденция к снижению интенсивности боли и увеличению функциональных возможностей к середине курса терапии: у пациентов 1-й группы – к 10-му дню терапии, 2-й группы – к 20-му дню терапии.
Диаграмма размаха применяется для сравнения диапазонов значений нескольких переменных (или нескольких функций) путем представления их на одном графике, использующем общие шкалы [10]. В нашем случае сравнивались показатели индекса Лекена в 1-й и 2-й группах до и после лечения. На графике средних (рис. 3) видно, что эффективность Хондрогарда в 1-й и 2-й группах была примерно одинаковой (p* =0,00071, p** =0,00067), что позволяет применять препарат в клинической практике как в виде ежедневных внутримышечных инъекций, так и по интермитирующей схеме (через день).
Сравнительная эффективность терапии Хондрогардом в 1-й и 2-й группах оценивалась по Т-критерию Стьюдента. Т-критерий для зависимых выборок очень полезен в тех довольно часто возникающих на практике ситуациях, когда важный источник внутригрупповой вариации (или ошибки) может быть легко определен и исключен из анализа [10]. Это относится к экспериментам, в которых две сравниваемые группы основываются на одной и той же совокупности наблюдений (субъектов) и тестируются дважды (до и после лечения). По результатам проведенного анализа выявлено статистически значимое снижение интенсивности боли и улучшение функциональных показателей у пациентов в обеих группах (p=0,0000001; табл. 2).
По результатам проведенного открытого клинического исследования выявлена эффективность Хондрогарда как симптом-модифицирующего препарата в терапии первичного остеоартроза крупных суставов. Хондрогард оказывает значительный анальгезирующий эффект и позволяет расширять функциональные возможности и улучшать качество жизни у пациентов с первичным гонартрозом и коксартрозом. Препарат обладает хорошей переносимостью в терапевтических дозах, побочные эффекты незначительны и не требуют отмены.
Таким образом, учитывая сопоставимую эффективность 1-й и 2-й схем примененной в данном исследовании терапии, препарат Хондрогард может быть рекомендован к применению по 1-й схеме при оказании медицинской помощи в стационарных условиях и с использованием 2-й схемы – при амбулаторно-поликлиническом лечении.

Литература
1. Алексеева Л.И., Цветкова Е.С. Остеоартроз: из прошлого в будущее // Научно-практическая ревматология. 2009. Прил. № 2. С. 31–37.
2. Дроздов В.Н., Ким В.А. Диагностика и лечение остеоартрита. Методические рекомендации. М.: МИК, 2010. 23 с.
3. Каратеев А.Е. Лечение остеоартроза с точки зрения безопасности фармакотерапии. // Современная ревматология. 2009. № 1. С.1–8.
4. Loeser R.F. Jr. Aging and the etiopathogenesis and treatment of osteoarthritis // Rheum. Dis. Clin. North Am. 2003. Vol. 26. № 3. P. 547–567.
5. Bierma-Zeinstra S., Bohnen A., Ginai A. et al. Validity of American College of Rheumatology criteria for diagnosing hip osteoarthritis in primary care research // J. Rheumatol. 2003. Vol. 26. № 5. P.1129–1133.
6. Шостак Н.А. Остеоартроз: актуальные вопросы диагностики и лечения // РМЖ. 2014. № 4. С. 278.
7. Zhang W., Donerty M., Peat G. et al. EULAR evidence-based recommendations for the diagnosis of knee osteoarthritis // Ann. Rheum. Dis. 2010. Vol. 69 (3). P. 483–489.
8. Kellgren J.H., Lawrence J.S. Radiografhic assessment of osteoarthritis // Ann. Rheum. Dis. 1957. Vol.16 (4). P. 494–501.
9. Амирджанова В.Н., Горячев Д.В., Коршунов Н.И. и др. Популяционные показатели качества жизни по опроснику SF-36 (результаты многоцентрового исследования качества жизни «МИРАЖ») // Научно-практическая ревматология. 2008. №1.
10. Thomas A. Lang, Michelle Secic. How To Report Statistics in Medicine // Amer. Coll. Physicians. 2006.
Исследование эффективности действия препарата Хондрогард (хондроитина сульфат) у пациентов с остеоартрозом
В.П.Волошин1, А.В.Еремин1, С.А.Санкаранараянан1, М.Ю.Тукаев2, И.В.Садовый3, П.С.Бардюгов4, С.А.Темесов5 1Московский областной научно-исследовательский клинический институт им. М.Ф.Владимирского 2Красногорская городская больница №2 3Городская больница г. Московский Центральная клиническая больница Ленинского района Московской области,
Видное
5Истринская Городская Больница
В настоящем исследовании представлены результаты применения препарата Хондрогард (хондроитина сульфат) у 422 пациентов с остеоартрозом коленных суставов. Продолжительность исследования составила 2 года. В проведении исследования принимали участие врачи-травматологи, работающие в амбулатор-но-поликлиническом звене ЛПУ Московской области. Парентеральное введение препарата Хондрогард проводилось внутримышечно в дозе 1 мл (100 мг) через день (первые 3 инъекции), четвертая и последующие инъекции по 2 мл (200 мг), также через день. Всем пациентам, изначально включенным в программу исследования, было выполнено 30 инъекций препарата в течение 2 мес. В результате проведенного исследования выявлена клиническая эффективность Хондро-гарда в лечении больных с остеоартрозом.
Ключевые слова: хондроитина сульфат, Хондро-гард, остеоартроз.
Study onEffectiveness of Hondrogard (Chondroitin Sulfate) in Patients with
Osteoarthritis
V. P.Voloshin1, A.V.Eryomin, S.A.Sankaranarayanan1, M.Yu.Yukaev2, I.V.Sadovy3, P.S.Bardyugov4, S.A.Temesov5 1M.F.Vladimirsky Moscow Region State Science and Research Clinical Institute, Moscow 2Krasnogorsk City Hospital №2, Moscow Region 3Moskovsky City Hospital, Moscow Region
4Leninsky District Clinical Hospital, Vidnoe
City, Moscow Region 5Istra City Hospital, Moscow Region
The paper presents the results of 2 years Hondrogard (Chondroitin Sulfate) trial on its effectiveness in 422 patients with chronic knee osteoarthritis. The trial was provided by traumatologists of outpatient care services in Moscow region. Hondrogard 1 ml (100 mg) was injected IM every other day (1st three administrations); others injections starting with 4th one were made in the dose of 2 ml (200 mg) IM every other day. All patients involved had generally got 30 IM injections of the drug during 2 months. The study revealed effectiveness of Hondrogard for chronic osteoarthritis patients.
Keywords: chondroitin sulfate, Hondrogard, osteo-arthritis.
Введение
Остеоартроз (ОА) — дегенеративно-дистрофическое заболевание суставов, причиной которого является поражение хрящевой ткани суставных поверхностей с последующим присоединением воспалительной реакции [1]. ОА встречается более чем у 70% пациентов в возрасте 60-65 лет [2]. Патологическим процессом поражаются, прежде всего, коленные и тазобедренные суставы, что значительно ухудшает качество жизни и приводит к инвалидизации, прежде всего лиц пожилого возраста. Представляя серьезную социально-экономическую проблему, заболевание является одной из основных причин стойкой потери трудоспособности. По данным EULAR (2003), риск нетрудоспособности вследствие остеоартроза коленных суставов равен риску, связанному с заболеваниями сердца, и находится на 4-м месте среди основных причин нетрудоспособности у женщин и на 8-м месте — у мужчин [3].
В основе остеоартроза лежит нарушение равновесия между анаболическими и катаболическими процессами в тканях сустава и гиалиновом хряще. Медленно прогрессирующее течение заболевания приводит к постепенному уменьшению объема гиалинового хряща, до полной его потери. Также наблюдается воспаление синовиальной оболочки, костное ремоделирование и формирование субхондрально-го склероза, образование остеофитов и субхонд-ральных кист, появляется фиброз суставной капсулы. Важное значение в происхождении боли принадлежит воспалению, которое имеет первостепенное значение в развитии и прогрессировании ОА [4].
Лечение ОА предполагает воздействие на все возможные этапы патогенеза. Комплекс проводимых мероприятий зависит от степени выраженности болевого синдрома, характера воспалительных явлений, функциональной недостаточности и сопутствующей патологии. Для воздействия на симптомы ОА в периоды обострения применяются нестероидные противовоспалительные средства (НПВС) [6, 7]. Однако, применение этой группы лекарственных средств ограничено в связи с негативным воздействием на органы желудочно-кишечного тракта. Общепринятой схемой лечения является прием минимально эффективных доз НПВС [7, 8]. Основной целью терапии остеоартроза является купирование болевого синдрома, замедление прогрессирования дегенеративно-дистрофического процесса, предотвращение поражения интактных суставов, сниже-
Сведения об авторе:
Волошин Виктор Парфентьевич — д.м.н., руководитель Клиники ортопедии и травматологии ГБУЗ МОНИКИ им. М.Ф.Владимирского
О
оо
VH
Ж.
Р
го
го
-О
•н
.а.
ние риска обострения и предупреждение побочных эффектов фармакотерапии.
Для симптоматического лечения ОА выделена группа наиболее изученных и доказательных препаратов замедленного действия, имеющих естественные компоненты хрящевого межклеточного вещества — глюкозамин и хондроитина сульфат [3, 5]. Хондроитина сульфат (ХС) относится к специфическим средствам, которые характеризуются медленным развитием симптом-модифицирующего действия, выраженным последействием в течение 4-8 нед и более и обладают потенциальными структурно-модифицирующими (хондропротективными) свойствами. Высокомолекулярный мукополисаха-рид хондроитина сульфат оказывает влияние на обменные процессы в гиалиновом хряще, способствует уменьшению дегенеративных изменений в хрящевой ткани суставов, ускоряет процессы регенерации, стимулирует синтез протеогликанов. ХС накапливается, главным образом, в хрящевой ткани суставов. Синовиальная оболочка не является препятствием для проникновения препарата в полость сустава [9]. Максимальный эффект ХС наступает при начальных признаках поражения суставного аппарата, однако действие препарата происходит также и при развитии клинической картины остео-артроза, замедляя при этом прогрессирование процесса. Включение Хондроитина сульфата в комплексную терапию позволяет снизить дозы НПВП и сократить сроки приема анальгетиков [5]. Форма выпуска большей части препаратов ХС предназначена для перорального применения, однако их биодоступность значительно ниже биодоступности препаратов для внутримышечного введения.
Материал и методы
В исследование с 2012 г. включены 422 пациента, 276 женщин и 146 мужчин в возрасте 45-78 лет с первичным ОА коленных суставов II (79%) и III (21%) рентгенологических стадий по KeПgren-Lawrence, нуждавшихся в приеме нестероидных противовоспалительных средств (НПВП). Длительность заболевания составила от 3 мес до 20 лет, среднее значение -6 лет. Продолжительность последнего обострения от 1 до 12 нед, среднее значение — 5 нед. У 40% пациентов наблюдалась наиболее выраженная симптоматика поражения левого коленного сустава, у 60% пациентов — правого.
До начала и в течение последующего проведения исследования НПВС принимали 295 пациентов (70%), не принимали НПВС 127 пациентов (30%).
В исследование не были включены пациенты после выполненных операций на коленных суставах, перенесшие интраартикулярное введение различных препаратов в течение последних 6 мес, получающие глюкокортикоиды, а так же физиотерапевтическое лечение. Разрешалось использование НПВС, которые пациент принимал на момент начала исследования.
Препарат Хондрогард был назначен в дозе 1 мл (100 мг) через день (первые три иньекции), четвертая и последующие иньекции — 2 мл (200 мг). Всего было проведено 30 внутримышечных инъекций на протяжении 2 мес.
Исследование по изучению эффективности препарата Хондрогард включало 4 визита: V! — скрининг и начало терапии, V2 — 2 нед от начала терапии, V3 — 1 мес от начала терапии (телефонный контакт с пациентом), V4 — 2 мес (окончание терапии). Во время первого визита — скрининга выполнялась оценка соответствия критериям включения в программу исследования и выявлялись критерии исключения из исследования. Проводилось заполнение карты пациента и осуществлялось введение 1 дозы препарата Хондрогард. Допускалось участие в исследовании пациентов, принимавших хондропротекторы и прекративших их прием не менее чем за 6 мес до включения в программу. Во время 2-го и 4-го визитов проводился учет нежелательных явлений и заполнялась карта пациента. В течение периода между 2-м и 4-м визитами осуществлялся телефонный контакт, выявлялись нежелательные явления, переносимость препарата, подтверждалось соблюдение протокола исследования пациентом.
Критерии отбора для программы исследования:
• мужчины и женщины в возрасте от 45 до 70 лет;
• установленный диагноз первичного тибио-фемо-рального остеоартроза, согласно критериям АРА;
• боли по визуальной аналоговой шкале при ходьбе на расстояние 40 м;
• остеоартроз II или III стадия по KeПgren-Lawrence;
• потребность в приеме НПВП (прием в течение 30 дней за последние 3 мес).
Информация о препарате
ХОНДРОГАРД® (ФармФирма «Сотекс», Россия) Раствор для внутримышечного введения
О
о
I—
со
го
.а
.сх
ФАРМАКОДИНАМИКА
Высокомолекулярный мукополисахарид, влияющий на обменные процессы в гиалиновом хряще. Уменьшает дегенеративные изменения в хрящевой ткани суставов, ускоряет процессы ее восстановления, стимулирует синтез протеогликанов. При лечении препаратом уменьшается болезненность и улучшается подвижность пораженных суставов. При лечении дегенеративных изменений суставов с развитием вторичного синовита, положительный эффект может наблюдаться уже через 2-3 нед после начала введения препарата: уменьшается боль в суставах, исчезают клинические проявления реактивного синовита, увеличивается объем движений в пораженных суставах. Терапевтический эффект сохраняется длительное время после окончания курса лечения.
ФАРМАКИНЕТИКА
После внутримышечного введения хондроитина сульфат быстро распределяется. Уже через 30 мин после инъекции он обнаруживается в
крови в значительных концентрациях. Максимальная концентрация (Стах) хондроитина сульфата в плазме достигается через 1 ч, затем постепенно снижается в течение 2 суток. Хондроитина сульфат накапливается, главным образом, в хрящевой ткани суставов. Синовиальная оболочка не является препятствием для проникновения препарата в полость сустава. В экспериментах показано, что через 15 мин после внутримышечной инъекции хондроитина сульфат обнаруживается в синовиальной жидкости, затем проникает в суставной хрящ, где его Стах достигается через 48 ч.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Дегенеративно-дистрофические заболевания суставов и позвоночника: остеоартроз периферических суставов; межпозвонковый остеохондроз и остеоартроз.
Другие разделы: см. в инструкции по медицинскому применению.
Анализ интенсивности болевого синдрома по шкале ВАШ
Препарат Диагноз Визит V2 Визиты V3-V4
отсутствие боли слабый болевой синдром умеренный болевой синдром сильная боль отсутствие боли слабый болевой синдром умеренный болевой синдром сильная боль
Хондрогард Гонартроз п=95 (22,5%) п=211 (50%) п=116 (27,5%) — п=326 (77,3%) п=96 (22,7%) — —
Критерии исключения из программы исследования:
• вторичный гонартроз, инфекционный артрит, системные воспалительные заболевания суставов, подагра, псевдоподагра, болезнь Педжета, внутрисуставные переломы, охроноз, акромегалия, гемохро-матоз, болезнь Вильсона, первичный хондроматоз;
• внутрисуставное введение любых препаратов в течение 6 нед до начала исследования;
• хондорокальциноз;
• асептический некроз мыщелков бедренной и большеберцовой костей;
• оперативное вмешательство на коленном суставе;
• известная повышенная чувствительность к хонд-роитина сульфату;
• тяжелые сопутствующие сердечно-сосудистые и эндокринные заболевания;
• язвенная болезнь желудка и двенадцатиперстной кишки в течение последнего месяца;
• кровотечение и склонность к кровоточивости;
• тромбофлебиты в анамнезе;
• беременность;
• период лактации.
Показатели эффективности
• динамика WOMAC (боли, скованность и функциональная недостаточность), изменение индекса в % относительно начального визита;
• время ходьбы на расстояние 15 м;
• потребность в НПВП.
Оценка эффективности терапии врачом и пациентом.
Критерии исключения больных из исследования:
• неэффективность терапии основного заболевания — сохранение или усиление болевого синдрома, требующего изменения терапии;
• серьезные нежелательные явления;
• отказ пациента от участия в исследовании;
• нарушения протокола исследования.
Болевой синдром оценивался по шкале ВАШ. Оценка болевого синдрома по этой шкале удобна в амбулаторно-поликлинических условиях. Умеренную боль (2 балла) испытывали 103 (24,4%) пациента, сильную боль (3 балла) — 79 (18,7%) пациентов.
Всем пациентам была назначена общепринятая медикаментозная терапия, которая включала НПВП, витамины группы В, рекомендован оптимальный двигательный режим.
Результаты и обсуждение
В ходе исследования установлена хорошая переносимость препарата Хондрогард. Неблагоприятных реакций как общих, так и местных (в местах инъекций), отмечено небыло. Критериями эффективности препарата в лечении остеоартроза были отсутствие боли и изменение ее интенсивности.
Учитывая отличительные особенности хондропро-тективных препаратов — время наступления эффекта спустя 2-8 нед, анализ исследования приведен в соответствующие сроки. Применение препарата Хондрогард привело к значительному улучшению
состояния пациентов: на 14-е сутки боль купирована в 50% случаев, на 60-е сутки — у 68,7% наблюдавшихся пациентов (см. таблицу).
Для оценки эффективности проводимого лечения были изучены показатели индекса WOMAC и показатели шкалы ВАШ. Необходимо отметить, что изучение материала с использованием опросов имело отчасти субъективный характер. При изучении индекса WOMAC получены несколько иные данные, чем при анализе показателей шкалы ВАШ. Индекс WOMAC отражает физическое состояние, в отличие от индекса ВАШ, характеризующего физическое и психическое здоровье пациентов.
Суммарно, степень выраженности болевого синдрома у всех наблюдавшихся пациентов по шкале ВАШ в начале исследования оценивалась как 364 мм, через 1 нед после начала исследования -344 мм (уменьшение относительно начального визита — 5,5%), через 1 мес — 260 мм (уменьшение относительно начального визита — 28,6%), и в конце исследования — 178 мм (уменьшение относительно начального визита — 51,1%).
Ощущение утренней скованности в начале исследования в совокупности составило 234 мм, через 1 нед — 230 мм (уменьшение относительно начального визита — 1,7%), через 1 мес — 198 мм (уменьшение относительно начального визита — 15,4%), в конце исследования — 142 мм (уменьшение относительно начального визита — 39,3%).
Среднее время прохождения расстояние 15 м в начале исследования составило — 11,6 с, через неделю -11,6 с (без изменений по сравнению с первичными показателями), через 1 мес — 11,2 (уменьшение относительно начального визита — 3,4%), в конце исследования — 10,1 с (уменьшение относительно начального визита — 12,9%).
Суммарная оценка степени функциональной недостаточности: в начале исследования — 1680 мм, через 1 нед — 1626 мм (уменьшение по сравнению с первым визитом — 3,2%), через 1 мес — 1390 мм (уменьшение по сравнению с первым визитом -17,3%), в конце исследования — 1034 (уменьшение по сравнению с первым визитом — 38,5%).
Динамика показателей WOMAC такова: в начале исследования — 2282 мм, через 1 нед — 2116 мм (положительная динамика — 7,28%), через 1 мес — 1848 мм (положительная динамика — 19,02%), в конце исследования — 1354 (положительная динамика — 40,67%) (см. рисунок).
Во всех случаях применения НПВС длительность приема составила не более 14 дней. Отмечались нежелательные явления в виде гиперемии в месте инъекций — 24 случая (5,7% от общего числа пациентов). Подобное состояние купировалось достаточно быстро после местного лечения и было обусловлено спецификой введения препарата. Изжога, отмеченная в 6 случаях (1,4% от общего числа пациентов) имела временный характер и была купирована после коррекции диеты. Тошнота, выявленная в 4 случаях (1% от общего числа пациентов) была купирована без применения медикаментозных средств. Все пациенты, принимавшие участие в программе исследования, успешно провели полный курс лечения.
о го
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
VH
Ж.
Р
го
го
-О
•н
.а.
о
о
I—
со
го
-О
s
.CP
Динамический показатель оценки выраженности болевого синдрома, утренней скованности, функциональной недостаточности и суммарного WOMAC по шкале ВАШ
Субъективная оценка эффективности препарата Хондрогард (хондроитина сульфат), проведенная пациентами как «удовлетворительная» отмечена в 146 случаях (34,6%), «хорошая» — в 277 случаях (65,7%).
Заключение
В результате проведенного исследования выявлена клиническая эффективность препарата Хондрогард (хондроитина сульфат), обладающего симп-том-модифицирующим действием у пациентов с ос-теоартрозом, по показателям купирования болевого синдрома, уменьшения скованности, улучшения функции пораженных суставов и суммарного WOMAC. Отмечено, что выраженность эффекта нарастает на протяжении всего периода исследования, достигнув максимума к концу 2-го месяца после начала применения препарата.
При изучении эффективности проводимой терапии подтвержден высокий показатель безопасности применения препарата и отсутствие серьезных побочных явлений. Обнаруженные нежелательные явления в большинстве случаев обусловлены способом введения препарата и купированы без последствий.
Данные исследования позволяют рекомендовать Хондрогард (хондроитина сульфат) как достоверно эффективный в повседневной клинической практике препарат для лечения больных с остеоартрозом в дневном стационаре и в амбулаторно-поликлиниче-ских условиях.
Литература
1. Покровский В. И. Малая медицинская энциклопедия. 1996; 4: 577.
2. Volpi N. Chondroitin sulphate for the treatment of osteoarthritis. Curr Med Chem. Anti-Inflammatory and Anti-Allergy Agents, 2005; 4: 221-234.
3. Jordan K.M., Arden N.K., Doherty M. et al. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis 2003; 62: 1145-1155.
4. Бадокин В.В. Значение воспаления в развитии и течении ос-теоартроза. Consilium medicus. 2009; 11 (9): 91-95.
5. Кригштейн О.С., Голубев Г.Ш. Оценка доказательств эффективности средств, претендующих называться «структурно-моди-фицируюими препаратами», 2004-2007 гг. Клинич. фармакология и фармакоэкономика. 2008; 1: 55-88.
6. Насонов Е.Л. Нестероидные противовоспалительные препараты (Перспективы применения в медицине). М.: Анко, 2000.
7. Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б. и др. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. М.: ИМА-ПРЕСС, 2009.
8. Zhang W., Nuki G., Moskowitz R.W. et al. OARSI recommendations for the Management of hip and knee osteoarthritis Part III: changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage. 2010; 18 (4): 476-99.
9. Алексеева Л.И. Симптоматические препараты замедленного действия при лечении ОА. Consilium medicus. 2009; 11 (9): 100-104.

ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.
Автор статьи
Профессия: провизор
Название вуза: Пермская государственная фармацевтическая академия (ПГФА)
Специальность: провизор- технолог. Интернатура на кафедре фармацевтическая технология лекарственных средств
Стаж работы: 8 лет
Диплом о фармацевтическом образовании: 105924 1197876, рег. номер 30353
Места работы: провизор в аптеке, провизор сервиса Мегаптека
Все авторы
Содержание
- Хондрогард: состав
- Хондрогард таблетки
- Что лучше: Алфлутоп или Хондрогард?
- Румалон или Хондрогард: что лучше?
- Мукосат или Хондрогард: что эффективнее
- Драстоп или Хондрогард: что лучше
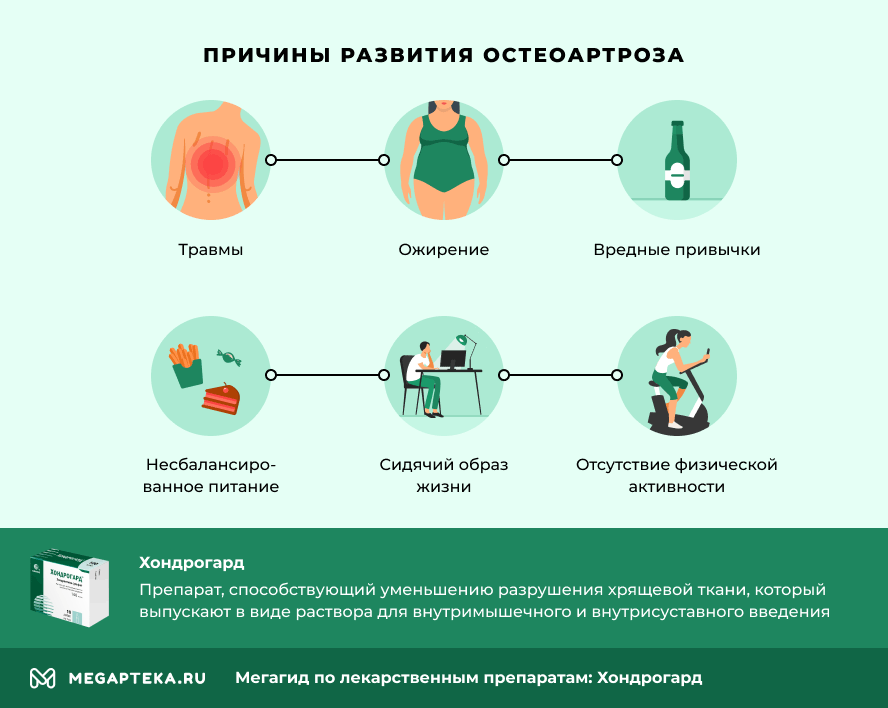
Остеоартроз молодеет во всем мире. Еще в прошлом веке заболевание связывали в основном с «изнашиванием» суставов. Это, в принципе, подтверждает и статистика: после 65 лет распространенность остеоартроза достигает 90%. Но, кроме неизбежного старения, развитию болезни способствуют травмы, ожирение, вредные привычки, несбалансированное питание, сидячий образ жизни и отсутствие физической активности. Врачи обеспокоены тем, что артрозом все чаще страдают молодые люди, подростки и даже дети.
Лечение остеоартроза (ОА) включает ограничение нагрузок, физиотерапию, лечебную физкультуру и медикаментозное лечение. В крайних случаях прибегают к замене разрушенных крупных суставов эндопротезами.
Если говорить о лекарствах, то в российские клинические рекомендации по терапии остеоартроза включены хондропротекторы. Это средства медленного действия, необходимые для построения и обновления суставного хряща. Провизор рассказывает о препарате Хондрогард и сравнивает его с аналогами: Алфлутоп, Румалон, Мукосат и Драстоп.
Хондрогард: состав
Российский препарат Хондрогард выпускают в виде раствора для внутримышечного и внутрисуставного введения. Действующее вещество — хондроитина сульфат в количестве 100 мг на 1 мл.
Хондроитина сульфат представляет собой высокомолекулярное белково-углеводное вещество — мукополисахарид, которое вместе с коллагеном является основой хряща. Введение хондроитина уменьшает разрушение хрящевой ткани и помогает ее восстановлению. Хондрогард уколы снимают боль и улучшают подвижность суставов.
Хондрогард таблетки
Компания ФармФирма «Сотекс» производит Хондрогард только в ампулах и шприцах для инъекционного введения. Пероральные формы не выпускаются.
Что лучше: Алфлутоп или Хондрогард?
Алфлутоп — оригинальный препарат природного происхождения. В его составе очищенный биоактивный концентрат, который получают из мелкой морской рыбы. Концентрат содержит хондроитина сульфат, аминокислоты, пептиды и ионы натрия, калия, магния, кальция, железа, меди и цинка.
Алфлутоп также, как и Хондрогард, защищает и восстанавливает хрящевую ткань. В отличие от Хондрогарда у него нет данных, с какой скоростью проникает в полость сустава и как выводится из организма, так как действующее вещество — биоконцентрат.
В России было проведено исследование* на тему: «Алфлутоп или Хондрогард — что эффективнее при остеоартрите коленных суставов». Выборка пациентов была недостаточной, условия не соответствовали международным стандартам. Исследование показало, что значимых различий в действии двух препаратов нет.
Показания к применению, побочные действия и противопоказания у Алфлутопа схожи с таковыми у Хондрогарда. Оба препарата вводятся внутримышечно или в полость сустава, отпускаются по рецепту и назначить их может только лечащий врач с учетом всех индивидуальных особенностей пациента.
Румалон или Хондрогард: что лучше?
Румалон — комбинированный препарат животного происхождения. Это один из самых первых хондропротекторов в медицине. Содержит гликозаминогликан-пептидный комплекс. который стимулирует синтез мукополисахаридов и коллагена, восстанавливает хрящ, а также снижает активность разрушающих хрящ ферментов. Как и в случае с Алфлутопом, у него тоже нет данных по метаболизму в организме.
Область применения у препаратов одинаковая, но Румалон используют только для внутримышечного введения. Хондрогард обладает обезболивающим действием и восстанавливает подвижность суставов. Подобные свойства Румалона в инструкции не отмечены. Противопоказаний больше у Хондрогарда: его нельзя ставить пациентам с тромбофлебитами и склонностью к кровотечениям. Но Румалон за счет животных белков может вызвать сильную аллергическую реакцию.
Румалон не подходит для внутрисуставного применения, которое считается более эффективным (активные вещества попадают сразу внутрь пораженного сустава). Но при внутримышечном применении курс лечения Румалоном составляет порядка 20 инъекций в течение 6 недель, а Хондрогардом — 25-30 инъекций в течение 8 недель.
Однозначно ответить на вопрос: «Румалон или Хондрогард — что эффективнее?» нельзя. Для быстрого купирования боли и восстановления подвижности сустава лучше подойдет Хондрогард. Лечащий врач подбирает терапию индивидуально исходя из показаний, стадии заболевания, сопутствующих болезней пациента. Препараты отпускают по рецепту и консультация врача обязательна.
Мукосат или Хондрогард: что эффективнее
Мукосат — линейка хондропротекторов, которая производится в России и Сербии. Включает лекарственные формы (раствор для инъекций и мазь для наружного применения) и БАДы (капсулы и шипучие таблетки).
Состав инъекционной формы идентичен составу Хондрогарда, действующее вещество — хондроитина сульфат, показания, противопоказания, побочные эффекты — те же. Отличия только в том, что для производства Хондрогарда используют только испанскую субстанцию хондроитина, а для Мукосата — из России, Аргентины и Испании.
Мукосат или Хондрогард — что лучше? Возможно, при комплексном использовании Мукосата внутрь, наружно и инъекционно эффективность лечения будет выше. Но назначить терапевтическую схему может только врач.
Драстоп или Хондрогард: что лучше
Драстоп — инъекционный хондропротектор из Турции, содержащий хондроитина сульфат. Выпускают в растворе только по 2 мл (200 мг) для внутримышечного применения. Субстанцию для производства Драстопа используют аргентинскую.
Препараты можно заменять, если врач назначил внутримышечные уколы в дозе 200 мг. Если надо ставить инъекции в сустав или в дозе 100 мг — подойдет только Хондрогард. В одинаковой дозе и фасовке Драстоп имеет более низкую цену по сравнению с Хондрогардом.
Провизор напоминает: «Хондропротекторы не способны полностью вылечить пораженные суставы. Их назначают на ранних стадиях развития болезни. Если хрящ сильно разрушен, то лекарства не помогут».
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же вы можете поделиться своим опытом с другими читателями Мегасоветов.
от 1 710 ₽
Состав
Раствор для внутримышечного введения1 амп./1 шприцдействующее вещество:хондроитина сульфат натрия100/200 мгвспомогательные вещества: бензиловый спирт— 9/18 мг; натрия метабисульфит— 1/2 мг; натрия гидроксид— до pH 6–7,5/до pH 6–7,5; вода для инъекций— до 1/2 мл
Описание
Раствор: прозрачный бесцветный или со слегка желтоватым оттенком, с запахом бензилового спирта.
Фармакологические свойства
Фармакологическое действие — регенерирующее, хондростимулирующее.
Показания к применению
дегенеративно-дистрофические заболевания суставов и позвоночника:- остеоартроз периферических суставов;- межпозвонковый остеохондроз и остеоартроз;ускорение формирования костной мозоли при переломах.
Противопоказания
повышенная чувствительность к препарату или его компонентам;кровотечения и склонность к кровоточивости;тромбофлебиты;беременность и период лактации (данные о безопасности применения препарата в настоящее время отсутствуют);детский возраст.
Способ применения и дозы
В/м, по 100 мг через день. При хорошей переносимости дозу увеличивают до 200 мг, начиная с 4-й инъекции. Курс лечения— 25–30 инъекций. При необходимости через 6 мес возможно проведение повторного курса лечения.Для формирования костной мозоли курс лечения составляет 3–4 нед (10–14 инъекций через день).
Побочное действие
Аллергические реакции (кожный зуд, эритема, крапивница, дерматит), геморрагии в месте инъекции.
Передозировка
В настоящее время о случаях передозировки хондроитина сульфата не сообщалось.
Взаимодействие с другими лекарственными средствами
Возможно усиление действия непрямых антикоагулянтов, антиагрегантов, фибринолитиков, что требует более частого контроля показателей свертывания крови при совместном применении.
Условия хранения
В защищенном от света месте, при температуре не выше 25°C. Хранить в недоступном для детей месте.
Срок годности
3 года. Не применять по истечении срока годности, указанного на упаковке.2000-2017. Регистр лекарственных средств России
Условия отпуска
По рецепту.
