Пациентка с болезнью Бехтерева рассказала об инновационном лечении
узнать из выпуска новостей, что ученым удалось создать препарат от ранее неизлечимого заболевания.

В апреле 2024 года в России зарегистрировали первый в мире препарат, потенциально способный остановить развитие болезни Бехтерева. Наталья из Санкт-Петербурга с этим диагнозом живет много лет. Она стала одной из первых пациенток в России, которой была проведена инновационная терапия в рамках ОМС. В интервью «Газете.Ru» Наталья рассказала о своей болезни и о том, каково это — узнать из выпуска новостей, что ученым удалось создать препарат от ранее неизлечимого заболевания.
— Наталья, расскажите, пожалуйста, что такое болезнь Бехтерева?
— Это хроническое воспалительное заболевание суставов. Оно приводит к воспалению в позвоночнике и суставах с развитием боли и ограничением движений, вплоть до неподвижности. На начальном этапе его можно спутать с остеохондрозом или радикулитом. Если у вас когда-то «простреливало» или болело в пояснице, защемляло шею, то вы можете примерно представить, что чувствует человек с болезнью Бехтерева.
Разница в том, что симптомы при радикулите или остеохондрозе проходят и достаточно быстро устраняются, а в моем случае боль и дискомфорт изматывали меня и днем, и ночью на протяжении многих лет. Болезнь Бехтерева связывают с генетическими и наследственными причинами. По сути, моя иммунная система объявила войну моим же суставам и связкам.
— Расскажите о себе. Какой была ваша жизнь до болезни?
— Диагноз мне поставили в 37 лет врачи Клиники нервных болезней Военно-медицинской Академии им. Кирова. До этого момента о болезни Бехтерева я не знала и даже не слышала. Уже потом, когда начала читать о том, что это за диагноз и как с ним жить, я сопоставила свои многолетние жалобы на ограниченное движение и ноющую сильную боль в шейном отделе позвоночника, затрудненное дыхание и утреннюю скованность в грудной клетке и плечевом суставе, боли в ноге — и пазл сложился.
До момента, когда я попала в больницу и мне провели генетическое исследование крови, я жила обычной жизнью: окончила институт, вышла замуж, работала. Мой муж военный, и мы часто переезжали. 10 лет жили в Ленинградской области, а последние 8 лет — в Петербурге. В нашей семье трое детей. У них разница в несколько лет, поэтому, когда мне становилось плохо физически, боль в спине усиливалась и не отпускала ни днем, ни ночью, я, конечно, связывала это с тем, что не спускаю детей с рук и просто накопилась усталость.
В юношеском возрасте я активно занималась спортом и, возможно, путала симптомы болезни с последствиями физической нагрузки от тренировок. Потом я окончила Сибирский государственный университет физической культуры и спорта. Работала фитнес-тренером, параллельно вела тренировки по аэробике, то есть всегда была активна и ежедневно занималась физкультурой. Поэтому проблемы с суставами и связками я связывала с высокой интенсивностью занятий, думала, что где-то дала себе слишком большую нагрузку, и лечилась массажами, мазями, мне прописывали уколы, которые должны были снять воспаление.
Дети мне тоже дались тяжело: каждые следующие роды проходили сложнее. Теперь уже кажется, что жизни до болезни у меня не было. Болезнь была со мной всегда, на всех этапах. Просто я не понимала степени своих проблем.
— Когда вы узнали, что у вас именно это заболевание? И с какими симптомами вы обратились к врачам?
— На протяжении многих лет я отмахивалась от боли в шейном отделе, плечевом суставе, в ноге. При этом своевременно проходила диспансеризацию, следила за здоровьем, поскольку много тренировалась. Повторюсь, диагноз мне поставили в 37 лет. Воспалительный процесс пошел вверх по позвоночнику. В какой-то момент у меня перестала двигаться шея: я не могла повернуть голову ни влево, ни вправо, ни опустить ее, ни поднять.
Я обратилась в поликлинику, надеялась, что поможет физиотерапия. Мне назначили курс уколов. Но постоянные боли только нарастали. Увеличилась скованность. Дискомфорт в грудной клетке усиливался. Меня положили в больницу, я прошла курс массажа, мне делали уколы и капельницы, но ничего не помогало. Как итог: мне провели рентгенологические исследования, а при генетическом тестировании крови выявили HLA-B27. Так я узнала, что у меня неизлечимая болезнь Бехтерева, мои суставы будут деформироваться, позвоночник костенеть, а боль не отступит.
— Было ли у вас в тот момент ощущение упущенного времени на лечение?
— Конечно, мне бы хотелось как можно раньше узнать о причинах своих недугов. Это очень важно. И это не только ответственность врачей, но и самих пациентов. Нельзя заниматься самолечением, пропускать анализы, важен постоянный контроль состояния.
Болезнь Бехтерева на начальном этапе часто упускают из виду. Мой пример показателен: я многие годы пыталась вылечить радикулит. При этом чем раньше человек узнает свой диагноз, тем больше можно сделать для сохранения активности и работоспособности. По сути, диагностика сводится к рентгеновскому исследованию, которое может показать первые признаки окостенения позвонков, и генетическому анализу. Теперь я знаю, что этот тест проводят для выявления предрасположенности к аутоиммунным заболеваниям или для уточнения диагноза.
— С какими проблемами сталкивается пациент с болезнью Бехтерева? С какими пришлось столкнуться вам?
— Эта болезнь забирает все силы. Кажется, что просвета нет. Болит всегда и все. Боль не проходит ни днем, ни ночью, а после отдыха только усиливается. Как будто всю ночь мое тело били палками. Утром встаешь, а сил уже нет, и откуда их брать, непонятно. Жить с болезнью Бехтерева сложно, но я стараюсь не зацикливаться на диагнозе, чтобы не разрушать себя изнутри.
По долгу службы мой муж много времени проводит вне дома. Он наша главная опора и поддержка, но, к сожалению, мы его очень редко видим. Поэтому можно сказать, что забота о доме, о детях полностью легла на меня. Работу за меня никто не сделает, точно так же, как никто не накормит детей, не проверит уроки, не отведет к врачу, если это необходимо. Жаловаться не в моей привычке. Никто не может понять мою боль. Объяснять каждому, что из-за болезни я не могу жить так, как жила прежде, я не хочу.
Я делаю, что должна. Конечно, я хотела бы быть здоровым человеком. Особенно сложно, когда ты не можешь строить планы на будущее, потому что не знаешь, удастся ли взять болезнь под контроль. Сейчас мне 42 года. Это тоже возраст, когда ты можешь и хочешь многое, но, увы, скован болезнью. Мечты заперты в теле, которое не слушается, которое сопротивляется самому факту того, что ты просыпаешься утром и встречаешь новый день. Это сложно понять другим людям. И потом, когда ты болеешь неделю, потом выздоравливаешь и идешь дальше, то, конечно, тебе посочувствуют. А когда ты годами демонстрируешь свою слабость и зависимость от болезни, то люди от этого устают. Этой темы начинают избегать, и я их понимаю.
— Тем не менее вы не оставили работу учителя?
— Я продолжаю работать и стараюсь идти в ногу с коллегами. Я веду физическую культуру и уроки ЛФК для детей в подготовительных группах. Им рекомендована сниженная физическая нагрузка. Конечно, на работе нужно решать задачи в ритме здорового человека. Мысли, что ты недостаточно хорош как работник, постоянно грызут. От боли, от усталости ты уязвим. Нужно принять тот факт, что тебя быстро вычеркнут и заменят, если ты выпадешь из обоймы. Но я для себя решила, что хочу и буду работать до конца.
— Какое лечение вам назначали врачи после постановки диагноза?
— Мне назначили традиционную схему для болезни Бехтерева: нестероидные противовоспалительные препараты и обезболивающие. Лечение было направлено на торможение дальнейшего развития воспаления. Главная задача заключалась в том, чтобы сохранить подвижность позвоночника и суставов. Но последние обследования, которые я прошла летом, показали, что болезнь распространилась уже и на грудную клетку. Позвоночник, спина, шея — как монолит, неподвижны. Я поворачиваюсь всем корпусом. Приглушенная боль остается даже на фоне приема препаратов, а после того, как действие лекарства ослабевает, она ударяет со всей силы.
— А как вы узнали, что в России зарегистрировали инновационное лекарство для лечения болезни Бехтерева? И самое главное, как вы оказались в числе первых пациентов, которым удалось получить его по ОМС?
— Я испытала непередаваемые эмоции, когда услышала по телевизору, что Минздрав России зарегистрировал первый в мире препарат, способный остановить болезнь Бехтерева. В новостях сказали, что лекарство разработали российские ученые.
Это был шок. Я прильнула к экрану, слушала и не верила. Дело даже не в том, что я столько лет живу с болью, — я научилась справляться. Но у меня трое детей, а болезнь Бехтерева — воспалительное генетическое заболевание. Мне рекомендовали сделать анализы детям, чтобы исключить этот диагноз у них. Но я тяну, не могу решиться, будто мое незнание способно что-то изменить. Вы не представляете мой ужас, когда ребенок в состоянии покоя жалуется на боль в ногах. Поэтому, когда я увидела сюжет о препарате, за спиной будто выросли крылья. Мысли были только о том, как получить эту терапию, к кому обращаться.
Я начала собирать информацию, писать письма в медицинские учреждения, читать новости, социальные сети. Позже я узнала, что получить консультацию по вопросу назначения препарата можно в нескольких федеральных центрах, в том числе в Петербурге, Москве и Новосибирске. Так я оказалась на приеме у врача-ревматолога в Клинике СПбГУ. Там меня внимательно осмотрели, собрали полный анамнез, потом, конечно, были анализы — и долгожданное назначение терапии. Все сложилось так, как я и мечтать не могла.
— Был вариант, что вам могут не назначить эту терапию?
— Препарат, разработанный нашими учеными, относится к генно-инженерным биологическим препаратам и, как любое лекарство, должен назначаться только врачом, так как у каждого пациента свои особенности заболевания и могут быть ограничения к применению того или иного лекарства. Для этого как минимум необходимо иметь подтвержденный диагноз. Препарат могут назначить тем, кто ранее не получал генно-инженерные биологические препараты и кому не помогают нестероидные противовоспалительные лекарственные средства, как в моем случае.
— Как прошла первая инфузия препарата, как вы себя чувствовали после? Присутствовало ли волнение?
— Конечно, я очень волновалась. И до сих пор не верю, что это происходит со мной. После введения препарата я осталась на ночь в больнице, а потом отправилась домой. Все было как обычно. Спустя несколько недель я обратила внимание, что стала лучше спать. Я боялась обмануть саму себя и подумала, что это совпадение. Но нет, сейчас я действительно не чувствую ночных приступов боли, просыпаюсь с силами. Тело стало мягче. А раньше были дни, когда я вообще не могла подняться после ночного сна. Положительные изменения подтверждают и первые анализы после введения инфузии.
— Врач уже сообщил, когда вам планируют сделать второе введение?
— 11 ноября будет второе введение инфузии. Я ее очень жду. Второй раз будет введена двойная доза препарата. Мне не дает покоя мысль: какой же будет эффект от нее? Вдруг я буду как обычный человек? Самое главное после лекарства — я поверила в себя, у меня появились планы по работе, с детьми.
— Что вы могли бы посоветовать пациентам, которые живут с таким же диагнозом?
— Единственное, что я могу посоветовать, — не унывать. Надо жить. Просто жить, верить в лучшее. В нашей стране сотни тысяч человек страдают от болезни Бехтерева.
Нельзя сдаваться и заниматься самолечением, нужно обращаться к врачам. Благодаря нашим ученым и врачам у нас есть все шансы жить без боли. Это придает сил. Я надеюсь, что эту болезнь удастся взять под контроль, и я смогу отвезти детей к морю. Сегодня это мое самое большое желание.
Аутоиммунное ревматологическое заболевание болезнь Бехтерева диагностировано почти у 1% взрослых в России. Без терапии оно может привести к окостенению позвоночника, но она доступна не для всех. «Афиша Daily» узнала, почему людям приходится доводить себя до инвалидности, и чем это грозит им.
Болезнь Бехтерева — ревматологическое аутоиммунное заболевание, поражающее позвоночник и суставы. Один из первых симптомов — обычная боль в спине, но постепенно разрушается все больше отделов позвоночника. Оно неизлечимо и требует своевременной терапии, от которой зависит качество жизни. Перспектива для человека без лечения — полное окостенение позвоночника, который нельзя восстановить, и потеря двигательных способностей, и постоянные боли.
Обычно для лечения хватает противовоспалительных лекарств стоимостью не более тысячи рублей в месяц — они нужны пожизненно. Но существуют люди, которым подходят только генно-инженерные биологические препараты (искусственные антитела. — Прим. ред.) за несколько тысяч долларов. Чтобы человек смог получить дорогостоящие виды помощи бесплатно, сначала он должен оформить инвалидность, но претендовать на нее можно, только если довести болезнь до запущенной стадии и подтвердить это на медико-социальной экспертизе. После наступления ремиссии пациент может потерять право на это лечение: повторная экспертиза через год не подтвердит, что он инвалид, потому что препараты, которые он получал все это время бесплатно, стабилизировали его состояние. И все начинается заново: ухудшение самочувствия, которое снова приводит к инвалидности, но та же самая терапия может стать менее эффективной после ее длительного отсутствия.
В битве за препарат вскрываются все достоинства и недостатки системы здравоохранения. Первое, с чем сталкиваются пациенты, — с отсутствием ревматологов. Поставить диагноз, оценить активность заболевания, перебрать стандартные методы лечения и оценить их эффективность, как правило, может только квалифицированный врач, но их катастрофически не хватает. Притом что только болезнь Бехтерева в России диагностирована у 0,1–0,6% взрослых, а доля ревматологических больных в России — десятки процентов, и цифра неуклонно растет.
Врачи помогают получить препараты генной инженерии в соответствии с клиническими рекомендациями, но от этого мало толку. Когда медико-социальная экспертиза выносит решение, их мало волнует активность заболевания, они оценивают необратимые изменения в позвоночнике и суставах. Это все порочный круг. Надо ждать, пока ты «немного развалишься», чтобы экспертиза сказала: «Ну да, ты инвалид. Теперь смело иди за препаратом».
Еще одна проблема возникает, когда человек приходит на подтверждение инвалидности после ремиссии. Комиссия может решить, что по всем признакам он здоров. Его снимают с учета и перестают выдавать препараты. А потом наступает второе обострение, которое может быть сильнее первого. Конечно, большинству наших пациентов не нужна инвалидность, льготы и доплаты, только лекарства.
Если нет инвалидности или ревматолог не дал назначения на препарат, то спасение — ряд федеральных центров. Они берут человека на госпитализацию, где предоставляют лекарство, но это временная мера. Для стационаров это дополнительная нагрузка, а их пропускная способность ограничена. А препараты должны вводить вовремя, так как задержки приводят к ухудшению здоровья. Но если мест нет, то врачи говорят: «Значит, придете через три недели». Это прямое нарушение клинических правил.
Я считаю привязку лекарственного обеспечения к инвалидности порочной практикой. Пациентам нужна не инвалидность, а лекарственное обеспечение. Но в России все законодательно привязано к ней (ФЗ «О государственной социальной помощи» № 178). Хотя существуют исследования, показывающие, что это экономически нецелесообразно. Если работоспособный пациент действительно нуждается в дорогостоящих препаратах, то экономически выгоднее выдать их сразу, чем когда он станет совсем недееспособным. После чего все равно дать препарат вместе с пособиями и социальными льготами, а человек к этому времени уже будет нетрудоспособен.
Елена Путинина
37 лет, Москва
Болезнь Бехтерева появилась у меня в 29 лет. Сначала заболели ноги. Эти [болезненные] ощущения мигрировали на другие места, а в период обострения болело все, вплоть до челюстных суставов. Невозможно было встать с дивана и элементарно дойти до туалета — я становилась недееспособной. Правильный диагноз поставили не сразу, сначала говорили про синдром грушевидной мышцы (патология мышечно-связочного аппарата. — Прим.ред.) и даже онкологию. Диагностика заболевания заняла около года, и мне еще повезло: десять лет назад это точно было сложнее и дольше.
Обычно на одну поликлинику в Москве есть один ревматолог. Я живу в Южном Бутово, и в моей его вообще нет. Функции ревматолога на себя берет невропатолог или терапевт, что играет плохую роль в момент обострения болезни. Распознать ее может только узкий специалист. Сейчас моя основная проблема — очереди. Например, я ждала приема у врача месяц, но не дождалась, и скорая госпитализировала меня после ухудшения состояния.
Мне пришлось добиваться инвалидности, чтобы получать генно-инженерную терапию, так как появилось сопутствующее заболевание — болезнь Крона. Теперь из‑за него мне нельзя принимать стандартное лечение, которое было доступно без инвалидности. Я получила ее только на год, но без проблем, потому что в медико-социальной комиссии были ревматологи. Новые препараты лечат и болезнь Крона, и болезнь Бехтерева. Минус статуса инвалидности — ад, который нужно проходить каждый год для ее подтверждения. Я получала лекарство до повторного освидетельствования, которое было в том году.
Врачи, посмотрев на состояние здоровья и мою ремиссию (которая возникла благодаря препаратам), решили, что я вполне дееспособна и больше инвалидность не нужна. Меня это, безусловно, радует, но, отменив ее, меня оставили без жизненно необходимых лекарств.
Если прекратится госпитализация (сейчас Елену лечат в стационаре — Прим.ред.) то меня ждет обострение сразу двух болезней. При болезни Бехтерева заболят суставы, а при болезни Крона я получу серьезные проблемы с кишечником. Если бы мне спокойно давали препарат, я была бы на седьмом небе от счастья.
Оксана Тищенко
Подольск, мама Сергея
Сейчас Сергею 21 год. Он заболел в детстве, но тогда ревматолога в Подольске не было. Врачи поставили точный диагноз только в 17 лет. Перед школьным выпускным у сына начались сильные боли в суставах, и из‑за госпитализации он не мог прийти даже на ЕГЭ. Нам назначили таблетки, которые не помогали, а потом от них открылась язва желудка. Так врачи поняли, что нужна генно-инженерная терапия: после первого укола сын перестал чувствовать боль — для него это было очень непривычно.
Последние три года мы получали препараты без инвалидности. А нам потом сказали, что Минздрав теперь требует ее, так как лечение дорогое. Но по факту Сергей не инвалид. Вроде бы выписывают лекарство, чтобы не доводить до состояния инвалидности, но справка о ней все равно нужна. Полгода я покупала препарат за свои деньги по рецепту врача. Я писала в разные инстанции по поводу лекарственного обеспечения, даже уполномоченной по правам человека. В итоге пошла в суд. Он встал на нашу сторону, и обязал Минздрав компенсировать нам 200 тыс. рублей за то время, пока сын сидел без лечения.
Оформлять инвалидность нам тоже не хотели. Я как законный представитель Сергея написала жалобу в Главное бюро экспертизы, попросила посмотреть все анализы и указала на то, что болезнь прогрессирует. Мне ответили, что, вообще-то, есть улучшения, хотя это не так. Нам снова дали возможность лечиться бесплатно только в январе.
Елена Бобкова
45 лет, Суздаль
Я работаю в интернате для пенсионеров. У меня никогда не было проблем со здоровьем, и я редко обращалась в поликлинику. Иногда беспокоил позвоночник, но мануальный терапевт всегда помогал. Три года назад появились страшные боли в каждом суставе и мышцах, невозможно было встать с кровати. Это тяжелый период жизни, который я не люблю вспоминать. От постановки диагноза до получения лекарств прошло девять месяцев, в мае 2017 года наконец-то получила лекарства, постепенно достигла ремиссии и вернулась к нормальной жизни. Останавливать терапию нельзя, потому что это жизненно важный препарат. А с апреля 2019 года аптека перестала принимать рецепт.
Я ездила в районную больницу к ответственному за лекарственное обеспечение, где мне объяснили, что без инвалидности не обеспечат лекарствами, но ее не будет, потому что «денег нет». Из‑за остановки в лечении у меня снова начались боли. Я писала всем, кому только можно, потому что хочу жить. Обратилась в Общество взаимопомощи при болезни Бехтерева, они помогли отправить обращение в Росздравнадзор. Параллельно я писала во все благотворительные фонды, которые просили предоставить официальный письменный отказ от обеспечения лекарствами, который врачи мне не давали. В итоге Росздравнадзор поддержал меня, а прокуратура выявила факты нарушения. Мы обратились в суд, а фонд «Помоги.орг» согласился выдавать препарат, пока не решится вопрос с Минздравом.
Максим Колесников
27 лет, Краснодар
В 12 лет мне поставили ревматоидный артрит из‑за болей в голеностопных и коленных суставах. Назначали гормональные препараты, и через два года наступила ремиссия. На первом курсе университета появилось прихрамывание и боли в шее, спине и позвоночнике. После чего в 2014 году мне поставили диагноз болезнь Бехтерева. Но, как сказали профессора НИИ ревматологии, скорее всего, первые симптомы заболевания были именно в детстве.
О генно-инженерной терапии я узнал, когда меня пригласили на форум пациентов, для которого я бесплатно делал дизайн листовок. Там я посетил ревматолога, и врач рассказала, что бывают генно-инженерные препараты. Меня направила на госпитализацию, во время которой собрали консилиум и сделали мне два укола. Самочувствие улучшилось, и меня отпустили домой с наставлением: «Добивайся получения этого препарата по месту жительства».
Дома я пошел с назначением экспертно-врачебной комиссии в поликлинику. Врачи поселка отправили письмо в Минздрав, на что им ответили: «Нужно назначение не московской Федеральной комиссии, а главного ревматолога по Ростовской области». Получить препарат можно, но на него очереди, было бы проще сделать это по инвалидности. Она уже была у меня из‑за ревматоидного артрита, но ее сняли после улучшения. А в 2018-м я не получил инвалидность из‑за «отсутствия функциональных нарушений».
В сентябре я прошел комиссию, и врач отправил мой пакет документов в Минздрав, где пообещали начать выдавать препарат к январю. В итоге к этому сроку я ничего не получил, мне сказали: «Наверное, письмо лежит у них на столе или потерялось». И в итоге — тишина, до врача не дозвониться, а ситуация не изменилась. Инвалидность есть, но препаратов все равно нет.
Проблема медико-социальной экспертизы в том, что они не пытаются предотвратить инвалидность и снижение качества жизни, будто говорят: «Приходи, когда не сможешь ходить».
Человек в стадии обострения получает инвалидность и лекарства, благодаря которым ему становится лучше. А через год перестают выписывать препарат, потому что нет обострения. И может быть так, что терапия вообще перестанет помогать из‑за больших перерывов.
Болезнь Бехтерева — распространенное ревматологическое заболевание, тяжелое и в ряде случаев инвалидизирующее. Может нарушаться подвижность позвоночника, воспалятся и разрушаться суставы, что ограничивает передвижение. Это с большей вероятностью развивается у пациентов без лекарств, поэтому болезнь требует внимательного наблюдения специалиста.
Вначале проявления не имеют специфического характера — у всех болит спина или суставы, и потом проходит на несколько лет. Это частая проблема, которая бывает у каждого из нас. Учитывая неопределенность жалоб, возникает проблема в диагностике на начальном этапе. Это не вина врача, вопреки мнению населения. Даже если он сделал все возможное — подробно спросил про боли, провел тесты при осмотре, сделал рентген и анализы, — то все равно могут быть затруднения в их оценке в первые месяцы болезни. Тут важно дальнейшее наблюдение.
Каждый ревматолог обязан оказывать помощь в полном объеме, и может использовать любые зарегистрированные и разрешенные методы. Но мы сталкиваемся с системой организации медицинской помощи, когда тривиальные назначения может делать любой врач, а специальные, например дорогостоящие, — только главный специалист региона.
Один ревматолог отправляет пациента к другому, тот — еще к кому‑нибудь, а потом на комиссию. На это уходит много времени и поездок в разные клиники, что не всегда удобно и доступно человеку с проблемами двигательного аппарата.
В результате ревматологи осваивают новые технологии лечения только в теории, теряют квалификацию и способность к самостоятельному принятию решений. Страдает пациент, вынужденный ходить по клиникам, терять массу времени и не получать четких ответов.
Не будет ничего хорошего, если мы дадим пациенту классные современные рекомендации, а он не сможет выполнить их. Бывает, что люди не могут купить лекарства и за двести рублей, а биологические препараты стоят несколько сотен тысяч рублей в год, и нужны они пожизненно. Тем временем людей без инвалидности по-прежнему не лечат во многих регионах России, вопреки правам на льготное лекарственное обеспечение.
15-16 апреля 2021 г. в Москве при поддержке ГКБ №52 прошел I Конгресс с международным участием «Московская ревматология». Мероприятие, организованное в рамках проекта «Внедрение новых медицинских технологий, методик лечения и профилактики заболеваний в практическое здравоохранение», объединило ведущих экспертов в области ревматологии, терапии, дерматологии, неврологии, кардиологии, хирургии и других специальностей. Примечательно, что лекции конгресса были обращены не только к врачам, но и к пациентам.
Научная программа включала симпозиумы, семинары и дискуссии по наиболее актуальным вопросам лечения, диагностики и профилактики ревматоидного артрита, подагры, анкилозирующего спондилита и других ревматологических заболеваний, и персонализации терапевтической тактики. Так, наиболее актуальные аспекты лечения анкилозирующего спондилита осветила в своем выступлении «Как лечить анкилозирующий спондилит» Симонова Елена Николаевна, врач-ревматолог, терапевт ГБУЗ ГКБ 52 ДЗМ, ассистент кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. академика В.С. Моисеева ФГАОУ ВО «РУДН».
Елена Николаевна обратила внимание слушателей на то, что анкилозирующий спондилит (АС) – потенциально тяжелое заболевание с разнообразными клиническими проявлениями, – обычно требует мультидисциплинарного терапевтического подхода, который должен координировать ревматолог. Терапия, основной целью которой является достижение клинической ремиссии или минимальной воспалительной активности заболевания, обязательно должна основываться на взаимопонимании врача и больного.
Современная стратегия лечения АС включает комбинацию нефармакологических и фармакологических методов лечения. Среди нефармакологических методов в числе важнейших можно отметить образование пациентов (школы больных) и регулярные физические упражнения (лечебная физкультура). Согласно действующим Российским Федеральным клиническим рекомендациям по диагностике и лечению анкилозирующего спондилита (Болезнь Бехтерева), ЛФК больной должен заниматься постоянно. Примечательно, что групповые занятия под присмотром инструктора, дают большую эффективность, чем индивидуальные домашние упражнения. Роль других нефармакологических методов лечения АС, а том числе физиотерапии, массажа, акупунктуры, не доказана, и поэтому они не рекомендуются для повседневного клинического использования.
Согласно тому же документу, для медикаментозного лечения АС сегодня используются нестероидные противовоспалительные препараты (НПВП), анальгетики, глюкокортикоиды (ГК), синтетические базисные противовоспалительные препараты (БПВП), ингибиторы фактора некроза опухоли-альфа (иФНОα) и ингибиторы ИЛ-17.
Анкилозирующий спондилит является единственным ревматическим заболеванием, при котором длительный прием НПВП патогенетически обоснован, высокоэффективен и не имеет альтернативы, кроме лечения генно-инженерными биологическими препаратами (иФНОα и иИЛ-17). НПВП являются препаратами первой линии у больных АС и должны быть назначены сразу после установления диагноза, независимо от стадии заболевания. Неэффективность или неполная эффективность первого (оригинального) НПВП является показанием к его замене на другой, но одновременное использование двух и более НПВП не рекомендуется. При переводе на синтетические таргетные БПВП или генно-инженерные биологические препараты отменять НПВП не следует. Спикер подчеркнула, что при назначении НПВП необходимо учитывать кардиоваскулярный риск, функцию почек, печени и состояние ЖКТ.
Анальгетики, такие как парацетамол и трамадол, могут быть использованы в качестве дополнительного краткосрочного симптоматического лечения, особенно в тех случаях, когда терапия боли при помощи НПВП неэффективна, противопоказана, и/или плохо переносится.
Применение глюкокортикоидов при АС в основном ограничено их местными формами. Системные ГК при аксиальной форме анкилозирующего спондилита или при наличии периферического артрита не рекомендуются. При периферическом артрите, сакроилиите и энтезитах можно использовать локальное введение ГК, при увеите также назначается местное лечение. В отдельных клинических ситуациях возможно применение пульс-терапии ГК, которая, однако, имеет краткосрочный эффект.
Базисные противовоспалительные препараты рекомендуются для пациентов с периферическим артритом при условии оценки эффективности такой терапии в течение 3 месяцев. Для лечения АС только с поражением аксиального скелета назначение базисных противовоспалительных препаратов, таких как сульфасалазин, метотрексат или лефлюномид, не показано.
Доктор Симонова также подробно осветила действующие положения руководства ASAS-EULAR по лечению аксиального спондилоартрита (2016 update of the ASAS-EULAR Management Recommendations for Axial Spondyloarthritis). Зарубежные коллеги подчеркивают, что лечение пациентов с таким диагнозом, а также частота наблюдений, должны быть индивидуальными, в соответствии с текущими признаками и симптомами заболевания (аксиальные, периферические, внесуставные проявления) и характеристиками пациента, включая сопутствующие заболевания и психосоциальные факторы. Пациенты должны быть обязательно информированы о своем заболевании, им должны быть разъяснены необходимость регулярных тренировок и отказа от курения.
Тактика ведения больных с АС в зарубежной практике также предусматривает назначение НПВП в качестве лекарственного средства первой линии вплоть до максимальной дозы, с обязательной оценкой рисков и пользы. Для пациентов, которые хорошо реагируют на НПВП, предпочтительнее их постоянное применение. Базисные противоревматические препараты (БПРП) следует рассматривать при стойкой высокой активности заболевания, несмотря на традиционные методы лечения. В текущей европейской практике терапия ГИБП начинается с препаратов группы иФНОα. Согласно Российским клиническим рекомендациям начинать терапию ГИБП можно как с иФНОα, так и с ингибиторов ИЛ-17
Согласно рекомендациям EULAR/ASAS, показаниями к назначению генно-инженерных биологических препаратов (ГИБП) является диагноз АС, неэффективность стандартной терапии и высокая активность патологического процесса (индекс ASDAS не менее 2,1 или индекс BASDAI не менее 4). Необходимость терапии ГИБП и выбор конкретного препарата может определяться ревматологом индивидуально для каждого конкретного клинического случая.
Помимо иФНОα для лечения аксиального спондилоартрита на данный момент зарегистрированы еще две группы ГИБП и таргетных синтетические препаратов: ингибиторы интерлейкина 17 (иИЛ-17) и ингибиторы янус-киназ, и исследования эффективности и безопасности препаратов новых групп сегодня активно продолжаются. Особенно перспективными для терапии АС представляются ингибиторы ИЛ-17, представителем которых является нетакимаб, оригинальная разработка компании BIOCAD.
Спикер представила предварительные результаты наблюдательного неинтервенционного исследования по оценке удержания на терапии нетакимабом и сравнительного анализа переключения внутри группы ингибиторов ИЛ-17, ингибиторов ФНОα у пациентов с анкилозирующим спондилоартритом.
В исследование вошли 42 пациента обоего пола в возрасте от 18 лет c установленным диагнозом анкилозирующего спондилита, которым назначена терапия нетакимабом по решению лечащего врача в рамках рутинной клинической практики. В популяцию анализа вошли как бионаивные участники, так и больные, принимавшие от 1 до 3 препаратов, включая ингибиторы ФНО-альфа. На протяжении исследования выбыл только 1 участник по причине неэффективности, и был зарегистрирован только один случай нежелательного явления – кожная реакция в месте инъекции. В результате трех месяцев терапии нетакимабом у всех пациентов наблюдалось резкое снижение индекса BASDAI: от изначального диапазона 8,7-13, до конечного – 2,26-4.
Доктор Симонова привела также разбор клинического случая пациентки 56 лет с диагнозом анкилозирующего спондилита. На протяжении 16 лет пациентка получала нерегулярную терапию НПВП, и 4 года назад была переведена на иФНОα, и потом на его биоаналог. Исследование, проведенное перед началом терапии нетакимабом, показало, что индекс BASDAI у пациентки составлял 6,5 баллов, а метрологический индекс BASMI – 6 (в частности, ротация в шейном отделе позвоночника – 25 градусов, расстояние козелок-стена – 20 см). После 3 месяцев терапии нетакимабом индекс BASDAI снизился до 3,5, а BASMI – до 5 баллов (в частности, ротация в шейном отделе позвоночника – 35 градусов, расстояние козелок-стена – 17 см). Отмечалось также существенное улучшение лабораторных показателей.
Елена Николаевна заключила, что на фоне терапии нетакимабом отмечается значительное улучшение состояния пациентов с активным АС: быстрое снижение активности заболевания, нарастающее с течением времени, улучшение функциональной активности и подвижности позвоночника и улучшение качества жизни больных. Немаловажно, что нетакимаб также продемонстрировал благоприятный профиль безопасности и переносимости.
УДК 616.71/72-082
ГЕННАЯ ИНЖЕНЕРИЯ В ЛЕЧЕНИИ АНКИЛОЗИРУЮЩЕГО СПОНДИЛИТА
(БОЛЕЗНИ БЕХТЕРЕВА)
GENETIC ENGINEERING IN THE TREATMENT OF ANKYLOSING SPONDYLITIS
(BEKHTEREV’S DISEASE)
С.И. Логвиненко 1, Э.А. Щербань 1’3, Л.С. Придачина 2, А.Н. Придачина 2,
Ю.Ю. Маслова 2, А.А. Кашичкина 1 S.I. Logvinenko 1, E.A. Shcherban 1>3, L.S. Pridachina 2, A.N.Pridachina 2, Yu.Yu. Maslova 2, A.A. Kashichkina 1
1) Белгородский государственный национальный исследовательский университет Россия, 308015, г. Белгород, ул. Победы, д. 85
2) ОГБУЗ «Городская больница №2» Россия, 308036, г. Белгород, ул. Губкина, д. 46
3) ОГБУЗ «Белгородская областная клиническая больница Святителя Иоасафа» Россия, 308007, г. Белгород, ул. Некрасова 8/9
1 >Belgorod National Research University Russia, 308015, Belgorod, Pobedy St., 85
2) Belgorod Regional Hospital № 2 Russia, 308036, Belgorod, Gubkin St., 46
3) Belgorod regional clinical hospital of Prelate Iosaf Russia, 308007, Belgorod, Nekrasov St., 8/9
E-mail: Logvinenko_S/@bsu.edu.ru
Аннотация. Анкилозирующий спондилит (АС) — это хроническое системное воспалительное заболевание, характеризующееся преимущественным поражением крестцово-подвздошных сочленений и позвоночника. Основной особенностью очагов поражения при данной патологии является постепенное ограничение их подвижности с образованием анкилозов, что приводит к инвалидизации в трудоспособном возрасте и снижению качества жизни. Современная терапия с использованием генно-инженерных биологических препаратов позволяет уменьшить активность анкилозирующего спондилита и способствует замедлению структурных повреждений. Уже на начальных этапах приема ГИБП отмечается их выраженный терапевтический эффект в отношении наиболее тяжелых клинических симптомов заболевания. Своевременное назначение выбранной группы препаратов позволяет не только снизить выраженность симптомов, но и сохранить дееспособность пациентов, обеспечив им хороший уровень функционального статуса.
Resume. Ankylosing spondylitis (AS) is a chronic systemic inflammatory disease with a primary lesion of the sacroiliac joints and the spine. The main feature of the lesions in this condition is a gradual limitation of their mobility with the formation of ankylosis that leads to disability in the working age and reducing quality of life. Modern therapy with genetically engineered biological agents can reduce the activity of ankylosing spondylitis and helps to slow down the structural damage. In the initial stages of the use of GEB is their pronounced therapeutic effect against the most severe clinical symptoms. Appointment of the selected group of drugs at the moment helps reduce the severity of symptoms and to maintain the capacity of the patients by providing a good level of functional status.
Ключевые слова: анкилозирующий спондилит, генно-инженерные биологические препараты, антиген гистосовместимости HLA B27.
Keywords: ankylosing spondylitis, genetically engineered biological agents, histocompatibility antigen HLA
B27.
Ревматические болезни — группа заболеваний, характеризующаяся системным поражением соединительной ткани, обусловленном в основном патологией иммунной системы. Морфологической основой всей группы ревматических заболеваний является системная прогрессирующая
дезорганизация соединительной ткани. Согласно статистике, в России более 3 миллионов человек страдают от рассматриваемой группы болезней. На сегодняшний день они являются также самыми «дорогостоящими» для нашего государства.
Анкилозирующий спондилит (АС) является одним из наиболее часто встречающихся ревматических заболеваний, его распространенность в России достигает 1%. У мужчин оно развивается в среднем в 5 раз чаще, чем у женщин, манифестируя в возрасте 20-30 лет. Болезнь Бехтерева является мультифакториальным заболеванием, в котором 20% отводится роли генетического фактора, а 80% составляет вклад факторов внешней среды. Важнейшим фактором патогенеза является семейная предрасположенность, маркером которой считается антиген гистосовместимости ИЬЛ-В27 (положителен более чем в 90% случаев). Молекула антигена ИЬЛ-В27 действует как рецептор для пусковых факторов. Образующийся комплекс стимулирует продукцию цитотоксических Т-лимфоцитов, обладающих способностью повреждать клетки или ткани, имеющие молекулы этого антигена и привлекать в очаги воспаления макрофагов. Центральную роль в воспалительном процессе играет цитокин, носящий название «Фактор некроза опухоли альфа» (ФНО-а), образующийся из макрофагов и Т-лимфоцитов. Именно этот гликопротеин стимулирует воспалительный процесс, он постоянно разжигается и сохраняется, становясь, таким образом, хроническим.
Проникая в области прикрепления сухожилий, связок, фиброзной части межпозвоночных дисков, капсул суставов к костям, воспалительные клетки в сочетании с высвободившимися медиаторами вызывают хроническое воспаление. Поражение осевого скелета при болезни Бехтерева преобладает над поражением периферических суставов, при этом поражаются преимущественно суставы «хрящевого» типа — крестцово-подвздошные сочленения, мелкие межпозвонковые суставы, грудинно-ключичные и реберно-грудинные сочленения [Мазуров В.И. 2008].
Заболевание развивается постепенно, появляются небольшие боли в пояснице, которые со временем усиливаются и распространяются на другие отделы позвоночника. Характер болей имеет следующие особенности: они стойкие, усиливаются в покое, особенно во вторую половину ночи или утром, сопровождаются скованностью, уменьшаются или проходят полностью после упражнений, быстро купируются приемом противовоспалительных препаратов. Постепенно появляется ограничение подвижности позвоночника, что порой происходит незаметно для самого больного. Со временем позвоночник укорачивается, объем движений уменьшается. Иногда боли бывают очень слабыми или даже отсутствуют, а единственным проявлением болезни является нарушение подвижности позвоночника. Изменения позвоночника распространяются обычно снизу вверх, поэтому затруднения при движении шеи появляются довольно поздно. В некоторых случаях ограничения движений и боли в шейном отделе позвоночника наблюдаются с первых лет заболевания, что может указывать на более неблагоприятный вариант течения болезни. При отсутствии лечения болезнь может привести к полной обездвиженности позвоночника, больной приобретает позу «просителя» (согнутые в локтях руки, сутулая спина, склоненная голова, ноги, чуть согнутые в коленях).
Кроме позвоночника и суставов иногда наблюдается поражение различных органов и систем. Наиболее часто поражаются глаза, проявляется это болью и покраснением одного глаза, слезотечением, светобоязнью, затуманиванием зрения. Увеит при АС, как правило, односторонний и при адекватном лечении обычно проходит в течение 2-3 месяцев без последствий. Если своевременно не назначают адекватное лечение, то увеит может привести к синехиям, катаракте, глаукоме или потере зрения.
Другие внепозвоночные проявления (нарушения сердечной проводимости, поражение аортального клапана сердца, почек, легких) встречаются значительно реже. Кроме того, в редких случаях АС может сопровождаться амилоидозом почек — серьезным осложнением, при котором возникает почечная недостаточность.
Среди лабораторных методов наибольшее значение имеет определение СОЭ и С-реактивного белка (СРБ). Эти показатели дают возможность ориентировочно судить, насколько активно протекает воспалительный процесс. Рентгеновское исследование позвоночника на ранних стадиях имеет меньшее значение для постановки диагноза, но обязательно проводится для дальнейшего сравнительного анализа выявляемых изменений по мере прогрессирования болезни, а также для исключения возможных других причин болей в позвоночнике. Более чувствительным методом для обнаружения сакроилеита считается магнитно-резонансная или рентгеновская компьютерная томография, позволяющая иногда увидеть признаки сакроилеита гораздо раньше, чем они видны на рентгенограммах. Обязательно проводится исследование на носительство антигена тканевой совместимости НЬАВ27 (гена предрасположенности к АС), его наличие является существенным аргументом в пользу диагноза АС [Насонов Е.Л. 2010].
Стратегия лечения АС, несомненно, представляет собой раннюю его диагностику и раннее начало терапии. В наши дни это имеет огромное значение. В связи с недостаточностью симптоматической терапии, специалисты в области генной инженерии направили усилия на изучение патогенеза заболевания. С целью воздействия на его стратегические звенья разрабатываются специальные генно-инженерные биологические препараты (ГИБП). Механизм действия ГИБП основан
на подавлении провоспалительных цитокинов, в частности фактора некроза опухоли альфа и ин-терлейкина-6, на устранение лимфоцитов из циркуляции и на торможение взаимодействия имму-нокомпетентных клеток. В результате современная терапия ГИБП приводит к снижению активности анкилозирующего спондилита, способствует замедлению структурных повреждений и расширяет границы их коррекции. Одним из препаратов группы ГИБП является Энбрел — ингибитор ФНО а, который представляет интерес для ассоциации ревматологов России.
Действующее вещество — этанерцепт. Является конкурентным ингибитором связывания ФНО с его рецепторами на поверхности клетки и, таким образом, ингибирует биологическую активность ФНО.
Показания: тяжелый активный АС, активный РА средней и высокой степени тяжести, псориаз.
Побочные эффекты: инфекции верхних дыхательных путей, кожи; инфузионные реакции, циститы, аллергические реакции, зуд, лихорадка. При отборе больных проводят тщательное обследование для исключения возможной инфекции (туберкулез) [Лекарственный справочник ГЭОТАР. 2015].
Представляем вашему вниманию клинический случай применения
описанного препарата
Больной М., 28 лет, поступил в ревматологическое отделение городской клинической больницы №2 в январе 2016 года с жалобами на болезненность во всех отделах позвоночника, больше в пояснично-крестцовом отделе, с иррадиацией по задней поверхности бедра, костях таза, на периодическую болезненность в правом коленном суставе, ограничение движений из-за болей, утреннюю скованность в позвоночнике, продолжительностью до 12 часов дня, уменьшающуюся после физической нагрузки, снижение работоспособности и слабость. Считает себя больным с 2005 года, когда появились боли в спине (поясничном и крестцовом отделах). Принимал курсами НПВС и гормональные препараты без выраженных улучшений. Болезненность распространялась на грудной и шейные отделы позвоночника. С марта 2014 отмечает усиление болезненности и скованности. В 2015 г. в НИИ РЕВМАТОЛОГИИ им. Насоновой В.А. установлен диагноз: анкилозирующий спондилит HLA-B27 ассоциированный. Было назначено лечение ГИБП -энбрелом. Препарат получает с 1.12.2015 г. на протяжении 4 месяцев. Из анамнеза: рос и развивался в соответствии с возрастом. Наследственный анамнез отягощен: у отца болезнь Бехтерева.
Объективно на момент поступления: состояние средней тяжести, обусловленное болевым синдромом в подвздошно-крестцовой области. Крепитация при движении в коленных суставах, местная отечность и гиперемия. Симптомы Кушелевского, Форестье положительные. Симптом Зацепина слабо положительный. Проба подбородок-грудина 2.5см. Индекс активности спондилита BASDAI — 7.4. Кожные покровы сухие, чистые. Периферические лимфатические узлы не пальпируются. Щитовидная железа не увеличена. Температура тела — 36.70С. В позе Ромберга больной устойчив. Дыхание через нос, свободное. ЧДД — 17 в минуту. Форма грудной клетки гиперстеническая, симметричная, равномерно участвует в акте дыхания, экскурсия грудной клетки в полном объёме. Грудная клетка эластичная, безболезненная. Голосовое дрожание одинаково с обеих сторон. При сравнительной перкуссии — над симметричными участками лёгочной ткани определяется ясный лёгочный звук. Аускультативно — над симметричными лёгочными полями отмечается везикулярное дыхание. Тоны сердца ясные, ритмичные, ЧСС=86, PS=86 ударов в 1 минуту. АД 120/80 мм рт. ст. Пульсация на периферических артериях удовлетворительная. Язык влажный, чистый. Живот правильной формы, симметричный, безболезненный, равномерно участвует в акте дыхания. Размеры печени по Курлову: 9 x8x7см. Селезёнка не пальпируется. Физиологические отправления в норме.
Обследование:
ОАК — Эритроциты — 5.59х1012/л, НЪ — 154г/л, ЦП — 0.7, Лейкоциты — 10.3-10х109/л, Э-2%П — 3%, С — 64%, Л — 23%, М — 3%, СОЭ — 36 мм/ч. Общий анализ мочи без патологии.
Биохимический анализ крови: Сахар — 5.4 ммоль/л, Билирубин — 11.2 мкмоль/л. АЛТ — 14.5 ед/л. АСТ — 18.5 ед/л. Креатинин — 81 мкмоль/л. Холестерин — 4.12 ммоль/л. Общий белок 80.5 г/л. СРБ — 2.3 мг/л. Коагулограмма: фибриноген — 5 г/л, ТВ — 14 с, АЧТВ 35 с, ПТИ 100%, ПВ 15 с. Анализ крови на RW,HBS Ag — отрицательный от 16.01.2016 №126921535. Кровь на антитела к ВИЧ от 16.01.2016 №7501 отрицательный. Анализ крови на маркер АС Н^ В27 положительный. ЭКГ -ритм синусовый, ЧСС 68 в мин., ЭОС не отклонена. Рентгенография органов грудной клетки от 15.01.2016 — без патологии. ФГДС от 2016 — умеренная деформация луковицы ДПК. Гастродуоденит.
Консультация фтизиатра: диаскинтест — отрицательный от 19.01.2016, данных за туберкулезное заболевание нет. R-грамма коленных суставов Д 0.01 МЗВ №3049 от 3.04.2014-Двухсторонний гонартроз справа II ст. слева III ст. R-грамма поясничного отдела позвоночника -склероз каудальной замыкательной пластинки тел LY, выпрямление лордоза снижено.
Заключение: остеохондроз LV-SI.
МРТ крестцово-подвздошных сочленений от 2015 г — суставная щель левого и правого крестцово-подвздошного сустава до 6мм. Определяются краевые костные разрастания обоих крестцово-подвздошных суставов.
Заключение: умеренно выраженные дегенеративные изменения крестцово-подвздошных суставов; умеренно выраженный остеохондроз поясничного отдела позвоночного столба. Дорсальная протрузия диска LY-SI; умеренно выраженный полисегментарный остеохондроз грудного отдела позвоночного столба; умеренно выраженный полисегментарный остеохондроз шейного отдела позвоночного столба.
В результате проведенного обследования выставлен клинический диагноз: анкилозирующий спондилит, периферическая форма, HLA B27 ассоциированный, медленно прогрессирующее течение, активность III степени. Двусторонний сакроилеит R III ст.ФН III Двусторонний коксартроз R I ст. ФН I Артрит правого коленного сустава ФН I
Наблюдая в динамике за пациентом, необходимо отметить, что на фоне лечения НПВС, сульфасалазином, гормональными препаратами не достигнуто клинико-лабораторной ремиссии. Однако при назначении генно-инженерного биологического препарата — энбрела по схеме 50 мг п/к 1 раз в неделю под контролем ОАК, HBS Ag, СРБ, биохимических проб печени и почек, диаскинтеста, через 2 недели пациент отметил субъективное улучшение, а через месяц нормализовались показатели ОАК (СОЭ до 15 мм/ч и СРБ до 1 мг/л), снизились болевой синдром по ВАШ (оценка интенсивности боли) с 8 см до 1 см. и индекс BASDAI (показатель активности спондилита) с 7.4 до 4.5.
Лечение: диета №10, энбрел 50 мг п/к 1 раз в неделю — вторник, целебрекс 200 мг по 1 таб. 2 раза в сут.
Рекомендовано:
— Диета №10 «Д»
— Наблюдение у участкового терапевта, ревматолога.
— Контроль лабораторных показателей, ревматологических проб.
— Продолжить лечение ГИБП ЭНБРЕЛ 50 мг 1 раз в неделю — вторник.
— Целебрекс 200 мг по требованию.
В результате проводимой терапии состояние больного улучшилось: уменьшились интенсивность болевого синдрома и скованность до 30 минут, улучшились лабораторные показатели, также снизилось чувство слабости и усталости, повысилась работоспособность, пациент отмечает улучшение качества жизни. Дальнейшее наблюдение и лечение продолжается.
Таким образом, своевременное назначение ГИБП позволяет не только снизить выраженность симптомов, но и улучшить качество жизни. Улучшение самочувствия пациентов трудоспособного и молодого возраста способствует продолжению трудовой деятельности и достижению хорошего функционального статуса.
Список литературы References
Насонов Е.Л. 2010. Ревматология: Клинические рекомендации НИИ Ревматологии. Анкилозирующий спондилит. Под ред. академика РАМН Е.Л. Насонова. М: ГЭОТАР — Медиа, 752.
Nasonov E.L. 2010. Revmatologija: Klinicheskie rekomendacii NII Revmatologii. Ankilozirujushhij spondilit [Revmatologiya: Clinical recommendations of scientific research institute of Rheumatology. Ankiloziruyushchy spon-dilit]. Pod red. akademika RAMN E.L. Nasonova.M: GJeOTAR — Media. (in Russian)
Лекарственный справочник ГЭОТАР. 2015. Издательская группа «ГЭОТАР-Медиа»., 1576.
Lekarstvennyj spravochnik GJeOTAR. 2015. [Medicinal reference book of GEOTAR]. Izdatel’skaja gruppa «GJeOTAR-Media»., 1576. (in Russian)
Мазуров В.И. 2008. Болезни суставов. Издательство СпецЛит, 397.
Mazurov V.I. 2008. Bolezni sustavov. [Joint disease] Izdatelstvo Speclit, 397. (in Russian)
Статья на конкурс «био/мол/текст»: Вам когда-нибудь снились кошмары о том, как организм разъедает себя изнутри? А что если это становится реальностью? Именно процессы аутофагии лежат в основе развития ревматических заболеваний. В борьбе с аутоиммунным воспалением медицина слишком часто проигрывала… пока не появились они. Моноклональные антитела.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Системные ревматические заболевания — это патологии, которые возникают из-за агрессивного воздействия иммунитета на собственные ткани. В основе их развития лежит ошибка иммунной системы , которая неправильно распознает нормальные составляющие человеческого тела — аутоантигены. Иммунные клетки принимают их за чужеродные агенты, в которых видят угрозу для организма. Активируется защитная функция, и начинается «бомбардировка» здоровых клеток факторами иммунной системы — аутоантителами (рис. 1).
Основы нормального иммунитета и аутоиммунного процесса в доступной форме изложены на «Биомолекуле» в статье «Иммунитет: борьба с чужими и… своими» [1].
Рисунок 1. Схема строения антител. Антитела представляют собой белки-иммуноглобулины, имеющие две H-цепи (тяжелые) и две L-цепи (легкие). В каждой молекуле белка есть специфические Fab-фрагменты. Эти области отвечают за связывание с антигеном — «мишенью», на которую воздействует антитело. Структура Fab-фрагмента очень вариабельна, что позволяет ей подстраиваться под активные центры антигена — эпитопы. Между антителом и антигеном формируются химические связи (ионные, водородные, гидрофобные). Другой конец молекулы — Fc-фрагмент — отвечает за связывание образовавшихся иммунных комплексов с Fc-рецептором, расположенным на мембранах иммунных клеток (нейтрофилов, макрофагов, тучных клеток). Активация компонентов иммунитета запускает «реакцию уничтожения» по отношению к чужеродному антигену. Таким путем осуществляется антителозависимая цитотоксичность.
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Подробнее о механизмах развития некоторых ревматических заболеваний можно почитать в статьях: «Системная красная волчанка: болезнь с тысячью лиц» [2] и «Ревматоидный артрит: изменить состав суставов» [3].
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
В 2017 году «Биомолекула» опубликовала спецпроект, посвященный аутоиммунным заболеваниям.
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
Разберемся, почему нужны новые лекарства. В качестве примера можно рассмотреть классическую терапию одного из самых распространенных аутоиммунных заболеваний — ревматоидного артрита [3]. Современные стратегии борьбы с этой патологией должны соответствовать концепции Treat to target — «лечение до достижения поставленной цели». Она направлена на ремиссию (исчезновение симптомов) заболевания или резкое снижение активности артрита [5], [6].
«Золотым стандартом» в терапии заболевания является метотрексат (рис. 2). Препарат входит в группу базисных противовоспалительных средств.
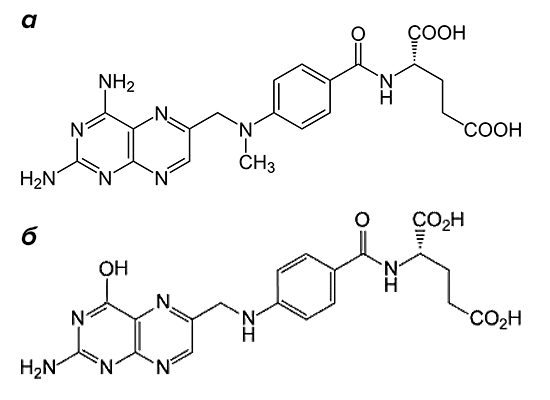
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
«Википедия»
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
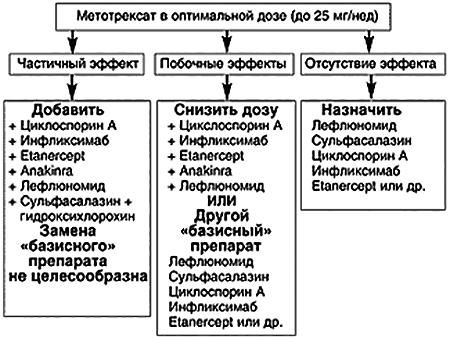
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
Иммунная система — это сложный механизм, состоящий из множества «винтиков» — иммунных клеток. Каждая из них имеет свои функции и занимает определенное место в общей структуре защитной системы. В ответ на поступление «вражеского» агента (антигена) включаются компоненты врожденного иммунитета — неспецифические факторы защиты. Это нейтрофилы, эозинофилы и базофилы, которые первыми стоят на пути у вредного воздействия.
Винтики крутятся — активируются новые компоненты иммунной системы. В борьбу с патогеном вступают Т- и В-лимфоциты. Они включают более тонкие механизмы защиты — специфическую цитотоксичность. Вырабатываются антитела, ищут себе «жертву» Т-киллеры… Тонкая регуляция процесса с помощью цитокинов позволяет быстро достигнуть поставленной цели. Согласованное действие всех компонентов иммунитета приводит к выполнению программы — уничтожению патологического агента.
Во время подбора подходящих «деталей» для механизма — при селекции лимфоцитов — неизбежно возникают ошибки. Иммунная система производит аутореактивные клоны — клетки, которые специфичны к антигенам тканей организма. В норме они отсеиваются в «мастерских» — тимусе и лимфатических узлах. Те клоны лимфоцитов, которые не различают собственные и чужеродные антигены, сразу же уничтожаются еще до того, как они приступят к выполнению своей функции. Но что происходит, если «винтики» выпадают из машины иммунитета? Поломка возникает в специфической части механизма — в работе Т- и В-лимфоцитов. При нарушении процесса селекции аутореактивные клетки выходят в кровь. Они ищут своих «жертв» и находят их в нормальных элементах собственных тканей.
В зависимости от типа реакции отличается патофизиологический процесс, лежащий в основе аутоиммунной агрессии. Т-лимфоциты могут самостоятельно убивать клетки тела, а могут и работать «чужими руками» — активировать выработку аутоантител В-лимфоцитами. При поражении В-клеточного иммунитета аутофагия реализуется через систему комплемента, а также путем формирования цитотоксических иммунных комплексов [13], [14]. Подробнее о механизмах нормального и измененного иммунного ответа можно почитать на «Биомолекуле» [1], а также в статьях [15], [16].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
Биологические агенты воздействуют на отдельные «винтики» механизма иммунной защиты. Их мишенями могут быть цитокины и их рецепторы, мембранные молекулы лимфоцитов. В зависимости от точки приложения препарата моноклональные антитела делятся на группы (рис. 4):
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
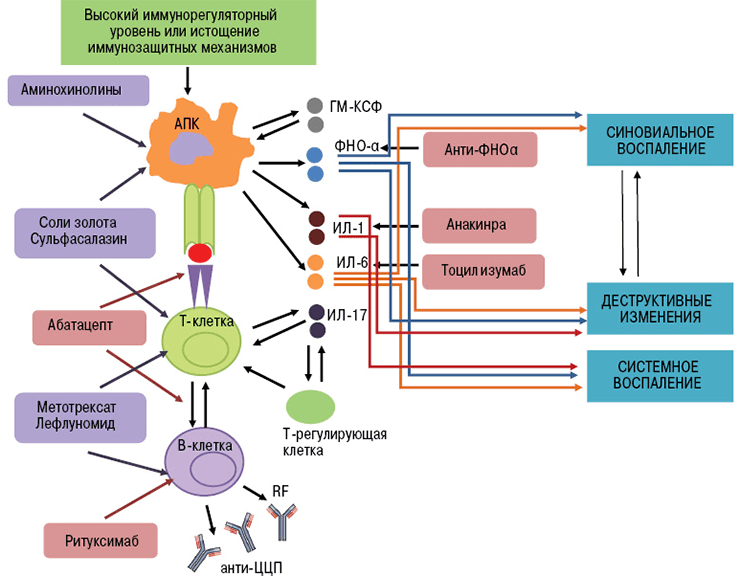
Рисунок 4. Патофизиологические «жертвы» моноклональных антител — интерлейкины, ФНО, поверхностные белки лимфоцитов.
Ингибиторы ФНО
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
Однако влияние ФНО на суставы при ревматических заболеваниях нельзя назвать положительным. Так, при ревматоидном артрите цитокин стимулирует размножение синовиальных фибробластов — клеток оболочки сустава. Это приводит к формированию паннусов — разрастаний агрессивной ткани. С течением заболевания процесс воспаления и деструкции распространяется на суставный хрящ и подлежащие кости (рис. 5). Ткани сустава заполняются иммунными клетками — макрофагами, Т- и В-лимфоцитами, нейтрофилами. Эти механизмы лежат в основе развития хронического воспаления. Освежить знания о патогенезе ревматоидного артрита можно в статье «Ревматоидный артрит: изменить состав суставов» [3].
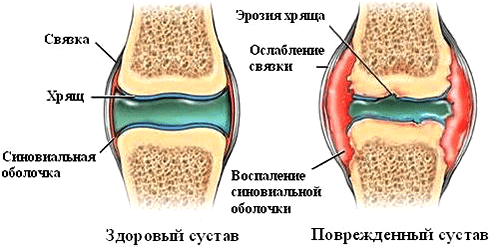
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Одним из ингибиторов ФНО является препарат инфликсимаб. Он имеет «человеческую» и «мышиную» области. Примерно 25% всех аминокислот в составе моноклонального антитела получены из организма мышей. Это Fab-фрагмент — специфический участок, отвечающий за связывание с ФНО. Fc-фрагмент белка образуется из IgG1 — антитела человека.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
Механизм действия инфликсимаба понятен из его строения. Fab-фрагмент молекулы связывает фактор некроза опухолей, образуя с ним устойчивый комплекс. Такое взаимодействие полностью блокирует активность цитокина, препятствуя его соединению с мембранными рецепторами p55 и p57. Инфликсимаб «обезвреживает» как растворимую, так и мембраноассоциированную формы ФНО (рис. 6). В клетках суставов снижается содержание и других провоспалительных факторов — ИЛ-1, ИЛ-6, монооксида азота.
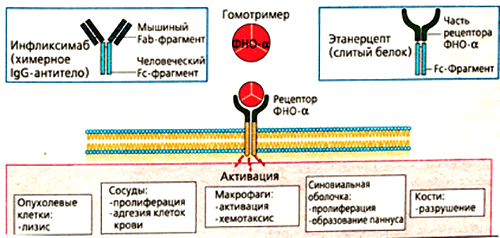
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
Немного другую структуру имеет еще один эффективный препарат из группы ингибиторов ФНО — этанерцепт. В его состав входит внеклеточная часть рецептора к фактору некроза опухолей. Она «подсоединяется» к человеческому IgG1. Гибридная молекула вступает в жесткую конкуренцию за свободный ФНО и обезвреживает его до того, как цитокин успевает связаться с рецепторами и запустить воспалительную реакцию. Дополнительное действие этанерцепта, которого нет у других ингибиторов ФНО, — это нейтрализация лимфотоксина. Это вещество тоже относится к провоспалительным цитокинам. Выработка лимфотоксина стимулирует пролиферативные процессы в суставах. Соответственно, блокировка его действия снижает активность воспаления при ревматологических заболеваниях [18].
Ингибиторы ФНО хорошо показали себя не только при лечении ревматоидного артрита, но и при других аутоиммунных патологиях. Например, у пациентов с болезнью Бехтерева широко используют новые препараты. Замедление прогрессирования патологии в этом случае очень важно, так как аутоагрессия направлена на суставные и костные образования позвоночника. С течением времени болезнь превращает позвоночный столб в «бамбуковую палку» — монолитное негнущееся образование. Анкилоз развивается постепенно, но неотвратимо. С каждым годом двигательные возможности больных становятся все более ограниченными. Применение биологических препаратов позволяет снизить активность воспаления в позвоночнике. Это замедляет процесс формирования анкилоза [19].
Блокаторы интерлейкиновых рецепторов
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
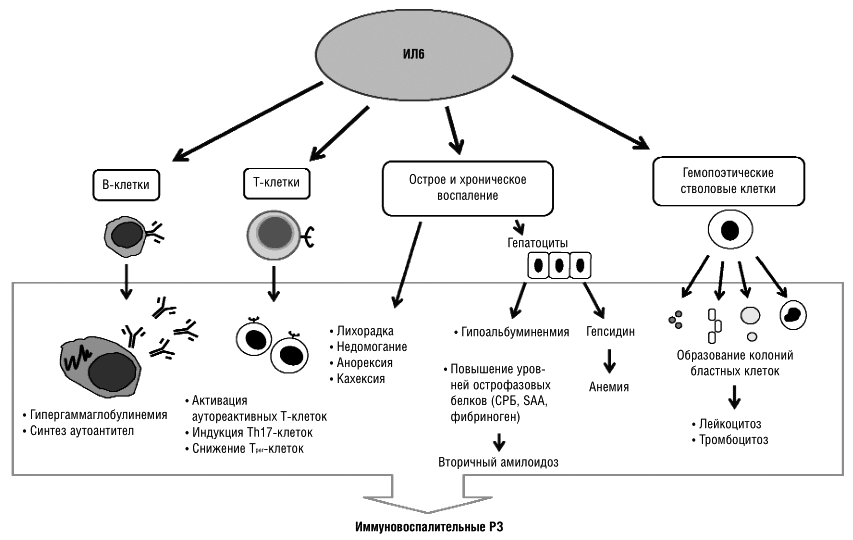
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Влияние интерлейкинов — один из «спусковых крючков» воспалительного процесса. Поэтому блокировка их активности улучшает состояние пациентов с аутоиммунными заболеваниями. Приостановить работу интерлейкинов можно, если связать их рецепторы — молекулы, передающие сигнал иммунным клеткам. На этом основан механизм действия моноклональных антител из группы ингибиторов интерлейкиновых рецепторов.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
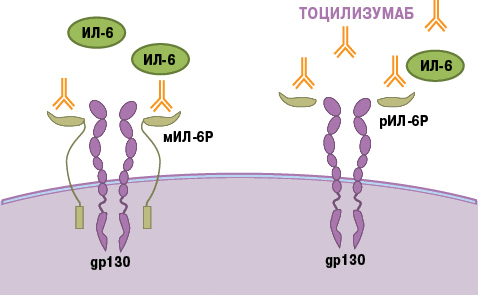
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Анти-B-клеточная терапия
Одними из главных элементов, участвующих в аутоиммунном воспалении, являются В-лимфоциты. Именно они вырабатывают аутоантитела, которые связываются со здоровыми клетками организма. Образовавшийся комплекс антитела и аутоантигена атакует система комплемента или цитотоксические лимфоциты. Этот процесс лежит в основе воспалительной реакции при таком ревматическом заболевании, как системная красная волчанка. Ей на «Биомолекуле» посвящена отдельная статья: «Системная красная волчанка: болезнь с тысячью лиц» [2].
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
Благодаря этой особенности белок CD20 является идеальной «жертвой» для биологических препаратов. При «выключении» его активности не нарушается ни образование новых лимфоцитов, ни выработка нормальных антител. Одним из лекарств с таким механизмом действия является ритуксимаб. Моноклональное антитело связывается с молекулой CD20. Это приводит к запуску иммунологических реакций по отношению к B-лимфоцитам, которые обеспечивают разрушение (лизис) этих клеток (рис. 9).
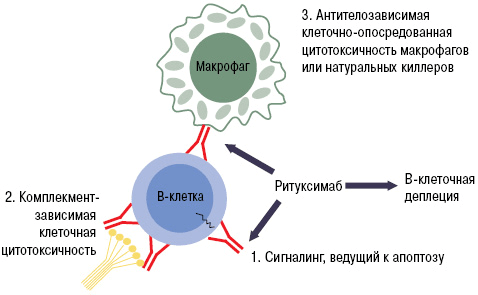
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Анти-Т-клеточная терапия
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
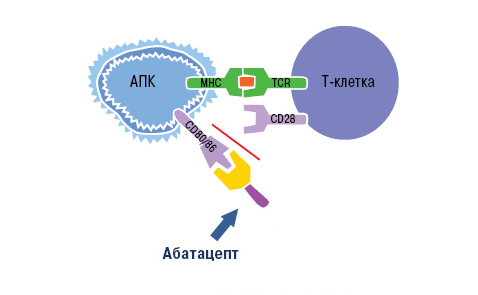
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Препараты моноклональных антител уже довольно долго используют в ревматологической практике. Однако назначают их далеко не всем — не каждому первому и даже не каждому второму пациенту. Главным ограничением, с которым сталкиваются врачи и больные, является действительно «заоблачная» стоимость препаратов этой группы. Ревматические заболевания нельзя вылечить за неделю или месяц — они требуют многолетнего (или даже пожизненного) использования терапии. Поэтому при подборе лекарственного средства важна не только его эффективность, но и цена.
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Поэтому лечение ревматических заболеваний проводят по строгим алгоритмам. При выявлении патологии пациенту назначают базисный препарат. К примеру, при ревматоидном артрите основным лекарством, вероятнее всего, станет метотрексат. Добавлять моноклональные антитела к стандартной схеме лечения врачи будут только в исключительных случаях. В России их считают препаратами резерва — дополнительными средствами, которые стоит «оставить на потом», даже несмотря на высокую эффективность. Так, если выраженность симптомов не снижается долгое время (как минимум 6 месяцев!), к метотрексату могут добавить биологический препарат. Базисная терапия при этом не отменяется.
Если заболевание изначально имеет высокую активность, быстро прогрессирует и сопровождается внесуставными осложнениями, то больному сразу могут назначить комбинированное лечение базисными средствами и моноклональными антителами. Это связано с тем, что лучше всего биологические препараты работают именно в «остром периоде», когда выраженность симптомов максимальная. Кроме того, эффект от их использования наблюдается быстрее. Лечение инфликсимабом дает результаты уже через 2–4 недели, тогда как метотрексат «включается в работу» только через несколько месяцев.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Назначение и реализация биологических препаратов контролируется государством. Многие средства из группы моноклональных антител (инфликсимаб, этанерцепт, тоцилизумаб, голимумаб) входят в «Перечень жизненно необходимых и важнейших лекарственных средств». В соответствии с ним формируется список лекарств, которые поступают в стационары по всей России. Конечно, биологические препараты сегодня есть далеко не в каждой больнице. Обычно их используют в региональных центрах или специализированных стационарах.
При неспособности обеспечить себя лекарствами пациенты получают инвалидность и проходят терапию за счет государства. Это право закреплено в действующей «Программе государственных гарантий оказания бесплатной медицинской помощи». Лечение биологическими препаратами предоставляется при ревматоидном артрите, болезни Бехтерева, СКВ, дерматополимиозите, ювенильном артрите и других заболеваниях. При этом врачи должны определить четкие показания к назначению того или иного средства. Получить дорогостоящее лечение довольно сложно — нужно пройти полное обследование, собрать документы. Однако предоставление государственной квоты для многих пациентов является последним шансом на полноценную жизнь.
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Аутоиммунные синдромы, спровоцированные введением лекарства, обычно представлены васкулитами, СКВ, антифосфолипидным синдромом, псориазом [25]. Высокой иммуногенностью обладает инфликсимаб, в составе которого есть чужеродные мышиные фрагменты. Менее активно провоцируют иммунитет полностью «человеческие» препараты. Но даже при их применении есть высокий риск развития побочных аутоиммунных реакций. Чтобы устранить эти нарушения, необходимо скорректировать схему лечения больного. В нее включают дополнительные иммуносупрессоры, которые будут подавлять осложнения. Возможно, поэтому комбинации биологических препаратов с базисными лекарствами часто более эффективны, чем изолированная терапия, пусть даже и самыми новыми средствами [24].
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
- Иммунитет: борьба с чужими и… своими;
- Системная красная волчанка: болезнь с тысячью лиц;
- Ревматоидный артрит: изменить состав суставов;
- Насонов Е.Л., Александрова Е.Н., Новиков А.А. (2015). Аутоиммунные ревматические заболевания — проблемы иммунопатологии и персонифицированной терапии. Вестник РАМН. 2, 169–182;
- Бабаева А.Р., Калинина Е.В., Звоноренко М.С. (2016). Новые возможности повышения эффективности и безопасности лечения ревматоидного артрита. Медицинский алфавит. 22, 5–12;
- Josef S Smolen, Robert Landewé, Ferdinand C Breedveld, Maya Buch, Gerd Burmester, et. al.. (2014). EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann Rheum Dis. 73, 492-509;
- Насонов Е.Л. (2015). Метотрексат при ревматоидном артрите — 2015: новые факты и идеи. Научно-практическая ревматология. 4, 421–433;
- Каневская М.З. и Гурская С.В. (2013). Метотрексат в лечении ревматических заболеваний. Современная ревматология. 4, 47–53;
- D. T. Felson, J. S. Smolen, G. Wells, B. Zhang, L. H. D. van Tuyl, et. al.. (2011). American College of Rheumatology/European League Against Rheumatism Provisional Definition of Remission in Rheumatoid Arthritis for Clinical Trials. Annals of the Rheumatic Diseases. 70, 404-413;
- Patrick Durez, Jacques Malghem, Adrien Nzeusseu Toukap, Geneviève Depresseux, Bernard R. Lauwerys, et. al.. (2007). Treatment of early rheumatoid arthritis: A randomized magnetic resonance imaging study comparing the effects of methotrexate alone, methotrexate in combination with infliximab, and methotrexate in combination with intravenous pulse methylprednisolone. Arthritis Rheum. 56, 3919-3927;
- Моноклональные антитела;
- 12 методов в картинках: иммунологические технологии;
- Аутофагия, протофагия и остальные;
- Нобелевская премия по медицине и физиологии 2016: за самоедство;
- Зайчик А.М., Полетаев А.Б., Чурилов Л.П. (2013). Распознавание «Своего» и взаимодействие со «Своим» как основная форма активности адаптивной иммунной системы. Вестник СПбГУ. Серия 11. Медицина. 1;
- Аутоиммунитет. Современные взгляды на физиологические и патологические аспекты аутоиммунитета. Электронный архив НГУ;
- Впервые за полвека появилось новое лекарство от волчанки;
- Насонов Е.Л. и Каратеев Д.Е. (2013). Применение генно-инженерных биологических препаратов для лечения ревматоидного артрита: общая характеристика (лекция). Научно-практическая ревматология. 2, 163–169;
- Логвиненко С.И., Щербань Э.А., Придачина Л.С., Придачина А.Н., Маслова Ю.Ю., Кашичкина А.А. (2016). Генная инженерия в лечении анкилозирующего спондилита (болезни Бехтерева). Научные ведомости БелГУ. Серия: Медицина. Фармация. 19, 179–182;
- Masahiko Mihara, Misato Hashizume, Hiroto Yoshida, Miho Suzuki, Masashi Shiina. (2012). IL-6/IL-6 receptor system and its role in physiological and pathological conditions. Clin. Sci.. 122, 143-159;
- Насонов Е.Л., Александрова Е.Н., Авдеева А.С., Панасюк Е.Ю. (2013). Ингибиция интерлейкина 6 — новые возможности фармакотерапии иммуновоспалительных ревматических заболеваний. Научно-практическая ревматология. 4, 416–427;
- Супоницкая Е.В., Александрова Е.Н., Алексанкин А.П., Насонов Е.Л. (2015). Влияние терапии генно-инженерными биологическими препаратами на субпопуляции В-лимфоцитов при ревматических заболеваниях: новые данные. Научно-практическая ревматология. 1, 78–83;
- Бабаева А.Р., Черевкова Е.В., Гальченко О.Е., Солоденкова К.С. (2012). Биологические агенты в базисной терапии ревматоидного артрита. Лекарственный вестник. 7, 3–9;
- Муравьев Ю.В. и Муравьева Л.А. (2016). Несвоевременные мысли о применении генно-инженерных биологических препаратов при ревматических болезнях. Научно-практическая ревматология. 3, 361–366;
- Псориаз: на войне с собственной кожей.
