Haute Fragrance Company
Wrap Me In Dreams: отзывы
Отзывы и оценки Haute Fragrance Company Wrap Me In Dreams
(1646)
Прекрасный гурманский аромат с ярко выраженными вишневыми нотками. Для меня наверное лучший ромат с нотами вишни!
Сладенький, яркий, но в то же время нежный аромат! Звучит дорого и очень интересно! Мне кажется, что обязательно нужно иметь в коллекции ароматы от hfc
Красивая вишня даже больше вишневая косточка пряный аромат с горчинкой не душный понравился пожалуй закажу еще . Шлейф есть уловимый и красивый .
Шикарная вишня, на зиму самое то, или на выход в торжество. Вишня действительно похоже на тома форда, только нежнее и по мне более приятнее
Напоминает лост черри, но более сладкий и менее терпкий. Быстро раскрывается сладким вишневым компотом. Приятный аромат. Стойкость средняя.
Аромат-забота. Очень мягкий, тёплый, с ванилью и чем-то почти сливочным. Его хочется носить в прохладные дни, чтобы создать себе уют. Не слишком громкий, но устойчивый и красивый в шлейфе. Название говорит само за себя
Действительно «обволакивающий» аромат — тёплый, сладковатый, с бархатной текстурой. Есть в нём и мягкость, и глубина. Идеален для холодных вечеров, когда хочется уюта и спокойствия. Очень красивый и приятный шлейф вишни
Оригинальный, неизбитый аромат. Определенно подойдёт на вечер и на холодное время года. Стойкость великолепная.
Приятный, мягкое звучание вишни с косточкой, стойкий, шлейфовый, мягче и нежнее, чем Том Форд, в базе легкая животинка. Очень долго остается на одежде.
Для меня вишня и ваниль, великолепный аромат, густой, обволакивающий, очень приятный.
На моей горячей коже не особо держится, часа 3 максимум, если принюхиваться, на одежде дольше.
Очень нравится этот аромат . Напоминает вишневый пунш или ром ) Всегда получаю комплементы от окружающих , когда наношу его
Очень вкусные, напоминают том Форд лом чери! Прислали флакон духов с двумя пробниками ❤️ быстрая отправка духов! Рекомендую всем 🌷
Сладкий вишнёвый аромат, с нотками алкоголя. Без особой глубины, но очень жизнерадостный, лёгкий вариант тф на весну и лето
Вишня, сухофрукты и ваниль. Сильной и яркой композицией назвать не могу, таких ароматов сейчас много, не хватило чего-то уникального. Стойкость на 4.
Поняла, что с ним категорически нельзя перебарщивать: 1-2 пшика и тебя обволакивает прекрасный вишневый шлейф, более 3 распылений и вот от тебя пахнет котом, который сходил под куст этой самой вишни, так что в переборе очень сильно вылезает мускус
Это восторг. Начинается с вишнёвой ноты. Дальше появляется бензоин, который сводит с ума. Шлейф-мускус и сандал. Создаёт ощущение очень приятной домашней теплоты
Начинается очень красиво. Вишнево-ванильный аромат. Раскрывается приятно. В конце- древеснно-сладкое звучание. Стойкость на высоте
Аромат на тему фордовской вишни, но не клон: здесь даже черешня, фокус именно на ягоду, а не на ее запчасти и ликер, и сам аромат более плотный. Нравится больше форда.
Начитался отзывов, боялся синтетической вишни, но нет, звучит вполне благородно. Шлейф есть. На лост черри не похоже, имхо.
Засахаренная вишня из шоколадных конфет с ликером, в отличие от Lost Cherry более сладкий и с меньшим содержанием миндаля и терпкости
Здравствуйте!
Название аромата переводится как «Окутай меня мечтами», романтичная фраза, надо заметить.
На самом деле Wrap Me In Dreams HFC, лично для меня, парфюм скорее деловой и серьезный, чем романтичный.
В нем есть стержень, характер и капля яда, вероятно чтоб избавиться от соперников.
✦ Wrap Me In Dreams ✦ Haute Fragrance Company.
Выпуск 2020 года.
Аромат для женщин.
Группа: восточные гурманские.
Парфюмер: Benoît Bergia.
Пирамида:
Верхние ноты:
Ром, Вишня и Сухофрукты;
Средние ноты:
Древесные ноты, Пачули и Бобы тонка;
Базовые ноты:
Мускус, Ваниль, Пудровые ноты и Пион.

Отзыв
╰◕ Как выглядит?
Флакон выглядит потрясающе! Ну, а у меня скучно-правильная миниатюра в объеме 7,5 мл. Имеет добротный распылитель и батч код на дне.
╰◕ Как раскрывается?
В самом начале яркий, заявляет о себе издалека, шлейфом в несколько метров.
Красивый миндально-вишневый старт плавно переходит в компотные оттенки сухофруктов и пудровую базу.
Усаживаясь становится уютней, пахнет косметикой и пудрой довольно долго, особенно на тканях.
Богатый, в нем можно найти горчинку вишневой косточки, миндаль, сухофрукты, алкогольные, древесные нотки, ваниль.
При этом может звучать монотонно, вероятно за счет высокой плотности.

Отзыв
╰◕ Особенности аромата.
Wrap Me In Dreams очень яркий и стойкий. Хватает одного распыления, чтоб получить вишневый шлейф.
Он хорошо подходит для хмурой осени и морозной зимы. Имеет свойство будить нервную систему, согревает ромовыми оттенками.
При раскрытии аромата я слышу ноту миндаля. Цианидный оттенок миндаля частый эффект в вишнёвых аккордах. Здесь он явно присутствует.

Зима
✦ Мое отношение.
Мечты у большинства людей ассоциируются с чем-то неуловимым и легким. В данном случае название Wrap Me In Dreams создает диссонанс.
Это не аромат мечта, а скорее яркая визуализация или даже четкий план на достижение цели))
Пусть название не вводит вас в заблуждение, парфюм насыщенный, интенсивный не теряет своей плотности несколько часов.
Я устаю от него быстрее, чем мне бы того хотелось. В неравном бою он побеждает!
Поэтому ношу крайне редко, под особое вишневое настроение.

Лето
Предполагаю, подойдет тем, кто любит восточные яркие ароматы. Если вам кажется, что Tom Ford Lost Cherry не достаточно громкий, можно попробовать Wrap Me In Dreams HFC.
Прощаюсь!
Всем любимых ароматов!
Здесь можно почитать другие парфюмерные отзывы.

24.03.2025
Описание препарата Форсига (таблетки, покрытые пленочной оболочкой, 10 мг) основано на официальной инструкции, утверждено компанией-производителем в 2025 году
Дата согласования: 24.03.2025
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью. Влияние на фертильность
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Таблетки, покрытые пленочной оболочкой | 1 табл. |
| действующее вещество: | |
| дапаглифлозина пропандиола моногидрат | 6,150/12,300 мг |
| (эквивалентно 5,000/10,000 мг дапаглифлозина) | |
| вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: лактоза безводная — 25,000/50,000 мг (см. «Особые указания») | |
| вспомогательные вещества (полный перечень) ядро таблетки: целлюлоза микрокристаллическая; лактоза безводная; кросповидон; кремния диоксид; магния стеарат |
|
| оболочка пленочная: Опадрай® II желтый (поливиниловый спирт частично гидролизованный, титана диоксид, макрогол 3350, тальк, краситель оксид железа желтый |
Описание лекарственной формы
Таблетки, покрытые пленочной оболочкой, 5 мг: круглые двояковыпуклые, покрытые пленочной оболочкой желтого цвета, с гравировкой «5» на одной стороне и «1427» — на другой.
Таблетки, покрытые пленочной оболочкой, 10 мг: ромбовидные двояковыпуклые, покрытые пленочной оболочкой желтого цвета, с гравировкой «10» на одной стороне и «1428» — на другой.
Фармакологическое действие
Фармакодинамика
Механизм действия
Дапаглифлозин — мощный (константа ингибирования (Кi) 0,55 нмоль), селективный обратимый ингибитор натрий-глюкозного котранспортера 2-го типа (SGLT2).
Ингибирование SGLT2 дапаглифлозином вызывает снижение реабсорбции глюкозы из клубочкового фильтрата в проксимальных почечных канальцах с сопутствующим снижением реабсорбции натрия, приводя к выведению глюкозы почками и осмотическому диурезу. Таким образом дапаглифлозин увеличивает доставку натрия к дистальным канальцам, что усиливает канальцево-клубочковую обратную связь и снижает внутриклубочковое давление. Это в сочетании с осмотическим диурезом приводит к уменьшению перегрузки объемом, снижению артериального давления и уменьшению преднагрузки и постнагрузки, что может оказывать благоприятное влияние на ремоделирование сердца и сохранять функцию почек.
В клинических исследованиях DAPA-HF, DELIVER и DAPA-CKD было показано, что благоприятное влияние дапаглифлозина на сердце и почки зависит не только от снижения концентрации глюкозы в крови и наблюдается не только у пациентов с сахарным диабетом типа 2 (СД2). Другие эффекты включают повышение гематокрита и снижение массы тела.
Дапаглифлозин снижает концентрацию глюкозы плазмы крови натощак (ГПН) и после приема пищи за счет уменьшения реабсорбции глюкозы в почечных канальцах, способствуя выведению глюкозы почками. Выведение глюкозы (глюкозурический эффект) наблюдается уже после приема первой дозы препарата, сохраняется в течение последующих 24 часов и продолжается на протяжении всей терапии. Количество глюкозы, выводимой почками за счет этого механизма, зависит от концентрации глюкозы в крови и скорости клубочковой фильтрации (СКФ). Таким образом, у пациентов с нормальной концентрацией глюкозы в крови на фоне применения дапаглифлозина отмечается низкая склонность к развитию гипогликемии. Дапаглифлозин не нарушает нормальную продукцию эндогенной глюкозы в ответ на гипогликемию.
Действие дапаглифлозина не зависит от секреции инсулина и чувствительности к инсулину. В клинических исследованиях дапаглифлозина отмечалось улучшение функции бета-клеток (тест НОМА, homeostasis model assessment).
SGLT2 селективно экспрессируется в почках. Дапаглифлозин не оказывает воздействия на другие переносчики глюкозы, осуществляющие транспорт глюкозы к периферическим тканям, и проявляет более чем в 1400 раз бóльшую селективность к SGLT2, чем к SGLT1, основному транспортеру в кишечнике, отвечающему за всасывание глюкозы.
Фармакодинамические эффекты
После приема дапаглифлозина здоровыми добровольцами и пациентами с СД2 наблюдалось увеличение количества выводимой почками глюкозы. При приеме дапаглифлозина в дозе 10 мг/сут в течение 12 нед пациентами с СД2 примерно 70 г глюкозы в сутки выделялось почками (что соответствует 280 ккал/сут). У пациентов с СД2, принимавших дапаглифлозин в дозе 10 мг/сут длительно (до 2 лет), выведение глюкозы поддерживалось на протяжении всего курса терапии.
Выведение глюкозы почками при применении дапаглифлозина также приводит к осмотическому диурезу и увеличению объема мочи. Увеличение объема мочи у пациентов с СД2, принимавших дапаглифлозин в дозе 10 мг/сут, сохранялось в течение 12 нед и составляло примерно 375 мл/сут. Увеличение объема мочи сопровождалось небольшим и транзиторным повышением выведения натрия почками, что не приводило к изменению концентрации натрия в сыворотке крови.
Кроме того, отмечалось кратковременное (в течение 3–7 дней) увеличение экскреции мочевой кислоты с мочой, сопровождавшееся устойчивым снижением концентрации мочевой кислоты в сыворотке крови. Через 24 недели снижение концентрации мочевой кислоты в сыворотке варьировало от –48,3 до –18,3 мкмоль/л (от –0,87 до –0,33 мг/дл).
Клиническая эффективность и безопасность
СД2. Улучшение контроля гликемии и снижение заболеваемости и смертности по причине сердечно-сосудистой патологии и осложнений со стороны почек являются неотъемлемой частью лечения СД2.
Для оценки эффективности контроля гликемии и безопасности препарата Форсига было проведено 14 двойных слепых рандомизированных контролируемых клинических исследований с участием 7056 взрослых пациентов с СД2, в которых 4737 пациентов получали дапаглифлозин. 12 исследований предусматривали период лечения продолжительностью 24 недели, 8 исследований — дополнительный период долгосрочного лечения от 24 до 80 недель (общая продолжительность исследований — до 104 недель), 1 исследование предусматривало период лечения продолжительностью 28 недель, и еще 1 исследование — период лечения продолжительностью 52 недели с дополнительными периодами долгосрочного лечения продолжительностью 52 и 104 недели (общая продолжительность исследования — 208 недель). Средняя продолжительность СД2 у пациентов варьировала от 1,4 до 16,9 года. У 50% пациентов было нарушение функции почек легкой степени тяжести, у 11% пациентов — нарушение функции почек средней степени тяжести. 51% пациентов были мужского пола, 84% принадлежали к европеоидной расе, 8% — к монголоидной расе, 4% — к негроидной расе, а 4% — к другим расовым группам. У 81% пациентов значение индекса массы тела (ИМТ) составило ≥27. Кроме того, было проведено два плацебо-контролируемых исследования продолжительностью 12 недель у пациентов с СД2 с неадекватным контролем гликемии и артериальной гипертензии. Для оценки эффекта дапаглифлозина в дозе 10 мг по сравнению с плацебо в отношении сердечно-сосудистых и почечных исходов было проведено исследование сердечно-сосудистых исходов DECLARE, в котором приняли участие 17160 пациентов с СД2 с диагностированным сердечно-сосудистым заболеванием или без него.
Контроль гликемии
Монотерапия. Для оценки безопасности и эффективности препарата Форсига в качестве монотерапии у пациентов с неадекватным контролем СД2 типа было проведено двойное слепое плацебо-контролируемое исследование продолжительностью 24 недели (с дополнительным периодом лечения). При приеме дапаглифлозина 1 раз в сутки было отмечено статистически значимое (p<0,0001) уменьшение уровня гликированного гемоглобина (HbA1c) по сравнению с приемом плацебо (таблица 1).
В дополнительном периоде лечения снижение уровня HbA1c сохранялось вплоть до 102 недель (скорректированное среднее изменение относительно исходного уровня: –0,6 и –0,17% для дапаглифлозина 10 мг и плацебо соответственно).
Таблица 1
Результаты, полученные через 24 недели (LOCF1) в плацебо контролируемом исследовании применения дапаглифлозина в качестве монотерапии
| Показатели | Монотерапия | |
| Дапаглифлозин 10 мг | Плацебо | |
| N2 | 70 | 75 |
| HbA1c (%) | ||
| Исходный уровень (среднее) | 8,01 | 7,79 |
| Изменение относительно исходного уровня3 | –0,89 | –0,23 |
| Разность относительно плацебо3 | –0,664 | |
| (95% ДИ) | (–0,96, –0,36) | |
| % пациентов, достигших уровня HbA1c <7% | ||
| Значение, скорректированное относительно исходного уровня | 50,85 | 31,6 |
| Масса тела, кг | ||
| Исходный уровень (среднее) | 94,13 | 88,77 |
| Изменение относительно исходного уровня3 | –3,16 | –2,19 |
| Разность относительно плацебо3 | –0,97 | |
| (95% ДИ) | (–2,20, 0,25) |
1LOCF: перенос данных последнего (до применения неотложной терапии для пациентов, у которых она применялась) наблюдения вперед.
2Все рандомизированные пациенты, получившие не менее 1 дозы исследуемого препарата в двойном слепом режиме в краткосрочном двойном слепом периоде.
3Среднее значение, рассчитанное методом наименьших квадратов, скорректированное относительно исходного уровня.
4р<0,0001 для различия с плацебо.
5Ввиду выполнения последовательного статистического анализа вторичных конечных точек оценку статистической значимости не проводили.
Комбинированная терапия
В исследовании не меньшей эффективности с активным контролем продолжительностью 52 недели (с дополнительными периодами лечения продолжительностью 52 и 104 недели) проводили оценку препарата Форсига в качестве добавления к терапии метформином по сравнению с производным сульфонилмочевины (глипизид) в качестве добавления к терапии метформином у пациентов с неадекватным контролем гликемии (HbA1c >6,5 и ≤0%). По результатам исследования было показано сходное среднее уменьшение уровня HbA1c относительно исходного уровня вплоть до 52-й недели по сравнению с терапией глипизидом, что свидетельствует о не меньшей эффективности терапии дапаглифлозином (таблица 2). Через 104 недели скорректированное среднее изменение уровня HbA1c относительно исходного уровня составило –0,32% для дапаглифлозина и –0,14% для глипизида. Через 208 недель скорректированное среднее изменение уровня HbA1c относительно исходного уровня составило –0,10% для дапаглифлозина и 0,20% для глипизида. Через 52, 104 и 208 недель статистически значимо меньшая доля пациентов в группе дапаглифлозина (3,5, 4,3 и 5,0% , соответственно), перенесла по крайней мере один эпизод гипогликемии по сравнению с группой глипизида (40,8, 47,0 и 50,0% соответственно). Доля пациентов, оставшихся в исследовании через 104 и 208 недель, составила 56,2 и 39,7% в группе дапаглифлозина, и 50,0 и 34,6% в группе глипизида.
Таблица 2
Результаты, полученные через 52 недели (LOCF1) в сравнительном исследовании с активным контролем по оценке добавления дапаглифлозина и глипизида к терапии метформином
| Показатель | Дапаглифлозин в добавление к метформину | Глипизид в добавление к метформину |
| N2 | 400 | 401 |
| HbA1c,% | ||
| Исходный уровень (среднее) | 7,69 | 7,74 |
| Изменение относительно исходного уровня3 | –0,52 | –0,52 |
| Разность относительно терапии глипизидом в сочетании с метформином3 | 0,004 | |
| (95% ДИ) | (–0,11, 0,11) | |
| Масса тела, кг | ||
| Исходный уровень (среднее) | 88,44 | 87,60 |
| Изменение относительно исходного уровня3 | –3,22 | 1,44 |
| Разность относительно терапии глипизидом в сочетании с метформином3 | –4,655 | |
| (95% ДИ) | (–5,14, –4,17) |
1LOCF: перенос данных последнего наблюдения вперед.
2Рандомизированные и получавшие лечение пациенты с исходной оценкой и как минимум одной оценкой эффективности после исходного уровня.
3Среднее значение, рассчитанное методом наименьших квадратов, скорректированное относительно исходного уровня.
4Не меньшая эффективность по сравнению с терапией глипизидом в сочетании с метформином.
5p <0,0001.
Применение дапаглифлозина в качестве добавления к терапии метформином, глимепиридом, метформином и производным сульфонилмочевины, ситаглиптином (с метформином или без него) или препаратом инсулина привело к статистически значимому уменьшению уровня HbA1c через 24 недели по сравнению с приемом плацебо (p<0,0001; таблицы 3, 4 и 5).
Уменьшение уровня HbA1c, наблюдаемое через 24 недели, носило устойчивый характер в исследованиях добавления дапаглифлозина (к глимепириду или препарату инсулина) согласно данным, полученным вплоть до 48 недель терапии (глимепирид) и 104 недель терапии (препарат инсулина). Через 48 недель применения дапаглифлозина в качестве добавления к терапии ситаглиптином (с метформином или без него) скорректированное среднее изменение относительно исходного уровня для дапаглифлозина в дозе 10 мг и плацебо составило –0,30 и 0,38% соответственно. В исследовании дапаглифлозина в качестве добавления к терапии метформином уменьшение уровня HbA1c сохранялось вплоть до 102-й недели (скорректированное среднее изменение относительно исходного уровня –0,78 и 0,02% для дапаглифлозина 10 мг и плацебо соответственно). Через 104 недели исследования дапаглифлозина в качестве добавления к терапии препаратом инсулина (в комбинации с дополнительными гипогликемическими препаратами или без них) скорректированное среднее уменьшение уровня HbA1c относительно исходного уровня составило –0,71 и –0,06% для дапаглифлозина 10 мг и плацебо соответственно. Через 48 и 104 недели у пациентов, получавших дапаглифлозин в дозе 10 мг, доза препарата инсулина оставалась стабильной по сравнению с исходным уровнем и в среднем составляла 76 ЕД/сутки. В группе, получавшей плацебо, наблюдалось среднее увеличение дозы препарата инсулина на 10,5 и 18,3 ЕД/сутки относительно исходного уровня (средняя доза: 84 и 92 ЕД/сутки) через 48 и 104 недели соответственно. Доля пациентов, оставшихся в исследовании через 104 недели, составила 72,4% в группе, получавшей дапаглифлозин 10 мг, и 54,8% в группе, получавшей плацебо.
Таблица 3
Результаты плацебо-контролируемых исследований дапаглифлозина в качестве добавления к терапии метформином или ситаглиптином (с метформином или без него) продолжительностью 24 недели (LOCF3)
| Показатели | Комбинированная терапия (добавление) | |||
| Метформин1 | Ингибитор ДПП-4 (ситаглиптин2) ± метформин1 | |||
| Дапаглифлозин 10 мг | Плацебо | Дапаглифлозин 10 мг | Плацебо | |
| N4 | 135 | 137 | 223 | 224 |
| HbA1c, % | ||||
| Исходный уровень (среднее) | 7,92 | 8,11 | 7,90 | 7,97 |
| Изменение относительно исходного уровня5 | –0,84 | –0,30 | –0,45 | 0,04 |
| Разность относительно плацебо5 | –0,546 | –0,486 | ||
| (95% ДИ) | (–0,74, –0,34) | (–0,62, –0,34) | ||
| % пациентов, достигших уровня HbA1c <7% | ||||
| Значение, скорректированное относительно исходного уровня | 40,67 | 25,9 | ||
| Масса тела, кг | ||||
| Исходный уровень (среднее) | 86,28 | 87,74 | 91,02 | 89,23 |
| Изменение относительно исходного уровня5 | –2,86 | –0,89 | –2,14 | –0,26 |
| Разность относительно плацебо5 | –1,976 | –1,896 | ||
| (95% ДИ) | (–2,63, –1,31) | (–2,37, –1,40) |
ДПП 4 — дипептидилпептидаза 4.
1Метформин ≥1500 мг/сутки.
2Ситаглиптин 100 мг/сутки.
3LOCF: перенос данных последнего наблюдения (до применения неотложной терапии для пациентов, у которых она применялась) вперед.
4Все рандомизированные пациенты, получившие не менее 1 дозы исследуемого препарата в двойном слепом режиме в краткосрочном двойном слепом периоде.
5Среднее значение, рассчитанное методом наименьших квадратов, скорректированное относительно исходного уровня.
6р <0,0001 для различия относительно терапии плацебо в сочетании с пероральным гипогликемическим препаратом.
7р <0,05 для различия относительно терапии плацебо в сочетании с пероральным гипогликемическим препаратом.
Таблица 4
Результаты плацебо-контролируемых исследований дапаглифлозина в качестве добавления к терапии производным сульфонилмочевины (глимепирид) или метформином и производным сульфонилмочевины продолжительностью 24 недели
| Комбинированная терапия (добавление) | ||||
| Производное сульфонилмочевины (глимепирид1) | Производное сульфонилмочевины в сочетании с метформином2 | |||
| Дапаглифлозин 10 мг | Плацебо | Дапаглифлозин 10 мг | Плацебо | |
| N3 | 151 | 145 | 108 | 108 |
| HbA1c? %4 | ||||
| Исходный уровень (среднее) | 8,07 | 8,15 | 8,08 | 8,24 |
| Изменение относительно исходного уровня5 | –0,82 | –0,13 | –0,86 | –0,17 |
| Разность относительно плацебо5 | –0,688 | –0,698 | ||
| (95% ДИ) | (–0,86, –0,51) | (–0,89, –0,49) | ||
| % пациентов, достигших уровня HbA1c <7% (LOCF)6 | ||||
| Значение, скорректированное относительно исходного уровня | 31,78 | 13,0 | 31,88 | 11,1 |
| Масса тела, кг (LOCF)6 | ||||
| Исходный уровень (среднее) | 80,56 | 80,94 | 88,57 | 90,07 |
| Изменение относительно исходного уровня5 | –2,26 | –0,72 | –2,65 | –0,58 |
| Разность относительно плацебо5 | –1,548 | –2,078 | ||
| (95% ДИ) | (–2,17, –0,92) | (–2,79, –1,35) |
1Глимепирид 4 мг/сутки.
2Метформин (лекарственные формы с немедленным или пролонгированным высвобождением) в дозе ≥1500 мг/сутки в сочетании с максимальной переносимой дозой (должна составлять не менее половины максимальной дозы) производного сульфонилмочевины в течение как минимум 8 недель до включения в исследование.
3Рандомизированные и получавшие лечение пациенты с исходной оценкой и как минимум одной оценкой эффективности после исходного уровня.
4Столбцы 1 и 2 — анализ уровня HbA1c с применением метода LOCF (см. примечание 6); столбцы 3 и 4 — анализ уровня HbA1c с применением метода LRM (см. примечание 7).
5Среднее значение, рассчитанное методом наименьших квадратов, скорректированное относительно исходного уровня.
6LOCF — Перенос данных последнего (пациенты до применения неотложной терапии) наблюдения вперед.
7LRM — Продольный анализ повторных измерений.
р <0,0001 для различия относительно терапии плацебо в сочетании с пероральным(-и) гипогликемическим(-и) препаратом(-ами).
Таблица 5
Результаты, полученные через 24 недели (LOCF1) в плацебо-контролируемом исследовании дапаглифлозина в качестве комбинированной терапии с инсулином (в качестве монотерапии или в комбинации с пероральными гипогликемическими препаратами)
| Показатель | Дапаглифлозин 10 мг в комбинации с инсулином ± пероральные гипогликемические препараты7 | Плацебо в комбинации с инсулином ± пероральные гипогликемические препараты7 |
| N2 | 194 | 193 |
| HbA1c, % | ||
| Исходный уровень (среднее) | 8,58 | 8,46 |
| Изменение относительно исходного уровня3 | –0,90 | –0,30 |
| Разность относительно плацебо3 | –0,604 | |
| (95% ДИ) | (–0,74, –0,45) | |
| Масса тела, кг | ||
| Исходный уровень (среднее) | 94,63 | 94,21 |
| Изменение относительно исходного уровня3 | –1,67 | 0,02 |
| Разность относительно плацебо3 | –1,684 | |
| (95% ДИ) | (–2,19, –1,18) | |
| Средняя суточная доза инсулина (ЕД)6 | ||
| Исходный уровень (среднее) | 77,96 | 73,96 |
| Изменение относительно исходного уровня3 | –1,16 | 5,08 |
| Разность относительно плацебо3 | –6,234 | 11,0 |
| (95% ДИ) | (–8,84, –3,63) | |
| Пациенты со снижением средней суточной дозы инсулина не менее чем на 10% (%) | 19,75 |
1LOCF: перенос данных последнего (до или в дату первого повышения дозы инсулина, при необходимости) наблюдения вперед.
2Все рандомизированные пациенты, получившие не менее 1 дозы исследуемого препарата в двойном слепом режиме в краткосрочном двойном слепом периоде.
3Среднее значение, рассчитанное методом наименьших квадратов, скорректированное относительно исходного уровня и наличия перорального гипогликемического препарата.
4р<0,0001 для различия относительно терапии плацебо в сочетании с инсулином ± пероральный гипогликемический препарат.
5р<0,05 для различия относительно терапии плацебо в сочетании с инсулином ± пероральный гипогликемический препарат.
6Повышение дозы препарата инсулина (включая инсулин короткого действия, инсулин средней продолжительности действия и базальный инсулин) допускалось только в случае соответствия пациентов предварительно заданным критериям концентрации ГПН.
7Исходно 50% пациентов получали монотерапию препаратом инсулина; 50% пациентов в дополнение к терапии инсулином принимали 1 или 2 пероральных гипогликемических препарата: из этой группы 80% принимали только метформин, 12% принимали метформин в комбинации с производным сульфонилмочевины, а остальные пациенты принимали другие пероральные гипогликемические препараты.
Комбинированная терапия с метформином у пациентов, ранее не получавших терапию
В общей сложности 1236 пациентов с неадекватным контролем СД2 (HbA1c ≥7,5 и ≤12%), ранее не получавших терапию, приняли участие в 2 исследованиях с активным контролем продолжительностью 24 недели для оценки эффективности и безопасности комбинированной терапии дапаглифлозином (5 или 10 мг) в сочетании с метформином у пациентов, ранее не получавших терапию, по сравнению с монотерапией.
Лечение дапаглифлозином в дозе 10 мг в комбинации с метформином (в дозе до 2000 мг/сутки) обеспечило статистически значимое улучшение уровня HbA1c по сравнению с монотерапией (таблица 6) и привело к более выраженному снижению концентрации ГПН (по сравнению с монотерапией) и массы тела (по сравнению с терапией метформином).
Таблица 6
Результаты, полученные через 24 недели (LOCF1) в сравнительном исследовании с активным контролем по оценке комбинированной терапии дапаглифлозином и метформином у пациентов, ранее не получавших терапию
| Показатель | Дапаглифлозин 10 мг в сочетании с метформином | Дапаглифлозин 10 мг | Метформин |
| N2 | 2112 | 2192 | 2082 |
| HbA1c, % | |||
| Исходный уровень (среднее) | 9,10 | 9,03 | 9,03 |
| Изменение относительно исходного уровня3 | –1,98 | –1,45 | –1,44 |
| Разность относительно терапии дапаглифлозином3 | –0,534 | ||
| (95% ДИ) | (–0,74, –0,32) | ||
| Разность относительно терапии метформином3 | –0,544 | –0,01 | |
| (95% ДИ) | (–0,75, –0,33) | (–0,22, 0,20) |
1LOCF: перенос данных последнего (до применения неотложной терапии для пациентов, у которых она применялась) наблюдения вперед.
2Все рандомизированные пациенты, получившие не менее 1 дозы исследуемого препарата в двойном слепом режиме в краткосрочном двойном слепом периоде.
3Среднее значение, рассчитанное методом наименьших квадратов, скорректированное относительно исходного уровня.
р<0,0001.
Комбинированная терапия с эксенатидом пролонгированного действия
В двойном слепом исследовании с активным контролем продолжительностью 28 недель сравнивали комбинированную терапию дапаглифлозином и эксенатидом пролонгированного действия (агонистом рецепторов глюкагоноподобного пептида-1 (ГПП-1) с монотерапией дапаглифлозином и монотерапией эксенатидом пролонгированного действия у пациентов с неадекватным контролем гликемии при монотерапии метформином (HbA1c ≥ 8 и ≤12%).
Во всех группах лечения было отмечено снижение уровня HbA1c по сравнению с исходным уровнем. В группе комбинированной терапии дапаглифлозином в дозе 10 мг и эксенатидом пролонгированного действия было показано более выраженное снижение уровня HbA1c относительно исходного уровня по сравнению с монотерапией дапаглифлозином и монотерапией эксенатидом пролонгированного действия (таблица 7).
Таблица 7
Результаты исследования терапии дапаглифлозином и эксенатидом пролонгированного действия по сравнению с монотерапией дапаглифлозином и монотерапией эксенатидом пролонгированного действия (пациенты популяции с назначенным лечением (ITT) в комбинации с метформином продолжительностью 28 недель
| Показатель | Дапаглифлозин 10 мг 1 раз сутки в комбинации с эксенатидом пролонгированного действия 2 мг 1 раз в неделю | Дапаглифлозин 10 мг 1 раз сутки в комбинации с плацебо 1 раз в неделю | Эксенатид пролонгированного действия 2 мг 1 раз в неделю в комбинации с плацебо 1 раз в сутки |
| N | 228 | 230 | 227 |
| HbA1c, % | |||
| Исходный уровень (среднее) | 9,29 | 9,25 | 9,26 |
| Изменение относительно исходного уровня1 | –1,98 | –1,39 | –1,60 |
| Средняя разность в изменении относительно исходного уровня между комбинированной терапией и терапией одним препаратом | –0,592 | –0,383 | |
| (95% ДИ) | (–0,84; –0,34) | (–0,63, –0,13) | |
| % пациентов, достигших уровня HbA1c <7% | 44,7 | 19,1 | 26,9 |
| Масса тела, кг | |||
| Исходный уровень (среднее) | 92,13 | 90,87 | 89,12 |
| Изменение относительно исходного уровня1 | –3,55 | –2,22 | –1,56 |
| Средняя разность в изменении относительно исходного уровня между комбинированной терапией и терапией одним препаратом | –1,332 | –2,002 | |
| (95% ДИ) | (–2,12, –0,55) | (–2,79, –1,20) |
N — количество пациентов, ДИ — доверительный интервал.
1Скорректированные средние значения, рассчитанные методом наименьших квадратов, и разность в изменении относительно исходного уровня через 28 недель смоделированы с использованием модели со смешанными эффектами для повторных измерений (MMRM), которая включала вариант терапии, регион, страту исходного уровня HbA1c (<9,0 или ≥9,0%) неделю лечения и взаимодействие «терапия–неделя» в качестве постоянных значений и значение исходного уровня в качестве ковариаты.
2p<0,001.
3p<0,01.
Все значения p скорректированы с поправкой на множественность.
В статистический анализ не включали измерения, полученные после применения неотложной терапии, а также после преждевременного прекращения приема исследуемого препарата.
Концентрация глюкозы в плазме натощак
Применение дапаглифлозина в дозе 10 мг в качестве монотерапии или в качестве добавления к терапии метформином, глимепиридом, метформином и производным сульфонилмочевины, ситаглиптином (с метформином или без него) или препаратом инсулина привело к статистически значимому снижению ГПН (от –1,90 до –1,20 ммоль/л) (от –34,2 до –21,7 мг/дл) по сравнению с плацебо (от –0,33 до 0,21 ммоль/л (от –6,0 до 3,8 мг/дл). Этот эффект наблюдался через 1 неделю лечения и сохранялся в исследованиях, продолжавшихся до 104 недель.
Комбинированная терапия дапаглифлозином в дозе 10 мг и эксенатидом пролонгированного действия приводила к статистически значимо большему снижению ГПН через 28 недель лечения: –3,66 ммоль/л (–65,8 мг/дл) по сравнению с –2,73 ммоль/л (–49,2 мг/дл) в группе монотерапии дапаглифлозином (p<0,001) и –2,54 ммоль/л (–45,8 мг/дл) в группе монотерапии эксенатидом (p<0,001).
В специальном исследовании у пациентов с СД2 с рСКФ ≥45 и <60 мл/мин/1,73 м2 терапия дапаглифлозином привела к снижению ГПН через 24 недели: –1,19 ммоль/л (–21,46 мг/дл) по сравнению с –0,27 ммоль/л (–4,87 мг/дл) в группе плацебо (p=0,001).
Концентрация глюкозы в плазме после приема пищи
Применение дапаглифлозина в дозе 10 мг в качестве добавления к терапии глимепиридом приводило к статистически значимому снижению концентрации глюкозы через 2 часа после приема пищи через 24 недели лечения, которое сохранялось вплоть до 48-й недели.
Применение дапаглифлозина в дозе 10 мг в качестве добавления к терапии ситаглиптином (с метформином или без него) приводило к снижению концентрации глюкозы через 2 часа после приема пищи через 24 недели лечения, которое сохранялось вплоть до 48-й недели.
Комбинированная терапия дапаглифлозином в дозе 10 мг и эксенатидом пролонгированного действия приводила к статистически значимо большему снижению концентрации глюкозы через 2 часа после приема пищи через 28 недель лечения по сравнению с терапией каждым препаратом по отдельности.
Масса тела
Применение дапаглифлозина в дозе 10 мг в качестве добавления к терапии метформином, глимепиридом, метформином и производным сульфонилмочевины, ситаглиптином (с метформином или без него) или препаратами инсулина приводило к статистически значимому снижению массы тела через 24 недели (p<0,0001, таблицы 3 и 4). Эти эффекты носили устойчивый характер в долгосрочных исследованиях. Через 48 недель разность значений, полученных в группе добавления дапаглифлозина к терапии ситаглиптином (с метформином или без него) и в группе, получавшей плацебо, составила –2,22 кг. Через 102 недели разность значений, полученных в группе добавления дапаглифлозина к терапии метформином, и в группе, получавшей плацебо, и разность значений, полученных в группе добавления дапаглифлозина к терапии инсулином, и в группе, получавшей плацебо, составила –2,14 и –2,88 кг соответственно.
При применении в качестве добавления к терапии метформином в исследовании не меньшей эффективности с активным контролем дапаглифлозин приводил к статистически значимому снижению массы тела по сравнению с применением глипизида (на –4,65 кг через 52 недели (p<0,0001, таблица 3), которое сохранялось через 104 и 208 недель (–5,06 и –4,38 кг, соответственно).
Применение дапаглифлозина в дозе 10 мг в качестве комбинированной терапии с эксенатидом пролонгированного действия привело к статистически значимо большему снижению массы тела по сравнению с монотерапией каждым препаратом в отдельности (таблица 7).
В исследовании с участием 182 пациентов с СД2 с использованием двухэнергетической рентгеновской абсорбциометрии для оценки количественного состава тела продолжительностью 24 недели, по данным измерений с использованием двухэнергетической рентгеновской абсорбциометрии, при применении дапаглифлозина в дозе 10 мг в сочетании с метформином по сравнению с плацебо в комбинации с метформином было показано, соответственно, снижение массы тела и жировой массы тела, а не потеря мышечной массы или жидкости. В подисследовании с использованием МРТ применение препарата Форсига в комбинации с метформином проводило к количественному уменьшению висцеральной жировой ткани по сравнению с применением плацебо в комбинации с метформином.
АД
На основании анализа объединенных данных 13 плацебо-контролируемых исследований по заранее предусмотренным переменным через 24 недели терапии дапаглифлозином в дозе 10 мг, было показано изменение сАД на –3,7 мм рт.ст. и дАД на –1,8 мм рт.ст. относительно исходного уровня, по сравнению с изменением сАД на –0,5 мм рт.ст. и дАД на –0,5 мм рт.ст. в группе, получавшей плацебо. Сходные изменения наблюдались вплоть до 104-й недели терапии.
Комбинированная терапия дапаглифлозином в дозе 10 мг в комбинации с эксенатидом пролонгированного действия приводила к статистически значимо большему снижению сАД через 28 недель (–4,3 мм рт.ст.) по сравнению с монотерапией дапаглифлозином (–1,8 мм рт.ст., p<0,05) и монотерапией эксенатидом пролонгированного действия (–1,2 мм рт.ст., р<0,01).
В 2 плацебо-контролируемых исследованиях продолжительностью по 12 недель, в общей сложности 1062 пациента с неадекватным контролем СД2 и артериальной гипертензии (несмотря на предшествующую стабильную терапию ингибитором АПФ или блокаторы рецепторов ангиотензина (БРА) II в одном исследовании и ингибитором АПФ или БРА в сочетании с еще одним антигипертензивным препаратом в другом исследовании) получали терапию дапаглифлозином в дозе 10 мг или плацебо. Через 12 недель в обоих исследованиях применение дапаглифлозина в дозе 10 мг в сочетании со стандартной противодиабетической терапией привело к улучшению уровня HbA1c и снижению сАД, скорректированному с учетом плацебо, в среднем на 3,1 и 4,3 мм рт.ст., соответственно. В специальном исследовании у пациентов с СД2 с рСКФ ≥45 и <60 мл/мин/1,73 м2 через 24 недели терапия дапаглифлозином привела к снижению сАД в положении сидя: –4,8 мм рт.ст. по сравнению с –1,7 мм рт.ст. в группе плацебо (p<0,05).
Контроль гликемии у пациентов с нарушением функции почек средней степени тяжести (хроническая болезнь почек стадии 3А, рСКФ ≥45 и <60 мл/мин/1,73 м2)
Эффективность дапаглифлозина была оценена в специальном исследовании у пациентов с СД2 с рСКФ ≥45 и <60 мл/мин/1,73 м2 с неадекватным контролем гликемии при стандартном лечении. Терапия дапаглифлозином привела к уменьшению уровня HbA1c и массы тела по сравнению с плацебо (таблица 8).
Таблица 8
Результаты, полученные через 24 недели в плацебо-контролируемом исследовании применения дапаглифлозина у пациентов с СД2 с рСКФ ≥45 и <60 мл/мин/1,73 м2
| Показатели | Дапаглифлозин1 10 мг | Плацебо1 |
| N2 | 159 | 161 |
| HbA1c (%) | ||
| Исходный уровень (среднее) | 8,35 | 8,03 |
| Изменение относительно исходного уровня2 | –0,37 | –0,03 |
| Разность относительно плацебо2 | –0,344 | |
| (95% ДИ) | (–0,53, –0,15) | |
| Масса тела, кг | ||
| Исходный уровень (среднее) | 92,51 | 88,30 |
| Изменение, % относительно исходного уровня3 | –3,42 | –2,02 |
| Разность в изменении, % относительно плацебо3 | –1,434 | |
| (95% ДИ) | (–2,15, –0,69) |
1Метформин или метформина гидрохлорид входили в стандартную терапию 69,4 и 64,0% пациентов в группе, получавшей дапаглифлозин в дозе 10 мг, и в группе, получавшей плацебо, соответственно.
2Среднее значение, рассчитанное методом наименьших квадратов, скорректированное относительно исходного уровня.
3Определено на основании среднего значения, рассчитанного методом наименьших квадратов, скорректированного относительно исходного уровня.
4p<0,001.
Пациенты с исходным уровнем HbA1c ≥9%
На основании анализа данных пациентов с исходным уровнем HbA1c ≥9,0% по заранее предусмотренным переменным терапия дапаглифлозином в дозе 10 мг приводила к статистически значимому уменьшению уровня HbA1c через 24 недели применения в качестве монотерапии (скорректированное среднее изменение относительно исходного уровня: –2,04 и 0,19% для дапаглифлозина в дозе 10 мг и плацебо, соответственно) и при добавлении к терапии метформином (скорректированное среднее изменение относительно исходного уровня: –1,32 и –0,53% для дапаглифлозина и плацебо, соответственно).
Сердечно-сосудистые и почечные исходы
Исследование влияния дапаглифлозина на сердечно-сосудистые исходы (DECLARE) — международное многоцентровое рандомизированное двойное слепое плацебо-контролируемое клиническое исследование для определения влияния дапаглифлозина на сердечно-сосудистые исходы при его добавлении к текущей базовой терапии по сравнению с плацебо.
У всех пациентов был СД2 и либо два и более дополнительных факторов риска развития сердечно-сосудистого заболевания (возраст ≥55 лет у мужчин или ≥60 лет у женщин и один или более из следующих факторов: дислипидемия, артериальная гипертензия или табакокурение), либо диагностированное сердечно-сосудистое заболевание.
Из 17160 рандомизированных пациентов у 6974 (40,6%) было диагностировано сердечно-сосудистое заболевание, а у 10186 (59,4%) таковое отсутствовало. В общей сложности 8582 пациента были рандомизированы в группу применения дапаглифлозина в дозе 10 мг, а 8578 пациентов — в группу плацебо; медиана длительности наблюдения составила 4,2 года.
Средний возраст пациентов исследуемой популяции составил 63,9 года, 37,4% пациентов были женского пола. В общей сложности 22,4% пациентов страдали СД2 на протяжении ≤5 лет, средняя продолжительность СД2 составила 11,9 года. Среднее значение уровня HbA1c составляло 8,3%, средний ИМТ — 32,1 кг/м2.
Исходно у 10,0% пациентов в анамнезе отмечалась сердечная недостаточность. Средняя рСКФ составила 85,2 мл/мин/1,73 м2. У 7,4% пациентов рСКФ была менее 60 мл/мин/1,73 м2. У 30,3% пациентов наблюдалась микро- или макроальбуминурия (альбумин-креатининовое соотношение (А/Кр) мочи) ≥ 30 и ≤300 или 300 мг/г соответственно).
Исходно бóльшая часть пациентов (98%) получали один или несколько противодиабетических препаратов, включая метформин (82%), препараты инсулина (41%) и производные сульфонилмочевины (43%).
Первичные конечные точки включали время до развития первого явления комбинированной конечной точки, включавшей смерть по причине сердечно-сосудистой патологии, инфаркт миокарда или ишемический инсульт (основные сердечно-сосудистые события), а также время до развития первого явления комбинированной конечной точки, включавшей госпитализацию по поводу сердечной недостаточности или смерть по причине сердечно-сосудистого заболевания. Вторичные конечные точки включали комбинированную конечную точку почечных исходов и смерть по любой причине.
Основные сердечно-сосудистые события
Дапаглифлозин в дозе 10 мг продемонстрировал не меньшую эффективность по сравнению с плацебо в отношении комбинированной конечной точки, включающей смерть по причине сердечно-сосудистой патологии, инфаркт миокарда или ишемический инсульт (одностороннее значение p<0,001).
ХСН или смерть по причине сердечно-сосудистой патологии
Дапаглифлозин в дозе 10 мг продемонстрировал превосходство по сравнению с плацебо в предотвращении первичной комбинированной конечной точки, включающей госпитализацию по поводу сердечной недостаточности или смерть по причине сердечно-сосудистой патологии (рисунок 1). Различие эффекта терапии было достигнуто за счет госпитализации по поводу сердечной недостаточности без различия в отношении смерти по причине сердечно-сосудистой патологии (рисунок 2).
Преимущество терапии дапаглифлозином по сравнению с плацебо наблюдалось у пациентов с диагностированным сердечно-сосудистым заболеванием и без такового, с исходной сердечной недостаточностью или без таковой, и было сопоставимым в ключевых подгруппах, включая возраст, пол, функцию почек (рСКФ) и регион.
Рисунок 1. Время до первой госпитализации по поводу сердечной недостаточности или смерти по причине сердечно-сосудистой патологии.
«Пациенты группы риска» означает количество пациентов группы риска в начале периода.
ОР — отношение рисков.
Результаты, полученные для первичных и вторичных конечных точек, показаны на рисунке 2. Преимущество терапии дапаглифлозином по сравнению с плацебо в отношении основных сердечно-сосудистых событий показано не было (p=0,172), в связи с чем, согласно методике проведения подтверждающих испытаний, исследования комбинированной конечной точки почечных исходов и смерти по любой причине не выполняли.
Рисунок 2. Эффект лечения в отношении первичных комбинированных конечных точек и их компонентов, а также вторичных конечных точек и их компонентов.
Примечание: комбинированная конечная точка почечных исходов включает: устойчивое подтвержденное снижение рСКФ на ≥40% до рСКФ <60 мл/мин/1,73 м2, и/или терминальную стадию почечной недостаточности (диализ ≥90 дней или трансплантация почки, устойчивый подтвержденный уровень рСКФ <15 мл/мин/1,73 м2), и/или смерть вследствие осложнений со стороны почек или смерть по причине сердечно-сосудистого заболевания. Значения p являются двусторонними.
Значения p для вторичных конечных точек и отдельных компонентов являются номинальными. Время до развития первого явления комбинированной конечной точки анализировали с помощью модели пропорциональных рисков Кокса. Количество первых явлений по отдельным компонентам комбинированной конечной точки является фактическим количеством первых явлений каждого компонента и не суммируется с количеством явлений в комбинированной конечной точке.
Нефропатия
Терапия дапаглифлозином приводила к снижению частоты явлений комбинированной конечной точки, включающей подтвержденное устойчивое снижение рСКФ, терминальную стадию почечной недостаточности, смерть вследствие осложнений со стороны почек или по причине сердечно-сосудистого заболевания. Разница между группами была обусловлена снижением числа явлений компонентов комбинированной конечной точки почечных исходов, включающей устойчивое снижение рСКФ, терминальную стадию почечной недостаточности и смерть вследствие осложнений со стороны почек (рисунок 2). ОР по времени до развития нефропатии (устойчивое снижение рСКФ, терминальная стадия почечной недостаточности или смерть вследствие осложнений со стороны почек) составило 0,53 (95% ДИ: 0,43, 0,66) для дапаглифлозина по сравнению с плацебо.
Также терапия дапаглифлозином снижала риск новых случаев развития стойкой альбуминурии (ОР: 0,79 (95% ДИ: 0,72, 0,87) и приводила к более выраженной регрессии макроальбуминурии (ОР: 1,82 (95% ДИ: 1,51, 2,20) по сравнению с плацебо.
ХСН
Исследование DAPA-HF: ХСН со сниженной фракцией выброса левого желудочка (ФВЛЖ ≤40%)
Исследование дапаглифлозина и предотвращения неблагоприятных исходов при сердечной недостаточности (DAPA-HF) — международное многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование у пациентов с ХСН (II–IV функциональный класс по классификации NYHA) со сниженной ФВЛЖ ≤40% — проводили с целью установить эффективность дапаглифлозина по сравнению с плацебо в отношении снижения риска смерти по причине сердечно-сосудистого заболевания и ухудшения течения сердечной недостаточности при добавлении дапаглифлозина к стандартной терапии.
Из 4744 пациентов 2373 пациента были рандомизированы в группу дапаглифлозина в дозе 10 мг, а 2371 пациент — в группу плацебо; медиана наблюдения составила 18 месяцев. Средний возраст пациентов исследуемой популяции составил 66 лет, 77% пациентов были мужского пола.
Исходно 67,5% пациентов были отнесены к II классу по NYHA, 31,6% — к III классу и 0,9% — к IV классу. Медиана ФВЛЖ составила 32%; в 56% случаев сердечная недостаточность имела ишемическую этиологию, в 36% — неишемическую этиологию и в 8% — неизвестную этиологию. В каждой группе лечения 42% пациентов имели в анамнезе СД2, еще 3% пациентов в каждой группе лечения были отнесены к пациентам с СД2 на основании уровня HbA1c ≥6,5%, зарегистрированного как при включении в исследование, так и при рандомизации. Пациенты получали стандартную терапию: 94% пациентов с СД2 получали терапию ингибиторами АПФ, БРА или ангиотензиновых рецепторов и неприлизина ингибитором (11%), 96% получали бета-адреноблокаторы, 71% — блокаторы минералокортикоидных рецепторов, 93% — диуретики; у 26% пациентов был имплантированный кардиовертер-дефибриллятор.
В исследование были включены пациенты с рСКФ ≥30 мл/мин/1,73 м2 на момент включения. Средняя рСКФ составила 66 мл/мин/1,73 м2. У 41% пациентов рСКФ была менее 60 мл/мин/1,73 м2, у 15% пациентов — менее 45 мл/мин/1,73 м2.
Смерть по причине сердечно-сосудистого заболевания и ухудшение течения ХСН
Дапаглифлозин продемонстрировал превосходство по сравнению с плацебо в предотвращении первичной комбинированной конечной точки, включающей смерть по причине сердечно-сосудистой патологии, госпитализацию по поводу сердечной недостаточности или экстренное обращение за помощью в связи с ухудшением течения сердечной недостаточности (ОР: 0,74 (95% ДИ: 0,65, 0,85); p<0,0001). Эффект наблюдался в самом начале и сохранялся на протяжении всего исследования (рисунок 3).
Рисунок 3. Время до первого достижения комбинированной конечной точки, включающей смерть по причине сердечно-сосудистой патологии, госпитализацию по поводу сердечной недостаточности или экстренное обращение за помощью в связи с ухудшением течения сердечной недостаточности
Примечание: экстренное обращение за помощью в связи с ухудшением течения сердечной недостаточности было определено как срочное, внеплановое обследование врачом, например в отделении неотложной помощи, вызванное ухудшением течения сердечной недостаточности, которое требует лечения (помимо только повышения дозы пероральных диуретиков).
«Пациенты группы риска» означает число пациентов группы риска в начале периода.
Все три компонента первичной комбинированной конечной точки по отдельности вносили вклад в эффект лечения (рисунок 4). Зарегистрировано несколько экстренных обращений за помощью в связи с ухудшением течения сердечной недостаточности.
Рисунок 4. Эффект лечения в отношении первичной комбинированной конечной точки, ее компонентов, а также смерти по любой причине.
Примечание: экстренное обращение за помощью в связи с ухудшением течения сердечной недостаточности было определено как срочное, внеплановое обследование врачом, например в отделении неотложной помощи, вызванное ухудшением течения сердечной недостаточности, которое требует лечения (помимо только повышения дозы пероральных диуретиков).
Количество первых явлений по отдельным компонентам комбинированной конечной точки является фактическим количеством первых явлений каждого компонента и не суммируется с количеством явлений в комбинированной конечной точке.
Частота возникновения явлений представлена как число участников, у которых было зарегистрировано явление компонентов комбинированной конечной точки, на 100 пациенто-лет последующего наблюдения.
Значения p для отдельных компонентов комбинированной конечной точки и смерти по любой причине являются номинальными.
Применение дапаглифлозина также приводило к снижению общего количества случаев госпитализации по поводу сердечной недостаточности (первичной и повторной) и смерти по причине сердечно-сосудистой патологии: 567 случаев в группе дапаглифлозина по сравнению с 742 случаями в группе плацебо (относительная частота: 0,75 (95% ДИ: 0,65–0,88); p=0,0002).
Преимущество терапии дапаглифлозином наблюдалось у пациентов с сердечной недостаточностью с СД2 и без такового. Применение дапаглифлозина приводило к снижению частоты первичной комбинированной конечной точки, включающей смерть по причине сердечно-сосудистой патологии, госпитализацию по поводу сердечной недостаточности или экстренное обращение за помощью в связи с ухудшением течения сердечной недостаточности у пациентов с СД2 (ОР: 0,75 (95% ДИ: 0,63, 0,90) и без такового (ОР: 0,73 (95% ДИ: 0,60, 0,88).
Преимущество терапии дапаглифлозином по сравнению с плацебо в отношении первичной конечной точки было сопоставимым в других ключевых подгруппах, включая сопутствующую терапию сердечной недостаточности, функцию почек (рСКФ), возраст, пол и регион.
Исход, сообщаемый пациентами: симптомы ХСН
Эффект лечения дапаглифлозином в отношении симптомов сердечной недостаточности оценивали с помощью общего показателя симптомов по Канзасскому опроснику для больных кардиомиопатией (KCCQ-TSS), который позволяет проводить количественную оценку частоты и тяжести симптомов сердечной недостаточности, включая утомляемость, периферические отеки, одышку и ортопноэ. Значения показателя варьируют от 0 до 100, причем более высокий балл соответствует лучшему состоянию здоровья.
Терапия дапаглифлозином приводила к статистически значимому и клинически значимому преимуществу по сравнению с плацебо в отношении симптомов сердечной недостаточности, оцениваемых по изменению KCCQ-TSS через 8 месяцев от исходного уровня (вероятность преимущества: 1,18 (95% ДИ: 1,11, 1,26); р<0,0001). Частота и тяжесть симптомов внесли вклад в результат, полученный по эффективности терапии. Преимущество наблюдалось как в улучшении симптомов сердечной недостаточности, так и в предотвращении ухудшения симптомов сердечной недостаточности.
При анализе данных респондентов доля пациентов с клинически значимым улучшением KCCQ-TSS через 8 месяцев по сравнению с исходным уровнем (которое определялось как 5 и более баллов) была выше в группе лечения дапаглифлозином по сравнению с группой, получавшей плацебо. Доля пациентов с клинически значимым ухудшением (которое определялось как 5 и более баллов) была ниже в группе лечения дапаглифлозином по сравнению с группой, получавшей плацебо. Преимущества терапии дапаглифлозином сохранялись при применении более жестких пороговых значений для больших клинически значимых изменений (таблица 9).
Таблица 9
Количество и доля пациентов с клинически значимым улучшением или ухудшением общего показателя симптомов по Канзасскому опроснику для больных кардиомиопатией (KCCQ-TSS) через 8 месяцев
| Изменение относительно исходного уровня через 8 месяцев | Дапаглифлозин 10 мг n1=2086 |
Плацебо n1=2062 |
Показатели | |
| Улучшение | n (%) с улучшением2 | n (%) с улучшением2 | Отношение шансов3 (95%ДИ) | Значение p6 |
| ≥5 баллов | 933 (44,7) | 794 (38,5) | 1,14 (1,06, 1,22) | 0,0002 |
| ≥10 баллов | 689 (33,0) | 579 (28,1) | 1,13 (1,05, 1,22) | 0,0018 |
| ≥15 баллов | 474 (22,7) | 406 (19,7) | 1,10 (1,01, 1,19) | 0,0300 |
| Ухудшение | n (%) с ухудшением4 | n (%) с ухудшением4 | Отношение шансов5 (95%ДИ) | Значение p6 |
| ≥5 баллов | 537 (25,7) | 693 (33,6) | 0,84 (0,78, 0,89) | <0,0001 |
| ≥10 баллов | 395 (18,9) | 506 (24,5) | 0,85 (0,79, 0,92) | <0,0001 |
Примечание:
1Число пациентов с зарегистрированным значением KCCQ-TSS или пациентов со смертельным исходом до окончания 8 месяцев лечения.
2Число пациентов, у которых наблюдалось улучшение не менее чем на 5, 10 или 15 баллов по сравнению с исходным уровнем. Значения для пациентов со смертельным исходом до окончания указанного периода времени соответствуют отсутствию улучшения.
3При улучшении отношение шансов >1 означает преимущество терапии дапаглифлозином в дозе 10 мг.
4Число пациентов, у которых наблюдалось ухудшение не менее чем на 5 или 10 баллов по сравнению с исходным уровнем. Значения для пациентов со смертельным исходом до окончания указанного периода времени соответствуют ухудшению.
5При ухудшении отношение шансов <1 означает преимущество терапии дапаглифлозином в дозе 10 мг.
6Значения p являются номинальными.
Нефропатия
Было зарегистрировано несколько явлений компонентов комбинированной конечной точки почечных исходов (подтвержденное устойчивое снижение рСКФ ≥50%, терминальная стадия почечной недостаточности или смерть вследствие осложнений со стороны почек); частота явлений составила 1,2% в группе, получавшей дапаглифлозин, и 1,6% в группе, получавшей плацебо.
Исследование DELIVER: ХСН с ФВЛЖ >40%
Оценка дапаглифлозина для улучшения качества жизни пациентов с ХСН с сохраненной фракцией выброса (DELIVER) — международное многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование у пациентов в возрасте ≥40 лет с ХСН (класс II–IV по NYHA) с ФВЛЖ >40% и признаками структурного заболевания сердца, которое провели для определения влияния дапаглифлозина по сравнению с плацебо на частоту случаев смерти по причине сердечно-сосудистой патологии и ухудшение течения сердечной недостаточности.
Из 6263 пациентов 3131 пациент был рандомизирован в группу дапаглифлозина 10 мг, а 3132 пациента — в группу плацебо; медиана продолжительности наблюдения составила 28 месяцев. В исследование включили 654 (10%) пациента с подострой сердечной недостаточностью (т.е. рандомизированных во время госпитализации по поводу сердечной недостаточности или в течение 30 дней после выписки из стационара). Средний возраст пациентов исследуемой популяции составил 72 года, 56% пациентов были мужского пола.
Исходно 75% пациентов были отнесены к II классу по NYHA, 24% — к III классу и 0,3% — к IV классу. Медиана ФВЛЖ составила 54%. У 34% пациентов ФВЛЖ составила ≤49%, у 36% — 50–59% и у 30% — ≥60%. В каждой группе лечения у 45% пациентов в анамнезе был СД2. Базовая терапия включала ингибиторы АПФ/БРА/ангиотензиновых рецепторов и неприлизина ингибитор, бета-адреноблокаторы (83%), диуретики (98%) и блокаторы минералокортикоидных рецепторов (43%).
Средняя рСКФ составила 61 мл/мин/1,73 м2. У 49% пациентов рСКФ составила <60 мл/мин/1,73 м2, у 23% — <45 мл/мин/1,73 м2 и у 3% — <30 мл/мин/1,73 м2.
Дапаглифлозин продемонстрировал превосходство по сравнению с плацебо в снижении частоты достижения комбинированной конечной точки, включающей смерть по причине сердечно-сосудистого заболевания, госпитализацию по поводу сердечной недостаточности или экстренное обращение за помощью в связи с ухудшением течения сердечной недостаточности (ОР: 0,82 (95% ДИ: 0,73, 0,92); p=0,0008) (рисунок 5).
Рисунок 5. Время до первого достижения комбинированной конечной точки, включающей смерть по причине сердечно-сосудистой патологии, госпитализацию по поводу сердечной недостаточности или экстренное обращение за помощью в связи с ухудшением течения сердечной недостаточности.
Примечание: экстренное обращение за помощью в связи с ухудшением течения сердечной недостаточности было определено как срочное, внеплановое обследование врачом, например в отделении неотложной помощи, вызванное ухудшением течения сердечной недостаточности, которое требует лечения (помимо только повышения дозы пероральных диуретиков).
«Пациенты группы риска» означает количество пациентов группы риска в начале периода.
На рисунке 6 представлен вклад трех компонентов первичной комбинированной конечной точки в эффект лечения.
Рисунок 6. Эффект лечения в отношении первичной комбинированной конечной точки и ее компонентов.
Примечание: экстренное обращение за помощью в связи с ухудшением течения сердечной недостаточности было определено как срочное, внеплановое обследование врачом, например в отделении неотложной помощи, вызванное ухудшением течения сердечной недостаточности, которое требует лечения (помимо только повышения дозы пероральных диуретиков).
Количество первых явлений по отдельным компонентам комбинированной конечной точки является фактическим количеством первых явлений каждого компонента и не суммируется с количеством явлений в комбинированной конечной точке.
Частота возникновения явлений представлена как число участников, у которых было зарегистрировано явление компонентов комбинированной конечной точки, на 100 пациенто-лет последующего наблюдения.
Анализ смерти по причине сердечно-сосудистого заболевания, представленной здесь в качестве компонента первичной конечной точки, также провели при формальном контроле ошибок первого рода, где она выступала в качестве вторичной конечной точки.
Дапаглифлозин продемонстрировал превосходство по сравнению с плацебо в снижении общего числа событий сердечной недостаточности (определяемого как первичная и повторная госпитализация по поводу сердечной недостатовчности или экстренные обращения за помощью в связи с ухудшением течения сердечной недостаточности) и смерти по причине сердечно-сосудистого заболевания: 815 случаев в группе, получавшей дапаглифлозин, по сравнению с 1057 случаями в группе, получавшей плацебо (относительная частота: 0,77 (95% ДИ: 0,67, 0,89); p=0,0003).
Преимущество терапии дапаглифлозином по сравнению с плацебо в отношении первичной конечной точки наблюдалось в подгруппах пациентов с ФВЛЖ ≤49%, 50–59% и ≥60%.
Эффект терапии также был сопоставим в других ключевых подгруппах, классифицированных, например, по возрасту, полу, классу NYHA, уровню NT-proBNP, подострого статуса сердечной недостаточности и наличию СД2.
Исход, сообщаемый пациентами: симптомы ХСН
Терапия дапаглифлозином приводила к статистически значимому преимуществу по сравнению с плацебо в отношении симптомов сердечной недостаточности, оцениваемых по изменению через 8 месяцев от исходного уровня KCCQ-TSS (вероятность преимущества: 1,11 (95% ДИ: 1,03, 1,21); p=0,0086). Частота и тяжесть симптомов внесли вклад в результат, полученный по эффективности терапии.
При анализе респондентов доля пациентов со средним (≥5 баллов) или сильным (≥14 баллов) ухудшением значения KCCQ-TSS через 8 месяцев по сравнению с исходным уровнем была ниже в группе лечения дапаглифлозином: среднее ухудшение наблюдалось у 24,1% пациентов, принимавших дапаглифлозин, по сравнению с 29,1% пациентов, принимавших плацебо (отношение шансов: 0,78 (95% ДИ: 0,64, 0,95); сильное ухудшение наблюдалось у 13,5% пациентов, принимавших дапаглифлозин, по сравнению с 18,4% пациентов, принимавших плацебо (отношение шансов: 0,70 (95% ДИ: 0,55, 0,88). Доля пациентов со слабым или средним улучшением (≥13 баллов) или сильным улучшением (≥17 баллов) не отличалась между группами лечения.
ХСН в исследованиях DAPA-HF и DELIVER
В анализе объединенных данных исследований DAPA-HF и DELIVER отношение рисков для дапаглифлозина по сравнению с плацебо в отношении комбинированной конечной точки, включающей смерть по причине сердечно-сосудистой патологии, госпитализацию по поводу сердечной недостаточности или экстренное обращение за помощью в связи с ухудшением течения сердечной недостаточности, составило 0,78 (95% ДИ: 0,72, 0,85), p<0,0001. Эффект лечения был сопоставим для всего диапазона значений ФВЛЖ без ослабления эффекта в зависимости от значения ФВЛЖ.
На основании анализа объединенных данных исследований DAPA-HF и DELIVER по заранее предусмотренным переменным на уровне пациентов применение дапаглифлозина приводило к снижению риска смерти по причине сердечно-сосудистой патологии по сравнению с плацебо (ОР: 0,85 (95% ДИ: 0,75, 0,96), p=0,0115). Положительный эффект лечения был продемонстрирован в обоих исследованиях.
Хроническая болезнь почек
Исследование по оценке влияния дапаглифлозина на почечные исходы и смертность от сердечно-сосудистых заболеваний у пациентов с хронической болезнью почек (DAPA-CKD) — международное многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование у пациентов с хронической болезнью почек с рСКФ ≥25 и ≤75 мл/мин/1,73 м2 и альбуминурией (А/Кр мочи) ≥200 и ≤5000 мг/г) — проводили для определения влияния, которое оказывает дапаглифлозин по сравнению с плацебо при добавлении к стандартной базовой терапии на частоту достижения комбинированной конечной точки, включающей устойчивое снижение рСКФ на ≥50%, терминальную стадию почечной недостаточности (определяемую как стойкое значение рСКФ 15 мл/мин/1,73 м2, долгосрочное лечение диализом или трансплантация почки), смерть по причине сердечно-сосудистого заболевания или вследствие осложнений со стороны почек.
Из 4304 пациентов 2152 пациента были рандомизированы в группу дапаглифлозина 10 мг, а 2152 пациента — в группу плацебо; медиана периода наблюдения составила 28,5 месяца. Лечение продолжали, если во время исследования значение рСКФ снижалось до уровня ниже 25 мл/мин/1,73 м2, и могли продолжать в случаях, когда был необходим диализ. Средний возраст пациентов исследуемой популяции составил 61,8 года, 66,9% пациентов были мужского пола. Исходно среднее значение рСКФ составило 43,1 мл/мин/1,73 м2, а медиана А/Кр мочи — 949,3 мг/г. У 44,1% пациентов значение рСКФ составляло от 30 до <45 мл/мин/1,73 м2, у 14,5% пациентов — <30 мл/мин/1,73 м2. У 67,5% пациентов был СД2. Пациенты получали стандартную терапию; 97,0% пациентов получали ингибиторы АПФ или БРА.
На основании рекомендации Независимого комитета по мониторингу данных, исследование завершили досрочно по причине выявления эффективности лечения, установленной до проведения запланированного анализа. Дапаглифлозин продемонстрировал превосходство по сравнению с плацебо в предотвращении первичной комбинированной конечной точки, включающей устойчивое снижение рСКФ на ≥50%, терминальную стадию почечной недостаточности, смерть по причине сердечно-сосудистого заболевания или вследствие осложнений со стороны почек. На основании графика, построенного с помощью метода Каплана–Мейера для времени до первого достижения комбинированной конечной точки, эффект терапии был продемонстрирован начиная с 4 месяцев лечения и сохранялся до конца исследования (рисунок 7).
Рисунок 7. Время до первого достижения комбинированной конечной точки, включающей устойчивое снижение рСКФ на ≥50%, терминальную стадию почечной недостаточности, смерть по причине сердечно-сосудистого заболевания или смерть вследствие осложнений со стороны почек.
Все четыре компонента первичной комбинированной конечной точки по отдельности вносили вклад в эффект лечения. Терапия дапаглифлозином также приводила к снижению частоты явлений комбинированной конечной точки, включающей устойчивое снижение рСКФ на ≥50%, терминальную стадию почечной недостаточности, смерть вследствие осложнений со стороны почек, а также частоты явлений комбинированной конечной точки, включающей смерть по причине сердечно-сосудистого заболевания и госпитализацию по поводу сердечной недостаточности. Лечение дапаглифлозином привело к улучшению общей выживаемости у пациентов с хронической болезнью почек и статистически значимому снижению смерти по любой причине (рисунок 8).
Рисунок 8. Эффект лечения в отношении первичной и вторичных комбинированных конечных точек, их отдельных компонентов, а также смерти по любой причине.
Примечание: количество первых явлений по отдельным компонентам комбинированной конечной точки является фактическим количеством первых явлений каждого компонента и не суммируется с количеством явлений в комбинированной конечной точке.
Частота возникновения явлений представлена как число участников, у которых было зарегистрировано явление компонентов комбинированной конечной точки, на 100 пациенто-лет последующего наблюдения. Оценки отношения рисков не представлены для подгрупп с общим числом явлений, составляющим менее 15 в обеих группах исследования.
Преимущество терапии дапаглифлозином было сопоставимым у пациентов с хронической болезнью почек с СД2 и без такового. Применение дапаглифлозина приводило к снижению частоты достижения первичной комбинированной конечной точки, включающей устойчивое снижение рСКФ на ≥50%, терминальную стадию почечной недостаточности, смерть по причине сердечно-сосудистой патологии или вследствие осложнений со стороны почек: отношение рисков — 0,64 (95% ДИ: 0,52, 0,79) для пациентов с СД2 и 0,50 (95% ДИ: 0,35, 0,72) для больных без СД2. Преимущество терапии дапаглифлозином по сравнению с плацебо в отношении первичной конечной точки было сопоставимым в других ключевых подгруппах, включая рСКФ, возраст, пол и регион.
Дети
СД2. В клиническом исследовании у детей и подростков в возрасте от 10 до 24 лет с СД2 39 пациентов были рандомизированы в группу дапаглифлозина в дозе 10 мг, а 33 пациента — в группу плацебо в качестве комбинированной терапии с метформином, инсулином или с комбинацией метформина и инсулина. На момент рандомизации 74% пациентов были младше 18 лет.
Скорректированное среднее изменение уровня HbA1c от исходного уровня до 24 недели при применении дапаглифлозина по сравнению с плацебо составило –0,75 % (95% ДИ: –1,65, 0,15). В возрастной группе младше 18 лет скорректированное среднее изменение уровня HbA1c при применении дапаглифлозина по сравнению с плацебо составило –0,59% (95% ДИ: –1,66, 0,48). В возрастной группе от 18 лет и старше среднее изменение уровня HbA1c относительно исходного уровня составило –1,52% в группе, получавшей дапаглифлозин (n=9), и 0,17% в группе, получавшей плацебо (n=6). Эффективность и безопасность были аналогичны соответствующим показателям, наблюдаемым у взрослых пациентов, получающих дапаглифлозин. Дальнейшее подтверждение безопасности и переносимости было получено в дополнительном периоде исследования, предназначенном для оценки безопасности, продолжительностью 28 недель (см. «Способ применения и дозы»).
Фармакокинетика
Абсорбция. После приема внутрь дапаглифлозин быстро и полностью всасывается в желудочно-кишечном тракте (ЖКТ) и может приниматься как во время приема пищи, так и вне его. Сmах дапаглифлозина в плазме крови обычно достигается в течение 2 часов после приема натощак. Средние геометрические значения Cmax и AUC для дапаглифлозина в равновесном состоянии после приема дапаглифлозина в дозе 10 мг один раз в сутки составляли 158 нг/мл и 628 нг·ч/мл соответственно. Абсолютная биодоступность дапаглифлозина при приеме внутрь в дозе 10 мг составляет 78%. Прием пищи с высоким содержанием жиров снижал Сmax дапаглифлозина на 50%, удлинял Тmax (время достижения Сmax в плазме) примерно на 1 час, но не влиял на AUC по сравнению с приемом натощак. Эти изменения не являются клинически значимыми. Препарат Форсига может приниматься как во время приема пищи, так и вне его.
Распределение. Дапаглифлозин примерно на 91% связывается с белками, у пациентов с различными заболеваниями, например нарушениями функции почек или печени, этот показатель не изменялся. Средний объем распределения дапаглифлозина в равновесном состоянии составил 118 л.
Биотрансформация. Дапаглифлозин метаболизируется с образованием главным образом неактивного метаболита дапаглифлозин-3-О-глюкуронида. Дапаглифлозин-3-О-глюкуронид и другие метаболиты не оказывают гипогликемического действия. Дапаглифлозин-3-О-глюкуронид формируется под действием фермента уридиндифосфат-глюкуронозилтрансферазы 1A9 (UGT1A9), присутствующего в печени и почках, изоферменты цитохрома CYP вовлечены в метаболизм в меньшей степени.
Элиминация. Средний T1/2 из плазмы крови у здоровых добровольцев составлял 12,9 часа после однократного приема дапаглифлозина внутрь в дозе 10 мг. Средний общий системный клиренс дапаглифлозина при внутривенном введении составлял 207 мл/мин. Дапаглифлозин и его метаболиты выводятся преимущественно почками, и только менее 2% выводится в неизмененном виде. После приема 50 мг 14C-дапаглифлозина было обнаружено 96% радиоактивности — 75% в моче и 21% — в фекалиях. Примерно 15% радиоактивности, обнаруженной в фекалиях, приходилось на неизмененный дапаглифлозин.
Линейность. Экспозиция дапаглифлозина увеличивалась пропорционально увеличению дозы в диапазоне от 0,1 до 500 мг, а фармакокинетические свойства дапаглифлозина не изменялись с течением времени при многократном ежедневном приеме в течение до 24 недель.
Фармакокинетическая-фармакодинамическая зависимость
Почечная недостаточность. В равновесном состоянии (среднее значение AUC) системная экспозиция дапаглифлозина у пациентов с СД2 и почечной недостаточностью легкой, средней или тяжелой степени (определяемой по клиренсу йогексола) была на 32, 60 и 87% выше, чем у больных с СД2 и нормальной функцией почек, соответственно.
Количество глюкозы, выводимой почками в течение суток при приеме дапаглифлозина в равновесном состоянии, зависело от состояния функции почек. У пациентов с СД2 и нормальной функцией почек и с почечной недостаточностью легкой, средней или тяжелой степени в сутки выводилось 85, 52, 18 и 11 г глюкозы соответственно. Не выявлены различия в связывании дапаглифлозина с белками у здоровых добровольцев и пациентов с почечной недостаточностью различной степени тяжести. Неизвестно, оказывает ли гемодиализ влияние на экспозицию дапаглифлозина. Влияние снижения функции почек на системную экспозицию препарата оценивали на популяционной фармакокинетической модели. Спрогнозированная моделью AUC была выше у пациентов с хронической болезнью почек по сравнению с пациентами с нормальной функцией почек и существенно не различалась у пациентов с хронической болезнью почек с СД2 или без него, что согласуется с ранее полученными данными.
Печеночная недостаточность. У пациентов с печеночной недостаточностью легкой или средней степени тяжести (классы А и В по Чайлд-Пью) средние значения Сmax и AUC дапаглифлозина были соответственно на 12 и 36% выше по сравнению со здоровыми добровольцами. Данные различия не являются клинически значимыми, поэтому корректировки дозы дапаглифлозина при печеночной недостаточности легкой и средней степени тяжести не требуется (см. «Способ применения и дозы»). У пациентов с печеночной недостаточностью тяжелой степени (класс С по Чайлд-Пью) средние значения Сmax и AUC дапаглифлозина были на 40 и 67% выше, соответственно по сравнению со здоровыми добровольцами.
Лица пожилого возраста (≥65 лет). Не отмечалось клинически значимого увеличения экспозиции у пациентов в возрасте до 70 лет (если не учитывать другие факторы, помимо возраста). Тем не менее можно ожидать увеличения экспозиции за счет снижения функции почек, связанного с возрастом. Данные об экспозиции у пациентов в возрасте старше 70 лет недостаточны.
Пол. У женщин среднее значение AUC в равновесном состоянии на 22% превышает аналогичный показатель у мужчин.
Расовая принадлежность. Клинически значимых различий системной экспозиции у представителей европеоидной, негроидной и монголоидной рас не выявлено.
Масса тела. Отмечены более низкие значения экспозиции при повышенной массе тела. Поэтому у пациентов с низкой массой тела может отмечаться некоторое повышение экспозиции, а у пациентов с повышенной массой тела — снижение экспозиции дапаглифлозина. Однако данные различия не являются клинически значимыми.
Дети. Фармакокинетика и фармакодинамика (глюкозурия) при применении у детей с СД2 от 10 до 17 лет были аналогичны соответствующим показателям, наблюдаемым у взрослых пациентов с СД2.
Данные доклинической безопасности
На основании данных, полученных в традиционных доклинических исследованиях (таких как исследования фармакологической безопасности, исследования токсичности при многократном введении, исследования генотоксичности, канцерогенного потенциала и исследования репродуктивной токсичности), особых рисков для человека выявлено не было. В исследовании канцерогенности продолжительностью 2 года было показано, что дапаглифлозин не вызывает развития опухолей ни у мышей, ни у крыс при применении ни в одной из исследуемых доз.
Репродуктивная и онтогенетическая токсичность. Прямое применение дапаглифлозина у молодых крыс-отъемышей и непрямое воздействие на поздних сроках беременности (периоды времени, соответствующие II и III триместрам беременности у женщин с точки зрения внутриутробного развития почек) и в период лактации связаны с повышенной частотой и/или тяжелой степенью расширения почечных лоханок и почечных канальцев у потомства.
В исследовании токсичности на неполовозрелых животных при непосредственном применении дапаглифлозина у молодых крыс в возрасте от 21 до 90 дней о расширении почечных лоханок и почечных канальцев сообщалось при применении всех уровней доз; экспозиция у потомства при самой низкой испытуемой дозе превышала максимальную рекомендуемую дозу для человека в ≥15 раз. Также при применении всех уровней доз наблюдали дозозависимое увеличение массы почек и макроскопические признаки гипертрофии почек. Расширение почечных лоханок и почечных канальцев, наблюдаемое у молодых животных, не было полностью обратимым в течение периода восстановления, составлявшего приблизительно 1 месяц.
В отдельном исследовании пренатального и постнатального развития препарат применяли у беременных самок крыс в период с 6-го дня гестации до 21-го дня постнатального периода, таким образом потомство подвергали влиянию препарата как внутриутробно, так и во время лактации (оценку экспозиции дапаглифлозина в молоке и у потомства проводили в рамках дополнительного исследования). Отмечалось увеличение частоты и тяжести расширения почечных лоханок у взрослого потомства самок, получавших препарат, но только в самой высокой испытуемой дозе (соответствующие экспозиции дапаглифлозина у самок и потомства превышали экспозицию, наблюдаемую у человека при применении максимальной рекомендуемой дозы для человека, соответственно в 1415 и 137 раз).
Дополнительные признаки онтогенетической токсичности ограничивались снижением массы тела потомства и наблюдались только при применении доз ≥15 мг/кг/сутки (что соответствовало экспозиции у потомства, в ≥29 раз превышающей экспозицию, наблюдаемую у человека при применении препарата в максимальной рекомендуемой дозе). Появление признаков токсичности для материнского организма отмечалось только при самой высокой испытуемой дозе и ограничивалось временным снижением массы тела и потребления пищи. Максимальная доза, не приводящая к развитию наблюдаемых нежелательных эффектов (NOAEL) в отношении онтогенетической токсичности (наименьшая испытуемая доза), соответствует кратной системной экспозиции у самок, приблизительно в 19 раз превышающей экспозицию, наблюдаемую у человека при применении максимальной рекомендуемой дозы для человека.
В дополнительных исследованиях эмбриофетального развития на крысах и кроликах дапаглифлозин применяли с интервалами, совпадающими с основными периодами органогенеза у каждого вида. Ни при одной из испытуемых доз у кроликов не наблюдалось признаков токсичности для материнского организма или признаков онтогенетической токсичности; наибольшая испытуемая доза соответствует кратной системной экспозиции, приблизительно в 1191 раз превышающей максимальную рекомендуемую дозу для человека. При применении у крыс дапаглифлозин не вызывал эмбриолетального и тератогенного действия при экспозиции, до 1441 раза превышающей максимальную рекомендуемую дозу для человека.
Показания
- сахарный диабет типа 2 у взрослых пациентов в дополнение к диете и физическим упражнениям для улучшения гликемического контроля в качестве:
— монотерапии, когда применение метформина невозможно ввиду непереносимости;
— комбинированной терапии с метформином, производными сульфонилмочевины (в т.ч. в комбинации с метформином), тиазолидиндионами, ингибиторами дипептидилпептидазы-4 (ДПП-4) (в т.ч. в комбинации с метформином); агонистом рецепторов глюкагоноподобного полипептида-1 (ГПП-1) эксенатидом пролонгированного действия в комбинации с метформином; препаратами инсулина (в т.ч. в комбинации с одним или двумя гипогликемическими препаратами для перорального применения) при отсутствии адекватного гликемического контроля на данной терапии;
— стартовой комбинированной терапии с метформином, при целесообразности данной терапии;
- сахарный диабет типа 2 у взрослых пациентов с установленным диагнозом сердечно-сосудистого заболевания или двумя и более факторами сердечно-сосудистого риска* для снижения риска госпитализации по поводу сердечной недостаточности;
- симптоматическая хроническая сердечная недостаточность;
- хроническая болезнь почек с риском ее прогрессирования для уменьшения риска устойчивого снижения расчетной скорости клубочковой фильтрации (рСКФ), наступления терминальной стадии хронической почечной недостаточности, смерти от сердечно-сосудистого заболевания и госпитализации по поводу сердечной недостаточности.
*Возраст у мужчин ≥55 лет или ≥ 60 лет у женщин и наличие не менее одного фактора риска (дислипидемия, артериальная гипертензия, курение).
Противопоказания
Гиперчувствительность к дапаглифлозину и/или любому из вспомогательных веществ в составе препарата (см. «Состав»).
Применение при беременности и кормлении грудью. Влияние на фертильность
Беременность. Отсутствуют данные о применении дапаглифлозина у беременных женщин. В доклинических исследованиях на крысах была выявлена токсичность для развивающейся почки в период времени, соответствующий II и III триместрам беременности женщины (см. Данные доклинической безопасности). Поэтому применение дапаглифлозина не рекомендуется во II и III триместрах беременности. При подтверждении беременности лечение дапаглифлозином следует прекратить.
Лактация. Неизвестно, выделяется ли дапаглифлозин и/или его неактивные метаболиты в грудное молоко. Доступные фармакодинамические/токсикологические исследования на животных показали, что дапаглифлозин/его метаболиты выделяются в молоко, а также имеют фармакологически опосредованные эффекты у вскармливаемого потомства (см. Данные доклинической безопасности). В связи с чем риск для новорожденных/младенцев не может быть исключен. Дапаглифлозин не следует применять в период грудного вскармливания.
Фертильность. Влияние дапаглифлозина на фертильность у человека не изучалось. У самцов и самок крыс дапаглифлозин не оказывал влияния на фертильность.
Способ применения и дозы
Внутрь, независимо от приема пищи, не разжевывая.
Перед началом терапии препаратом Форсига следует оценить состояние водно-солевого обмена и при необходимости восполнить объем циркулирующей крови (ОЦК).
СД2
Монотерапия: рекомендуемая доза препарата Форсига составляет 10 мг 1 раз в сутки.
Комбинированная терапия: рекомендуемая доза препарата Форсига составляет 10 мг 1 раз в сутки в комбинации с метформином, производными сульфонилмочевины (в т.ч. в комбинации с метформином), тиазолидиндионами, ингибиторами ДПП-4 (в т.ч. в комбинации с метформином); агонистом рецепторов ГПП-1 — эксенатидом пролонгированного действия, в комбинации с метформином; препаратами инсулина (в т.ч. в комбинации с одним или двумя гипогликемическими препаратами для перорального применения).
Для снижения риска гипогликемии при назначении препарата Форсига в сочетании с препаратами инсулина или препаратами, стимулирующими секрецию инсулина (например, с производным сульфонилмочевины), может потребоваться снижение дозы препаратов инсулина или препаратов, стимулирующих секрецию инсулина (см. «Взаимодействие», «Побочные действия»).
Стартовая комбинированная терапия с метформином: рекомендуемая доза препарата Форсига составляет 10 мг 1 раз в сутки, доза метформина — 500 мг 1 раз в сутки. В случае неадекватного гликемического контроля дозу метформина следует увеличить.
СД2 у взрослых пациентов с установленным диагнозом сердечно-сосудистого заболевания или двумя и более факторами сердечно-сосудистого риска для снижения риска госпитализации по поводу сердечной недостаточности: рекомендуемая доза препарата Форсига составляет 10 мг 1 раз в сутки.
ХСН. Рекомендуемая доза препарата Форсига составляет 10 мг один раз в сутки.
Хроническая болезнь почек. Рекомендуемая доза препарата Форсига составляет 10 мг один раз в сутки
Особые группы пациентов
Нарушение функции почек. Коррекции дозы в зависимости от функции почек не требуется. Из-за ограниченного опыта применения не рекомендуется начинать лечение препаратом у пациентов с рСКФ <25 мл/мин. Гипогликемическое действие дапаглифлозина у пациентов с СД2 зависит от функции почек и снижается у пациентов с рСКФ менее 45 мл/мин/1,73м2 и вероятно, отсутствует у пациентов с тяжелой почечной недостаточностью. В том случае, если необходим дальнейший контроль гликемии у пациентов с СД2 при падении рСКФ ниже 45 мл/мин, необходимо назначить дополнительную гипогликемическую терапию (см. «Особые указания», «Побочные реакции», «Фармакодинамика», «Фармакокинетика»).
Таблица 10
Рекомендации по дозированию препарата в зависимости от показателей рСКФ
| рСКФ, мл/мин/1,73 м2 | Рекомендуемая доза |
| 45 или выше | Коррекции дозы не требуется |
| Менее 45 до 25 | Коррекции дозы не требуется. Применение препарата Форсига не рекомендуется для улучшения гликемического контроля у взрослых пациентов с СД2 |
| Менее 25 | Начинать терапию не рекомендуется. Однако пациенты могут продолжать терапию для уменьшения риска снижения рСКФ, наступления терминальной стадии хронической почечной недостаточности, смерти от сердечно-сосудистого заболевания и госпитализации по поводу сердечной недостаточности |
| Терминальная стадия хронической почечной недостаточности, требующая проведения диализа | Противопоказано |
Нарушение функции печени. Коррекция дозы препарата у пациентов с печеночной недостаточностью легкой или средней степени тяжести не требуется. Пациентам с печеночной недостаточностью тяжелой степени рекомендуется начальная доза препарата 5 мг. При хорошей переносимости доза может быть увеличена до 10 мг (см. «Особые указания», «Фармакокинетика»).
Пациенты пожилого возраста. Коррекция дозы препарата в зависимости от возраста не рекомендуется.
Дети. Имеющиеся на сегодняшний день клинические данные приведены в разделах «Фармакодинамика», «Фармакокинетика», однако невозможно дать рекомендации по режиму дозирования.
Побочные действия
Реклама: ООО «РЛС-Патент», ИНН 5044031277
Резюме профиля безопасности
СД2. В клинических исследованиях более 15000 пациентов с СД2 получали терапию дапаглифлозином. Первичная оценка безопасности и переносимости была проведена в предварительно заданном объединенном анализе 13 краткосрочных (до 24 недель) плацебо-контролируемых исследований с участием 2360 пациентов, получавших дапаглифлозин в дозе 10 мг, и 2295 пациентов, получавших плацебо. В исследовании сердечно-сосудистых исходов дапаглифлозина при СД2 (исследование DECLARE, см. «Фармакодинамика») 8574 пациента получали дапаглифлозин в дозе 10 мг, и 8569 пациентов получали плацебо при средней продолжительности терапии 48 месяцев. В целом средняя экспозиция дапаглифлозина составила 30623 пациенто-года. Наиболее частыми нежелательными реакциями, отмеченными в клинических исследованиях, были генитальные инфекции.
ХСН. В исследовании сердечно-сосудистых исходов при применении дапаглифлозина у пациентов с ХСН со сниженной фракцией выброса (исследование DAPA-HF) 2368 пациентов получали дапаглифлозин в дозе 10 мг, и 2368 пациентов получали плацебо при средней продолжительности терапии 18 месяцев. В исследуемую популяцию вошли пациенты с СД2 и пациенты без диабета, а также пациенты с рСКФ ≥30 мл/мин/1,73 м2. В исследовании сердечно-сосудистых исходов при применении дапаглифлозина у пациентов с ХСН с ФВЛЖ >40% (DELIVER) 3126 пациентов получали дапаглифлозин в дозе 10 мг, и 3127 пациентов получали плацебо при средней продолжительности терапии 27 месяцев. В популяцию пациентов входили пациенты с СД2 и без диабета, а также пациенты с рСКФ ≥25 мл/мин/1,73 м2.
Общий профиль безопасности дапаглифлозина у пациентов с ХСН соответствовал известному профилю безопасности дапаглифлозина.
Хроническая болезнь почек. В исследовании по оценке эффективности дапаглифлозина в отношении почечных исходов у пациентов с хронической болезнью почек (DAPA-CKD) 2149 пациентов получали дапаглифлозин в дозе 10 мг, и 2149 пациентов получали плацебо при средней продолжительности терапии 27 месяцев. В исследуемую популяцию входили пациенты с СД2, без СД2, с рСКФ ≥25 и ≤75 мл/мин/1,73 м2 и альбуминурией (А/Кр мочи ≥200 и ≤5000 мг/г). Лечение продолжали, если рСКФ снижалась менее 25 мл/мин/1,73 м2.
Общий профиль безопасности дапаглифлозина у пациентов с хронической болезнью почек соответствовал известному профилю безопасности дапаглифлозина.
Резюме нежелательных реакций
Нежелательные реакции, отмеченные в плацебо-контролируемых исследованиях1 дапаглифлозина и при пострегистрационном наблюдении, приведены далее. Нежелательные реакции не были дозозависимыми. Нежелательные реакции распределены по системно-органным классам с указанием частоты их возникновения: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000) и неуточненной частоты (невозможно оценить на основании имеющихся данных).
Инфекционные и паразитарные заболевания: часто* — вульвовагинит, баланит и связанные с ними генитальные инфекции*,2,3, инфекция мочевыводящих путей*,2,4; нечасто** — вульвовагинальный зуд, грибковые инфекционные заболевания**; очень редко — некротизирующий фасциит промежности (гангрена Фурнье)2,9.
Нарушения метаболизма и питания: очень часто — гипогликемия (при применении в комбинации с производным сульфонилмочевины или инсулином)2; нечасто** — снижение ОЦК2,5, жажда**; редко — диабетический кетоацидоз (при применении при СД2)2,9,11.
Со стороны нервной системы: часто* — головокружение.
Со стороны ЖКТ: нечасто** — запор**, сухость во рту**.
Со стороны кожи и подкожных тканей: часто* — сыпь10; очень редко — ангионевротический отек.
Со стороны скелетно-мышечной системы и соединительной ткани: часто* — боль в спине*.
Со стороны почек и мочевыводящих путей: часто* — дизурия, полиурия*,6; нечасто** — никтурия**; очень редко — тубулоинтерстициальный нефрит.
Нарушения со стороны репродуктивной системы и молочных желез: нечасто** — вульвовагинальный зуд**, генитальный зуд**.
Лабораторные и инструментальные данные: часто* — повышение значения гематокрита7, снижение почечного клиренса креатинина на начальном этапе терапии2, дислипидемия8; нечасто** — повышение концентрации креатинина в крови на начальном этапе терапии**,2, повышение концентрации мочевины в крови**, уменьшение массы тела**.
1Представлены данные применения препарата до 24 недель (краткосрочная терапия) независимо от приема дополнительного гипогликемического препарата.
2См. соответствующий подраздел ниже для получения дополнительной информации.
3Вульвовагинит, баланит и связанные с ними генитальные инфекции включают, например, следующие заранее определенные предпочтительные термины: вульвовагинальную грибковую инфекцию, вагинальную инфекцию, баланит, грибковую инфекцию половых органов, вульвовагинальный кандидоз, вульвовагинит, кандидозный баланит, генитальный кандидоз, инфекцию половых органов, инфекцию половых органов у мужчин, инфекцию полового члена, вульвит, бактериальный вагинит, абсцесс вульвы.
4Инфекция мочевыводящих путей включает следующие предпочтительные термины, перечисленные в порядке убывания частоты: инфекция мочевыводящих путей, цистит, инфекция мочевыводящих путей, вызванная бактериями рода Escherichia, инфекция мочеполового тракта, пиелонефрит, тригонит, уретрит, инфекция почек и простатит.
5Снижение ОЦК включает, например, следующие заранее определенные предпочтительные термины: обезвоживание, гиповолемия, артериальная гипотензия.
6Полиурия включает предпочтительные термины: поллакиурия, полиурия и усиление диуреза.
7Средние изменения значения гематокрита от исходных значений составили 2,30% в группе дапаглифлозина 10 мг по сравнению с −0,33% в группе плацебо. Значения гематокрита >55% отмечены у 1,3% пациентов, получавших дапаглифлозин 10 мг, по сравнению с 0,4% пациентов, получавших плацебо.
8Среднее изменение следующих показателей в процентах от исходных значений в группе дапаглифлозина 10 мг и группе плацебо соответственно составило: общий холестерин 2,5% по сравнению с 0,0%; холестерин-ЛПВП 6,0% по сравнению с 2,7%; холестерин-ЛПНП 2,9% по сравнению с −1,0%; триглицериды −2,7% по сравнению с −0,7%.
9 См. «Особые указания».
10HP отмечена при пострегистрационном наблюдении. Сыпь включает следующие предпочтительные термины, перечисленные в порядке частоты развития в клинических исследованиях: сыпь, генерализованная сыпь, зудящая сыпь, макулезная сыпь, макулопапулезная сыпь, пустулезная сыпь, везикулезная сыпь, эритематозная сыпь. В плацебо-контролируемых и с активным контролем клинических исследованиях (группа, получавшая дапаглифлозин: n=5936, контрольная группа: n=3403) частота развития сыпи была схожей у пациентов, получавших дапаглифлозин (1,4%), и пациентов в контрольной группе (1,4%).
11Отмечено в исследовании сердечно-сосудистых исходов у пациентов с СД2 (DECLARE). Частота основана на годовом показателе.
*Отмечены у ≥2% пациентов и на ≥1% чаще, и у большего количества пациентов (как минимум на 3) в группе дапаглифлозина 10 мг по сравнению с группой плацебо.
**Оценены исследователем как возможно связанные, вероятно связанные или связанные с исследуемой терапией и отмечены у ≥0,2% пациентов и на ≥0,1% чаще, и у большего количества пациентов (как минимум на 3) в группе дапаглифлозина 10 мг по сравнению с группой плацебо.
Описание отдельных нежелательных реакций
Вульвовагинит, баланит и связанные с ними генитальные инфекции. В объединенных данных по безопасности 13 исследований вульвовагинит, баланит и связанные с ними генитальные инфекции отмечены у 5,5 и 0,6% пациентов, принимавших дапаглифлозин 10 мг и плацебо, соответственно. Большинство инфекций были слабо или умеренно выраженными; начальный курс стандартной терапии был эффективен, в связи с чем пациенты редко прекращали прием дапаглифлозина. Эти инфекции чаще развивались у женщин (8,4 и 1,2% при применении дапаглифлозина и плацебо соответственно), а у пациентов с такими инфекциями в анамнезе они чаще рецидивировали.
В исследовании DECLARE количество пациентов с серьезными нежелательными явлениями в виде генитальных инфекций было небольшим и сбалансированным: по 2 (<0,1%) пациента в группе дапаглифлозина и группе плацебо.
В исследовании DAPA-HF не было пациентов с серьезными нежелательными явлениями в виде генитальных инфекций в группе дапаглифлозина, в группе плацебо серьезное нежелательное явление зарегистрировано у 1 пациента. В группе дапаглифлозина у 7 (0,3%) пациентов были отмечены нежелательные явления, приводящие к прекращению лечения ввиду генитальных инфекций, и ни у одного пациента в группе плацебо. В исследовании DELIVER у 1 (<0,1%) пациента в каждой группе лечения отмечено серьезное нежелательное явление в виде генитальных инфекций. В группе дапаглифлозина у 3 (0,1%) пациентов отмечены нежелательные явления, приводившие к прекращению лечения ввиду генитальных инфекций, а в группе плацебо пациентов с такими явлениями не было.
В исследовании DAPA-CKD было 3 (0,1%) пациента с серьезными нежелательными явлениями в виде генитальных инфекций в группе дапаглифлозина и ни одного пациента с такими явлениями в группе плацебо. В группе дапаглифлозина у 3 (0,1%) пациентов отмечены нежелательные явления, приводившие к прекращению лечения из-за генитальных инфекций, а в группе плацебо пациентов с такими явлениями не было. О развитии серьезных нежелательных явлений и нежелательных явлений, приводивших к прекращению лечения из-за генитальных инфекций, у пациентов без СД2 не сообщалось.
Некротизирующий фасциит промежности (гангрена Фурнье). Сообщалось о пострегистрационных случаях развития гангрены Фурнье у пациентов, принимающих ингибиторы SGLT2, включая дапаглифлозин (см. «Особые указания»). В исследовании DECLARE у 17160 пациентов с СД2 и медианой продолжительности терапии 48 месяцев всего было зарегистрировано 6 случаев гангрены Фурнье: один — в группе, получавшей дапаглифлозин, и 5 — в группе плацебо.
Гипогликемия. Частота развития гипогликемии зависела от типа базовой терапии, используемой в клинических исследованиях СД2.
В исследованиях дапаглифлозина в качестве монотерапии, в качестве добавления к метформину и в качестве добавления к ситаглиптину (с метформином или без метформина) продолжительностью до 102 недель частота случаев легкой гипогликемии была схожей (<5%) в группах лечения, включая плацебо. Во всех исследованиях эпизоды тяжелой гипогликемии отмечены нечасто, и их частота была сопоставима между группой дапаглифлозина и плацебо.
В исследованиях дапаглифлозина в качестве добавления к препарату сульфонилмочевины или препарату инсулина отмечена более высокая частота гипогликемии (см. «Взаимодействие»). В исследовании добавления дапаглифлозина к глимепириду на 24-й и 48-й неделях незначительные эпизоды гипогликемии регистрировались чаще в группе дапаглифлозина 10 мг и глимепирида (6,0 и 7,9%, соответственно), чем в группе плацебо и глимепирида (2,1 и 2,1% соответственно).
В исследовании добавления дапаглифлозина к препаратам инсулина эпизоды выраженной гипогликемии были зарегистрированы у 0,5 и 1,0% пациентов, получавших дапаглифлозин 10 мг и препараты инсулина на 24-й и 104-й неделях, соответственно и у 0,5% пациентов, получавших плацебо и препараты инсулина на 24-й и 104-й неделях. На 24-й и 104-й неделях незначительные эпизоды гипогликемии были зарегистрированы, соответственно у 40,3 и 53,1% пациентов, получавших дапаглифлозин 10 мг и препараты инсулина, и у 34,0 и 41,6% пациентов, получавших плацебо и препараты инсулина.
В исследовании добавления дапаглифлозина к метформину и препарату сульфонилмочевины до 24 недель не было зарегистрировано ни одного эпизода тяжелой гипогликемии. Эпизоды легкой гипогликемии были зарегистрированы у 12,8% пациентов, получавших дапаглифлозин 10 мг в сочетании с метформином и препаратами сульфонилмочевины, и у 3,7% пациентов, получавших плацебо в сочетании с метформином и производными сульфонилмочевины.
В исследовании DECLARE не отмечено повышенного риска развития тяжелой гипогликемии при терапии дапаглифлозином по сравнению с плацебо. Случаи тяжелой гипогликемии зарегистрированы у 58 (0,7%) пациентов, получавших дапаглифлозин, и у 83 (1,0%) пациентов, получавших плацебо.
В исследовании DAPA-HF случаи тяжелой гипогликемии зарегистрированы у 4 (0,2%) пациентов как в группе дапаглифлозина, так и в группе плацебо.
В исследовании DELIVER случаи тяжелой гипогликемии зарегистрированы у 6 (0,2%) пациентов в группе дапаглифлозина и у 7 (0,2%) пациентов в группе плацебо. Случаи тяжелой гипогликемии наблюдались только у пациентов с СД2.
В исследовании DAPA-CKD случаи тяжелой гипогликемии зарегистрированы у 14 (0,7%) пациентов в группе дапаглифлозина и у 28 (1,3%) пациентов в группе плацебо и наблюдались только у пациентов с СД2.
Снижение ОЦК. В объединенных данных по безопасности 13 исследований нежелательные реакции, указывающие на снижение ОЦК (включая сообщения об обезвоживании, гиповолемии или артериальной гипотензии), отмечены у 1,1% и 0,7% пациентов, принимавших дапаглифлозин 10 мг и плацебо, соответственно; серьезные нежелательные реакции отмечены у <0,2% пациентов, и они были сопоставимы в группах дапаглифлозина 10 мг и плацебо (см. «Особые указания»).
В исследовании DECLARE количество пациентов с явлениями, указывающими на снижение ОЦК, было сбалансировано между группами лечения: 213 (2,5%) и 207 (2,4%) в группах дапаглифлозина и плацебо соответственно. Серьезные нежелательные явления были зарегистрированы у 81 (0,9%) и 70 (0,8%) пациентов в группе дапаглифлозина и плацебо соответственно. Явления в целом были сбалансированы между группами лечения по возрастным категориям, применению диуретиков, артериальному давлению и применению ингибитора АПФ/БРА II типа I. У пациентов с исходной рСКФ <60 мл/мин/1,73 м2 в группе дапаглифлозина отмечено 19 случаев серьезных нежелательных явлений, указывающих на снижение ОЦК, и 13 — в группе плацебо.
В исследовании DAPA-HF явления, указывающие на снижение ОЦК, были отмечены у 170 (7,2%) в группе дапаглифлозина и 153 (6,5%) в группе плацебо. В группе дапаглифлозина было меньше пациентов 23 (1,0%) с проявлениями серьезных симптомов, указывающих на снижение ОЦК, по сравнению с группой плацебо 38 (1,6%) пациентов соответственно. Результаты были одинаковыми независимо от исходного наличия диабета и исходной рСКФ. В исследовании DELIVER количество пациентов с серьезными нежелательными явлениями в виде симптомов, указывающих на снижение ОЦК, составило 35 (1,1%) в группе дапаглифлозина и 31 (1,0%) в группе плацебо.
В исследовании DAPA-CKD количество пациентов с явлениями, указывающими на снижение ОЦК, составило 120 (5,6%) в группе дапаглифлозина и 84 (3,9%) в группе плацебо. В группе дапаглифлозина у 16 (0,7%) пациентов отмечены серьезные явления в виде симптомов, указывающих на снижение ОЦК, и у 15 (0,7%) пациентов в группе плацебо.
Диабетический кетоацидоз при СД2. В исследовании DECLARE с медианой воздействия 48 месяцев явления диабетического кетоацидоза были зарегистрированы у 27 пациентов в группе дапаглифлозина 10 мг и 12 пациентов в группе плацебо. Данные явления возникали равномерно в течение периода исследования. В группе дапаглифлозина из 27 пациентов с диабетическим кетоацидозом 22 получали сопутствующую инсулинотерапию на момент развития явления. Предрасполагающие к развитию диабетического кетоацидоза факторы были ожидаемыми для популяции с СД2 (см. «Особые указания»).
В исследовании DAPA-HF явления диабетического кетоацидоза были зарегистрированы у 3 пациентов с СД2 в группе дапаглифлозина, в группе плацебо случаев диабетического кетоацидоза не было.
В исследовании DELIVER случаи диабетического кетоацидоза были зарегистрированы у 2 пациентов с СД2 в группе дапаглифлозина, а в группе плацебо случаев диабетического кетоацидоза не отмечалось.
В исследовании DAPA-CKD явления диабетического кетоацидоза не зарегистрированы ни у одного пациента в группе дапаглифлозина, но отмечались у 2 пациентов с СД2 в группе плацебо.
Инфекции мочевыводящих путей. В объединенных данных по безопасности 13 исследований инфекции мочевыводящих путей чаще отмечены при применении дапаглифлозина 10 мг, чем при применении плацебо (4,7% по сравнению с 3,5% соответственно; см. «Особые указания»). Большинство инфекций были слабо или умеренно выраженными; начальный курс стандартной терапии был эффективен, в связи с чем пациенты редко прекращали применение дапаглифлозина. Эти инфекции чаще развивались у женщин, а у пациентов с такими инфекциями в анамнезе они чаще рецидивировали.
В исследовании DECLARE серьезные случаи инфекций мочевыводящих путей регистрировались менее часто для дапаглифлозина 10 мг по сравнению с плацебо: 79 (0,9%) явлений по сравнению с 109 (1,3%) явлениями соответственно.
В исследовании DAPA-HF количество пациентов с серьезными нежелательными явлениями инфекций мочевыводящих путей было небольшим и сбалансированным: 14 (0,6%) пациентов в группе дапаглифлозина и 17 (0,7%) пациентов в группе плацебо. В группе дапаглифлозина и плацебо было по 5 (0,2%) пациентов с нежелательными явлениями, приводящими к прекращению лечения ввиду инфекций мочевыводящих путей.
В исследовании DELIVER серьезные нежелательные явления в виде инфекций мочевыводящих путей были отмечены у 41 (1,3%) пациента в группе дапаглифлозина и 37 (1,2%) пациентов в группе плацебо. В группе дапаглифлозина у 13 (0,4%) пациентов отмечены нежелательные явления, приводившие к прекращению лечения вследствие развития инфекций мочевыводящих путей, а в группе плацебо — у 9 (0,3%) пациентов.
В исследовании DAPA-CKD серьезные нежелательные явления в виде инфекций мочевыводящих путей отмечены у 29 (1,3%) пациентов в группе дапаглифлозина и у 18 (0,8%) пациентов в группе плацебо. В группе дапаглифлозина было 8 (0,4%) пациентов с нежелательными явлениями, приводившими к прекращению лечения из-за инфекций мочевыводящих путей, и 3 (0,1%) пациента в группе плацебо. Количество пациентов без СД2, у которых возникли серьезные нежелательные явления или нежелательные явления, приводившие к прекращению лечения из-за инфекций мочевыводящих путей, было схожим между группами лечения (6 (0,9%) по сравнению с 4 (0,6%) для серьезных нежелательных явлений; 1 (0,1%) по сравнению с 0 для нежелательных явлений, приводивших к прекращению лечения).
Повышение кониентраиии креатинина. Нежелательные реакции, связанные с повышением концентрации креатинина, были сгруппированы (например, снижение почечного клиренса креатинина, нарушение функции почек, повышение концентрации креатинина в крови и снижение СКФ). В объединенных данных по безопасности 13 исследований данная группа реакций была отмечена у 3,2 и 1,8% пациентов, получавших дапаглифлозин 10 мг и плацебо соответственно. У пациентов с нормальной функцией почек или нарушением функции почек легкой степени (исходно рСКФ >60 мл/мин/1,73 м2) эта группа реакций была зарегистрирована у 1,3 и 0,8% пациентов, получавших дапаглифлозин 10 мг и плацебо соответственно. Эти реакции чаще отмечались у пациентов с исходной рСКФ ≥30 и <60 мл/мин/1,73 м2 (18,5% в группе дапаглифлозина 10 мг по сравнению с 9,3% в группе плацебо).
Дополнительная оценка пациентов с нежелательными явлениями, связанными с функцией почек, показала, что у большинства этих пациентов отмечено изменение концентрации креатинина в сыворотке на ≤44 мкмоль/л (≤0,5 мг/дл) относительно исходного значения.
Повышение концентрации креатинина в целом было временным на фоне продолжения терапии или обратимым после прекращения терапии.
В исследовании DECLARE, включавшем пожилых пациентов и пациентов с нарушением функции почек (рСКФ менее 60 мл/мин/1,73 м2), рСКФ снижалась с течением времени в обеих группах лечения. Через 1 год терапии среднее значение рСКФ в группе дапаглифлозина было немного ниже, а через 4 года терапии — немного выше по сравнению с группой плацебо.
В исследовании DAPA-HF, а также в исследовании DELIVER рСКФ снижалась с течением времени как в группе дапаглифлозина, так и в группе плацебо. В исследовании DAPA-HF начальное снижение среднего значения рСКФ составило −4,3 мл/мин/1,73 м2 в группе дапаглифлозина и −1,1 мл/мин/1,73 м2 в группе плацебо. Через 20 месяцев изменение рСКФ относительно исходного значения было схожим в группах лечения: −5,3 мл/мин/1,73 м2 в группе дапаглифлозина и −4,5 мл/мин/1,73 м2 в группе плацебо.
В исследовании DELIVER снижение среднего значения рСКФ через 1 месяц составило −3,7 мл/мин/1,73 м2 в группе дапаглифлозина и −0,4 мл/мин/1,73 м2 в группе плацебо. Через 24 месяца изменение рСКФ относительно исходного значения было схожим в группах лечения: −4,2 мл/мин/1,73 м2 в группе дапаглифлозина и −3,2 мл/мин/1,73 м2 в группе плацебо.
В исследовании DAPA-CKD рСКФ снижалась с течением времени как в группе дапаглифлозина, так и в группе плацебо. Начальное (на 14-й день) снижение средней рСКФ составило −4,0 мл/мин/1,73 м2 в группе дапаглифлозина и −0,8 мл/мин/1,73 м2 в группе плацебо. Через 28 месяцев изменение рСКФ относительно исходного значения составило −7,4 мл/мин/1,73 м2 в группе дапаглифлозина и −8,6 мл/мин/1,73 м2 в группе плацебо.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации препарата с целью обеспечения непрерывного мониторинга соотношения польза/риск лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств — членов Евразийского экономического союза.
Российская Федерация. Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор). 109012, Москва, Славянская пл., 4, стр. 1.
Тел.: +7 800 550-99-03.
e-mail: pharm@roszdravnadzor.gov.ru
https://roszdravnadzor.gov.ru
Республика Армения. АОЗТ Научный центр экспертизы лекарств и медицинских технологий им. академика Э. Габриеляна. 0051, г. Ереван, пр. Комитаса, 49/5.
Тел. отдела мониторинга безопасности лекарственных средств: (+374 10) 200505, (+374 96) 220505.
e-mail: vigilance@pharm.am admin@pharm.am
https://www.pharm.am
Республика Беларусь. УП «Центр экспертиз и испытаний в здравоохранении». 220037, г. Минск, Товарищеский пер., 2a.
Тел. отдела Фармаконадзора: +375 (17) 242-00-29; факс: +375 (17) 242-00-29.
e-mail: rcpl@rceth.by rceth@rceth.by
https://www.rceth.by
Республика Казахстан. РГП на ПХВ Национальный центр экспертизы лекарственных средств и медицинских изделий комитета медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан. 010000, г. Астана, ул. А. Иманова, 13.
Тел.: 8 (7172) 235-135.
e-mail: pdlc@dari.kz
https://www.ndda.kz
Взаимодействие
Фармакодинамическое взаимодействие
Диуретики. Дапаглифлозин может усиливать диуретический эффект тиазидных и петлевых диуретиков и повышать риск развития обезвоживания и артериальной гипотензии (см. «Особые указания»).
Инсулин и препараты, повышающие секрецию инсулина. На фоне применения инсулина и препаратов, повышающих секрецию инсулина, может возникать гипогликемия. Поэтому с целью снижения риска гипогликемии при совместном применении препарата Форсига с препаратом инсулина или препаратом, повышающим секрецию инсулина, может потребоваться снижение дозы препарата инсулина или препарата, повышающего секрецию инсулина (см. «Способ применения и дозы» и «Побочные действия»).
Фармакокинетическое взаимодействие
Метаболизм дапаглифлозина в основном осуществляется посредством глюкуронидной конъюгации под действием UGT1A9.
В ходе исследований in vitro дапаглифлозин не ингибировал изоферменты системы цитохрома Р450 CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4 и не индуцировал изоферменты CYP1A2, CYP2B6 или CYP3A4. В связи с этим не ожидается влияние дапаглифлозина на метаболический клиренс сопутствующих препаратов, которые метаболизируются под действием этих изоферментов.
Влияние других лекарственных препаратов на дапаглифлозин. Исследования взаимодействий с участием здоровых добровольцев, в основном принимавших однократную дозу препарата, показали, что метформин, пиоглитазон, ситаглиптин, глимепирид, воглибоза, гидрохлоротиазид, буметанид, валсартан или симвастатин не оказывают влияние на фармакокинетику дапаглифлозина.
После совместного применения дапаглифлозина и рифампицина, индуктора различных активных транспортеров и ферментов, метаболизирующих лекарственные препараты, отмечено снижение системной экспозиции (AUC) дапаглифлозина на 22%, при отсутствии клинически значимого влияния на суточное выведение глюкозы почками. Не рекомендуется корректировать дозу препарата. Клинически значимое влияние при применении с другими индукторами (например карбамазепин, фенитоин, фенобарбитал) не ожидается.
После совместного применения дапаглифлозина и мефенамовой кислоты (ингибитор UGT1A9) отмечено увеличение на 55% системной экспозиции дапаглифлозина, но без клинически значимого влияния на суточное выведение глюкозы почками. Не рекомендуется корректировать дозу препарата.
Влияние дапаглифлозина на другие лекарственные препараты. Одновременное применение дапаглифлозина и препаратов лития может привести к снижению концентрации лития в сыворотке крови из-за возможного усиления выведения лития с мочой. Может потребоваться коррекция дозы препарата лития.
В исследованиях взаимодействий с участием здоровых добровольцев, в основном однократно принимавших дозу препарата, дапаглифлозин не влиял на фармакокинетику метформина, пиоглитазона, ситаглиптина, глимепирида, гидрохлоротиазида, буметанида, валсартана, дигоксина (субстрат P-gp) или варфарина (S-варфарин, субстрат изофермента CYP2C9), или на антикоагуляционный эффект, оцениваемый по Международному нормализованному отношению (МНО). Применение однократной дозы дапаглифлозина 20 мг и симвастатина (субстрата изофермента CYP3A4) приводило к повышению на 19% AUC симвастатина и на 31% AUC симвастатиновой кислоты. Повышение экспозиции симвастатина и симвастатиновой кислоты не считается клинически значимым.
Влияние на определение 1,5-ангидроглюцитола. Оценка гликемического контроля с помощью определения 1,5-ангидроглюцитола не рекомендуется, поскольку измерение 1,5-ангидроглюцитола является ненадежным методом для пациентов, принимающих ингибиторы SGLT2. Для оценки гликемического контроля следует использовать альтернативные методы.
Другие взаимодействия. Влияние курения, диеты, приема растительных препаратов и употребления алкоголя на параметры фармакокинетики дапаглифлозина не изучалось.
Передозировка
Симптомы: дапаглифлозин безопасен и хорошо переносится здоровыми добровольцами при однократном приеме в дозах до 500 мг (в 50 раз выше рекомендуемой дозы). Глюкоза определялась в моче после приема препарата (как минимум в течение 5 дней после приема дозы 500 мг), при этом не выявлены случаи обезвоживания, гипотонии, электролитного дисбаланса, клинически значимого влияния на интервал QTc. Частота развития гипогликемии была схожей с частотой при приеме плацебо. В клинических исследованиях у здоровых добровольцев и пациентов с СД2, принимавших препарат однократно в дозах до 100 мг (в 10 раз выше максимальной рекомендуемой дозы) в течение 2 недель, частота развития гипогликемии была немного выше, чем при приеме плацебо, и не зависела от дозы. Частота развития нежелательных явлений, включая обезвоживание или артериальную гипотензию, была схожей с частотой в группе плацебо, при этом не выявлено клинически значимых, дозозависимых изменений лабораторных показателей, включая сывороточную концентрацию электролитов и биомаркеров функции почек.
Лечение: в случае передозировки необходимо проводить поддерживающую терапию, учитывая состояние пациента. Выведение дапаглифлозина с помощью гемодиализа не изучалось.
Особые указания
Общие указания
Дапаглифлозин не следует применять пациентам с СД1 (см. Диабетический кетоацидоз).
Нарушение функции почек
Из-за ограниченного опыта не рекомендуется начинать лечение дапаглифлозином у пациентов с СКФ <25 мл/мин.
Эффективность дапаглифлозина в отношении снижения уровня глюкозы зависит от функции почек и уменьшается у пациентов с рСКФ менее 45 мл/мин/1,73 м2 и, вероятно, отсутствует у пациентов с тяжелой почечной недостаточностью (см. «Способ применения и дозы», «Фармакодинамика», «Фармакокинетика»).
В одном исследовании у пациентов с СД2 с нарушением функции почек средней степени тяжести (рСКФ <60 мл/мин/1,73 м2) нежелательные реакции в виде повышения концентраций креатинина, фосфора, паратиреоидного гормона и артериальной гипотензии в группе дапаглифлозина отмечались у большей доли пациентов, чем в группе плацебо.
Нарушение функции печени
В клинических исследованиях получены ограниченные данные о применении препарата у пациентов с нарушением функции печени. Экспозиция дапаглифлозина увеличена у пациентов с нарушением функции печени тяжелой степени (см. «Способ применения и дозы», «Фармакокинетика»).
Применение у пациентов с риском снижения ОЦК и/или артериальной гипотензии
В соответствии с механизмом действия дапаглифлозин усиливает диурез, что может приводить к небольшому снижению АД, отмеченному в клинических исследованиях (см. «Фармакодинамика»). Диуретический эффект может быть более выраженным у пациентов с очень высокой концентрацией глюкозы в крови.
Следует соблюдать осторожность у пациентов, для которых вызванное дапаглифлозином снижение АД может представлять риск, например у пациентов, получающих гипотензивную терапию, с эпизодами гипотензии в анамнезе или у пожилых пациентов.
В случае интеркуррентных состояний, которые могут привести к cнижению ОЦК (например, желудочно-кишечные заболевания), рекомендуется тщательный мониторинг ОЦК (например, физикальное обследование, измерение АД, лабораторные исследования, включая гематокрит и концентрации электролитов). Временное прекращение лечения дапаглифлозином рекомендуется пациентам, у которых развивается гиповолемия, до ее коррекции (см. «Побочные действия»).
Диабетический кетоацидоз
Сообщалось о редких случаях диабетического кетоацидоза, включая угрожающие жизни и летальные случаи у пациентов, получавших ингибиторы натрий-глюкозного котранспортера 2-го типа (SGLT2), включая дапаглифлозин. В ряде случаев клиническая картина состояния была нетипичной, с умеренным, ниже 14 ммоль/л (250 мг/дл), повышением концентрации глюкозы в крови.
Риск диабетического кетоацидоза следует учитывать при появлении неспецифических симптомов, таких как тошнота, рвота, анорексия, боль в животе, чрезмерная жажда, затрудненное дыхание, спутанность сознания, повышенная утомляемость или сонливость. При появлении этих симптомов пациентов следует немедленно обследовать на наличие кетоацидоза, независимо от концентрации глюкозы в крови.
У пациентов с подозрением или диагнозом диабетического кетоацидоза лечение дапаглифлозином следует немедленно прекратить.
Лечение следует приостановить у пациентов, госпитализированных в связи с обширными хирургическими вмешательствами или острыми серьезными заболеваниями. У этих пациентов рекомендуется контролировать содержание кетоновых тел. Измерение концентрации кетоновых тел в крови предпочтительнее, чем в моче. Лечение дапаглифлозином можно возобновить при нормализации концентрации кетоновых тел и стабилизации состояния пациента.
Перед назначением дапаглифлозина следует учитывать данные анамнеза пациента, которые могут предрасполагать к кетоацидозу.
К группе возможного повышенного риска развития диабетического кетоацидоза относятся пациенты с низким резервом функции бета-клеток (например, пациенты с СД2 с низким уровнем С-пептида или латентным аутоиммунным диабетом взрослых (LADA-диабет) или пациенты с панкреатитом в анамнезе); пациенты с заболеваниями, которые приводят к ограничению приема пищи или тяжелому обезвоживанию; пациенты, у которых снижены дозы препаратов инсулина; и пациенты с повышенной потребностью в препаратах инсулина из-за острого заболевания, хирургического вмешательства или злоупотребления алкоголем. Следует соблюдать осторожность при применении ингибиторов SGLT2 у таких пациентов.
У пациентов с диабетическим кетоацидозом, возникшим во время лечения ингибитором SGLT2, не рекомендуется возобновление терапии ингибитором SGLT2, если не был выявлен и устранен другой явный провоцирующий фактор.
В исследованиях дапаглифлозина у пациентов с СД1 часто отмечался диабетический кетоацидоз. Дапаглифлозин не следует применять для лечения больных с СД1.
Некротизирующий фасциит промежности (гангрена Фурнье)
Сообщалось о пострегистрационных случаях некротизирующего фасциита промежности (также называемого гангреной Фурнье) у женщин и мужчин, принимающих ингибиторы SGLT2 (см. «Побочные действия»). Это редкое, но серьезное и потенциально угрожающее жизни явление, которое требует неотложного хирургического вмешательства и применения антибиотиков.
Пациентам рекомендуется обратиться к врачу в том случае, если у них появились боль, чувствительность при прикосновении, эритема или отек в области гениталий или области промежности в сочетании с лихорадкой и недомоганием. Следует помнить, что либо урогенитальная инфекция, либо абсцесс промежности могут предшествовать некротизирующему фасцииту.
При подозрении на гангрену Фурнье применение препарата Форсига должно быть прекращено и начато незамедлительное лечение (включая антибиотики и хирургическую обработку).
Инфекции мочевыводящих путей
Экскреция глюкозы с мочой может быть связана с повышенным риском инфекции мочевыводящих путей. Поэтому при лечении пиелонефрита или уросепсиса следует рассмотреть возможность приостановки терапии дапаглифлозином.
Пациенты пожилого возраста (≥65 лет)
У пожилых пациентов риск снижения ОЦК может быть повышен, и им чаще назначают диуретики. Пожилые пациенты чаще имеют нарушение функции почек и/или получают лечение антигипертензивными препаратами, которые могут вызывать изменения функции почек, такими как ингибиторы АПФ и БРА II типа 1. Для пациентов пожилого возраста применимы те же рекомендации в отношении функции почек, что и для других пациентов (см. «Способ применения и дозы», «Побочные действия» и «Фармакодинамика»).
ХСН
Опыт применения дапаглифлозина у пациентов сХСН IV функционального класса по классификации NYHA ограничен.
Инфильтративная кардиомиопатия
Применение дапаглифлозина у пациентов с инфильтративной кардиомиопатией не изучалось.
Хроническая болезнь почек
Опыт применения дапаглифлозина для лечения хронической болезни почек у пациентов без СД2 и альбуминурии отсутствует. Пациенты с альбуминурией могут получить больше пользы от лечения дапаглифлозином.
Ампутация нижних конечностей
Увеличение случаев ампутации нижних конечностей (в первую очередь, пальцев стопы) наблюдалось в долгосрочных клинических исследованиях применения ингибиторов SGLT2 у пациентов с СД2. Неизвестно, является ли это эффектом препаратов класса SGLT2. Пациентам с СД2 важно рекомендовать постоянный профилактический уход за стопами.
Оценка результатов анализа мочи
Вследствие механизма действия препарата результаты анализа мочи на глюкозу у пациентов, принимающих препарат Форсига, будут положительными.
Лактоза
Препарат содержит лактозу. Этот лекарственный препарат не следует применять пациентам с редкой наследственной непереносимостью лактозы, дефицитом лактазы или синдромом глюкозо-галактозной мальабсорбции.
Влияние на способность управлять транспортными средствами и работать с механизмами. Исследований по изучению влияния дапаглифлозина на способность к управлению транспортными средствами и механизмами не проводилось.
Форма выпуска
Для таблеток 5 мг (при производстве на предприятии АстраЗенека Фармасьютикалс ЛП, США): по 10 таблеток в перфорированном блистере из алюминиевой фольги, сформированном из формовочного ламината, состоящего из полиамида/мягкой алюминиевой фольги/непластифицированной поливинилхлоридной (ПВХ) пленки, запечатанном закаленной алюминиевой фольгой, покрытой термолаком.
По 3 перфорированных блистера с листком-вкладышем в картонной пачке с контролем первого вскрытия.
По 14 таблеток в блистере из алюминиевой фольги, сформированном из формовочного ламината, состоящего из полиамида/мягкой алюминиевой фольги/непластифицированной поливинилхлоридной (ПВХ) пленки, запечатанном закаленной алюминиевой фольгой, покрытой термолаком; по 1 или 2 блистера с листком-вкладышем в картонной пачке с контролем первого вскрытия.
Для таблеток 10 мг (при производстве на предприятии АстраЗенека Фармасьютикалс ЛП, США): по 10 таблеток в перфорированном блистере из алюминиевой фольги, сформированном из формовочного ламината, состоящего из полиамида/мягкой алюминиевой фольги/непластифицированной поливинилхлоридной (ПВХ) пленки, запечатанном закаленной алюминиевой фольгой, покрытой термолаком; по 3 перфорированных блистера с листком-вкладышем в картонной пачке с контролем первого вскрытия.
По 14 таблеток в блистере из алюминиевой фольги, сформированном из формовочного ламината, состоящего из полиамида/мягкой алюминиевой фольги/непластифицированной поливинилхлоридной (ПВХ) пленки, запечатанном закаленной алюминиевой фольгой, покрытой термолаком; по 1 или 2 блистера с листком-вкладышем в картонной пачке с контролем первого вскрытия.
При производстве на предприятии ООО «АстраЗенека Индастриз», Россия: по 10 таблеток в блистере из алюминиевой фольги, сформированном из формовочного ламината, состоящего из полиамида/мягкой алюминиевой фольги/непластифицированной поливинилхлоридной (ПВХ) пленки, запечатанном закаленной алюминиевой фольгой, покрытой термолаком.
По 3 или 9 блистеров с листком-вкладышем в картонной пачке с контролем первого вскрытия.
Производитель
Держатель регистрационного удостоверения. Великобритания/United Kingdom АстраЗенека ЮК Лимитед, 1, Френсис Крик Авеню, Кембридж Биомедикал Кампус, Кембридж, Великобритания, CB2 0AA/AstraZeneca UK Limited, 1, Francis Crick Avenue, Cambridge Biomedical Campus, Cambridge, United Kingdom, CB2 0AA.
Представитель держателя регистрационного удостоверения/претензии потребителей направлять по адресу. Российская Федерация, Республика Армения, Республика Беларусь. ООО АстраЗенека Фармасьютикалз. 123112, Москва, 1-й Красногвардейский пр., 21, стр. 1, этаж 30-й, комн. 13 и 14.
Тел.: +7 (495) 799-56-99; факс: +7 (495) 799-56-98.
e-mail: в Российской Федерации: Safety.Russia@astrazeneca.com ProductQuality.ru@astrazeneca.com
в Республике Армения, Республике Беларусь: Frontiers-PV@astrazeneca.com ProductQualityEurasia@astrazeneca.com
Республика Казахстан. Представительство ЗАК «АстраЗенека Ю-Кей Лимитед». 050000, г. Алматы, ул. Кунаева, 77, оф. 101.
Тел.: +7 727-232-14-15; +7 701-032-67-45.
e-mail: adverse.events.kz@astrazeneca.com
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 30 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Описание проверено
-
Лобанова Елена Георгиевна
(фармаколог, доктор медицинских наук, профессор)
Опыт работы: более 30 лет
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Листок-вкладыш – информация для пациента Форсига, 5 мг, таблетки, покрытые пленочной оболочкой Форсига, 10 мг, таблетки, покрытые пленочной оболочкой
Действующее вещество: дапаглифлозин
Перед приемом препарата полностью прочитайте листок-вкладыш, поскольку в нем содержатся важные для Вас сведения.
- Сохраните листок-вкладыш. Возможно, Вам потребуется прочитать его еще раз.
- Если у Вас возникли дополнительные вопросы, обратитесь к лечащему врачу.
- Препарат назначен именно Вам. Не передавайте его другим людям. Он может навредить им, даже если симптомы их заболевания совпадают с Вашими.
- Если у Вас возникли какие-либо нежелательные реакции, обратитесь к лечащему врачу. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в разделе 4 листка-вкладыша.
Содержание листка-вкладыша
- Что из себя представляет препарат Форсига, и для чего его применяют.
- О чем следует знать перед приемом препарата Форсига.
- Прием препарата Форсига.
- Возможные нежелательные реакции.
- Хранение препарата Форсига.
- Содержимое упаковки и прочие сведения.
-
1. Что из себя представляет препарат Форсига, и для чего его применяют
Препарат Форсига содержит действующее вещество дапаглифлозин. Препарат Форсига относится к группе лекарственных препаратов, называемых «ингибиторы натрий-глюкозного котранспортера 2 типа (SGLT2). Эти лекарственные препараты оказывают свое действие путем блокирования белка SGLT2 в почках. При блокировании этого белка сахар в крови (глюкоза), соль (натрий) и вода выводятся из организма через мочу.
Показания к применению
Препарат Форсига показан к применению у взрослых в возрасте от 18 лет для лечения:
- сахарного диабета 2 типа в дополнение к диете и физическим упражнениям для улучшения гликемического контроля:
- в качестве монотерапии, когда применение метформина невозможно ввиду непереносимости;
- в комбинированной терапии с метформином, производными сульфонилмочевины (в том числе, в комбинации с метформином), тиазолидиндионами, ингибиторами дипептидилпептидазы 4 (ДПП-4) (в том числе, в комбинации с метформином); агонистом рецепторов глюкагоноподобного полипептида-1 (ГПП-1) эксенатидом пролонгированного действия в комбинации с метформином; препаратами инсулина (в том числе, в комбинации с одним или двумя гипогликемическими препаратами для перорального применения) при отсутствии адекватного гликемического контроля на данной терапии;
- в стартовой комбинированной терапии с метформином, при целесообразности данной терапии;
- сахарного диабета 2 типа у пациентов с установленным диагнозом сердечно-сосудистого заболевания или двумя и более факторами сердечно-сосудистого риска* для снижения риска госпитализации по поводу сердечной недостаточности;
* возраст у мужчин ≥ 55 лет или ≥ 60 лет у женщин и наличие не менее одного фактора риска: дислипидемия, артериальная гипертензия, курение.
- симптоматической хронической сердечной недостаточности;
- хронической болезни почек с риском ее прогрессирования для уменьшения риска устойчивого снижения расчетной скорости клубочковой фильтрации (рСКФ), наступления терминальной стадии хронической почечной недостаточности, смерти от сердечно- сосудистого заболевания и госпитализации по поводу сердечной недостаточности.
Если улучшение не наступило, или Вы чувствуете ухудшение, необходимо обратиться к врачу.
-
2. О чем следует знать перед приемом препарата Форсига Противопоказания
Не принимайте препарат Форсига, если у Вас аллергия на дапаглифлозин или любые другие компоненты препарата, перечисленные в разделе 6 листка-вкладыша.
Особые указания и меры предосторожности
Перед приемом препарата Форсига проконсультируйтесь с лечащим врачом.
Незамедлительно обратитесь к врачу или в ближайшее медицинское учреждение в следующих случаях
Диабетический кетоацидоз:
- если у Вас сахарный диабет и возникает плохое самочувствие или недомогание, боль в животе, чрезмерная жажда, быстрое и глубокое дыхание, спутанность сознания, необычная сонливость или чувство усталости, сладкий запах изо рта, сладкий или металлический привкус во рту, изменение запаха мочи или пота, или быстрое снижение массы тела.
- перечисленные выше симптомы могут быть признаком «диабетического кетоацидоза» – редкого, но серьезного, иногда угрожающего жизни состояния, которое может возникнуть у Вас при сахарном диабете из-за повышенного уровня
«кетоновых тел» в моче или крови, обнаруживаемых при лабораторных исследованиях.
- риск развития диабетического кетоацидоза может повышаться при длительном голодании, чрезмерном употреблении алкоголя, обезвоживании, резком снижении дозы инсулина или повышенной потребности в инсулине вследствие обширного хирургического вмешательства или тяжелого заболевания.
- при лечении препаратом Форсига диабетический кетоацидоз может развиться даже при нормальном уровне сахара в крови.
Если Вы подозреваете, что у Вас диабетический кетоацидоз, незамедлительно обратитесь к врачу или в ближайшее медицинское учреждение и не принимайте данный препарат.
Некротизирующий фасциит промежности:
- немедленно обратитесь к лечащему врачу, если у Вас появились следующие симптомы: боль, чувствительность при прикосновении, покраснение или отек гениталий или области между гениталиями и анальным отверстием, которые сопровождаются лихорадкой или общим недомоганием. Эти симптомы могут быть признаком редкой, но серьезной или даже угрожающей жизни инфекции, называемой некротизирующим фасциитом промежности или гангреной Фурнье, которая разрушает подкожные ткани.
Перед приемом препарата Форсига проконсультируйтесь с лечащим врачом:
- если у Вас сахарный диабет 1 типа – тип сахарного диабета, который обычно начинается в молодом возрасте, и при котором в организме не вырабатывает инсулин. Препарат Форсига не следует принимать при данном типе сахарного диабета;
- если у Вас сахарный диабет и нарушение функции почек, лечащий врач может рекомендовать Вам принимать дополнительный или другой лекарственный препарат для контроля уровня сахара в крови;
- если у Вас нарушения функции печени, лечащий врач может назначить Вам более низкую дозу препарата;
- если Вы принимаете лекарственные препараты для снижения артериального давления (антигипертензивные препараты), и у Вас в анамнезе было низкое артериальное давление (артериальная гипотензия). Более подробная информация представлена ниже в подразделе «Другие препараты и препарат Форсига»;
- если у Вас очень высокий уровень сахара в крови, что может привести к обезвоживанию (потере слишком большого количества жидкости из организма). Возможные признаки обезвоживания перечислены в разделе 4 листка-вкладыша. Если у Вас есть какие-либо из этих признаков, сообщите лечащему врачу перед тем, как начинать принимать препарат Форсига;
- если у Вас ощущение тошноты, рвота или лихорадка, или если Вы не можете есть или пить.
- если у Вас часто возникают инфекции мочевыводящих путей.
Если что-либо из перечисленного выше относится к Вам (или Вы не уверены), проконсультируйтесь с лечащим врачом, прежде чем принимать препарат Форсига. Сахарный диабет и уход за стопами
Если у Вас сахарный диабет, важно регулярно проверять состояние стоп и соблюдать все другие указания по уходу за стопами, которые дает Вам лечащий врач.
Глюкоза в моче
Вследствие механизма действия препарата Форсига анализ мочи на сахар будет иметь положительный результат, пока Вы принимаете данный препарат.
Грибковые генитальные инфекции
Препарат Форсига повышает риск развития грибковой инфекции влагалища или полового члена, особенно если у Вас была такая инфекция ранее. Проконсультируйтесь с лечащим врачом, если у Вас часто возникают данные инфекции.
Дети и подростки
Имеющиеся на сегодняшний день клинические данные не позволяют дать рекомендации по режиму дозирования.
Другие препараты и препарат Форсига
Сообщите лечащему врачу о том, что Вы принимаете, недавно принимали или можете начать принимать какие-либо другие препараты.
Обязательно сообщите лечащему врачу, если Вы принимаете:
- лекарственный препарат, который выводит воду из организма (диуретик).
- другие лекарственные препараты, снижающие уровень сахара в крови, такие как инсулин или производное сульфонилмочевины. Ваш врач может снизить дозу других сахароснижающих препаратов, чтобы предотвратить развитие низкого уровня сахара в крови (гипогликемию).
- Вы применяете препарат лития, поскольку препарат Форсига может снизить уровень лития в крови.
Беременность, грудное вскармливание и фертильность
Если Вы беременны или кормите грудью, думаете, что забеременели, или планируете беременность, перед началом применения препарата проконсультируйтесь с лечащим врачом.
Беременность
Не принимайте препарат Форсига, если Вы забеременели, поскольку применение препарата не рекомендуется во втором и третьем триместрах беременности. При подтверждении беременности лечение дапаглифлозином следует прекратить.
Лактация
Не принимайте препарат Форсига в период грудного вскармливания. Неизвестно, проникает ли этот лекарственный препарат в грудное молоко.
Фертильность
Влияние дапаглифлозина на фертильность у человека не изучалось. У самцов и самок крыс дапаглифлозин не оказывал влияния на фертильность.
Управление транспортными средствами и работа с механизмами Исследований по изучению влияния дапаглифлозина на способность к управлению транспортными средствами и механизмами не проводилось.
Препарат Форсига содержит лактозу
Если у Вас непереносимость некоторых сахаров, обратитесь к лечащему врачу перед приемом данного лекарственного препарата.
-
3. Прием препарата Форсига
Всегда принимайте препарат в полном соответствии с рекомендациями лечащего врача. При появлении сомнений посоветуйтесь с лечащим врачом.
Рекомендуемая доза:
Сахарный диабет 2 типа
Монотерапия: рекомендуемая доза препарата составляет 10 мг один раз в сутки. Комбинированная терапия: рекомендуемая доза препарата составляет 10 мг один раз в сутки. Стартовая комбинированная терапия с метформином: рекомендуемая доза препарата составляет 10 мг один раз в сутки, доза метформина – 500 мг один раз в сутки. В случае неадекватного гликемического контроля дозу метформина следует увеличить.
Сахарный диабет 2 типа у пациентов с установленным диагнозом сердечно-сосудистого заболевания или двумя и более факторами сердечно-сосудистого риска для снижения риска госпитализации по поводу сердечной недостаточности: рекомендуемая доза препарата составляет 10 мг один раз в сутки.
Хроническая сердечная недостаточность
Рекомендуемая доза препарата составляет 10 мг один раз в сутки. Хроническая болезнь почек
Рекомендуемая доза препарата составляет 10 мг один раз в сутки.
- Если у Вас есть проблемы с печенью, врач может назначить Вам дозу 5 мг.
- Врач назначит дозу препарата, которая подходит именно Вам.
Путь и способ введения
Внутрь.
Таблетку необходимо проглатывать целиком, запивая водой. Таблетку не следует
разжевывать или измельчать. Препарат может назначаться в любое время суток независимо от приема пищи.
Диета и физические упражнения могут помочь Вашему организму лучше использовать сахар, содержащийся в крови. Если у Вас сахарный диабет, во время применения препарата Форсига важно придерживаться диеты и программы физических упражнений, рекомендованных Вашим лечащим врачом.
Продолжительность лечения
Продолжайте прием препарата Форсига столько, сколько назначил Ваш врач.
Если Вы приняли препарата Форсига больше, чем следовало
Если Вы приняли больше таблеток, чем необходимо, немедленно обратитесь за медицинской помощью.
Если Вы забыли принять препарат Форсига
Что нужно делать, если Вы забыли принять таблетку, зависит от того, сколько времени осталось до приема следующей дозы.
- Если до приема следующей дозы осталось 12 или более часов, примите дозу препарата Форсига, как только Вы об этом вспомнили. Затем примите следующую дозу в обычное время.
- Если до приема следующей дозы осталось менее 12 часов, не принимайте пропущенную дозу. Затем примите следующую дозу в обычное время.
- Не принимайте двойную дозу препарата Форсига, чтобы компенсировать пропущенную дозу.
Если Вы прекратили прием препарата Форсига
Не прекращайте принимать препарат Форсига без консультации с Вашим лечащим врачом. Если у Вас сахарный диабет, без этого лекарственного препарата уровень сахара в Вашей крови может повыситься.
При наличии вопросов по применению препарата обратитесь к лечащему врачу.
-
4. Возможные нежелательные реакции
Подобно всем лекарственным препаратам препарат может вызывать нежелательные реакции, однако они возникают не у всех.
Прекратите прием препарата Форсига и незамедлительно обратитесь за медицинской помощью в случае возникновения признаков перечисленных ниже реакций:
- ангионевротический отек наблюдается очень редко (может возникать не более чем у
1 человека из 10 000)
Признаками ангионевротического отека являются:
- отек лица, языка или горла;
- затруднение глотания;
- крапивница и проблемы с дыханием.
- диабетический кетоацидоз – это состояние редко наблюдается у пациентов с сахарным диабетом 2 типа (может возникать не более чем у 1 человека из 1000).
Признаками диабетического кетоацидоза являются (см. также подраздел «Особые указания и меры предосторожности» раздела 2 листка-вкладыша):
- повышенный уровень «кетоновых тел» в моче или крови;
- недомогание или ощущение недомогания;
- боль в животе;
- чрезмерная жажда;
- быстрое и глубокое дыхание;
- спутанность сознания;
- необычная сонливость или чувство усталости;
- сладкий запах изо рта, сладкий или металлический привкус во рту или изменение запаха мочи или пота;
- быстрое снижение массы тела.
Эти симптомы могут возникнуть независимо от уровня сахара в крови. Ваш лечащий врач может принять решение о временном или полном прекращении лечения препаратом.
- некротизирующий фасциит промежности или гангрена Фурнье – это серьезная инфекция мягких тканей гениталий или области между гениталиями и анальным отверстием, которая наблюдается очень редко (может возникать не более чем у
1 человека из 10 000).
- инфекция мочевыводящих путей встречается часто (может возникать не более чем у
1 человека из 10).
Признаками тяжелой инфекции мочевыводящих путей являются:
- лихорадка и/или озноб;
- ощущение жжения при мочеиспускании;
- боль в спине или боку.
Если Вы заметили кровь в моче (хотя это нечастое явление), немедленно сообщите об этом лечащему врачу.
- низкий уровень сахара в крови (гипогликемия) – наблюдается очень часто (может возникать более чем у 1 человека из 10) у пациентов с сахарным диабетом, принимающих данный препарат в комбинации с производным сульфонилмочевины или инсулином.
Признаками низкого уровня сахара в крови являются:
- дрожь, потоотделение, чувство сильного беспокойства, учащенное сердцебиение;
- чувство голода, головная боль, нарушение зрения;
- изменение настроения или ощущение спутанности сознания.
Лечащий врач расскажет Вам, как лечить низкий уровень сахара в крови и что делать, если у Вас появились какие-либо из перечисленных выше признаков.
Другие возможные нежелательные реакции, которые могут наблюдаться при приеме препарата Форсига
Часто (могут возникать не более чем у 1 человека из 10):
- генитальная инфекция (молочница) полового члена или влагалища (признаки могут включать раздражение, зуд, необычные выделения или запах);
- головокружение;
- сыпь;
- боль в спине;
- выделение большего количества воды (мочи), чем обычно, или необходимость более частого мочеиспускания;
- увеличение числа эритроцитов в крови (отмечают при анализе крови);
- снижение почечного клиренса креатинина (отмечают при проведении анализа) в начале лечения;
- изменение уровня холестерина или липидов (жиров) в крови (отмечают при анализе крови).
Нечасто (могут возникать не более чем у 1 человека из 100):
- грибковые инфекционные заболевания;
- выведение слишком большого количества жидкости из организма (обезвоживание, признаки которого могут включать ощущение сильной сухости или липкости во рту, небольшой объем выводимой мочи или отсутствие мочи или учащенное сердцебиение);
- жажда;
- запор;
- сухость во рту;
- пробуждение ночью для мочеиспускания;
- повышение уровня креатинина (отмечают при лабораторном анализе крови) в начале лечения;
- повышение уровня мочевины (отмечают при лабораторном анализе крови);
- снижение массы тела.
Очень редко (могут возникать не более чем у 1 человека из 10000):
- воспаление почек (тубулоинтерстициальный нефрит).
Если у Вас имеется любой из перечисленных симптомов, немедленно сообщите об этом лечащему врачу.
Сообщение о нежелательных реакциях
Если у Вас возникают какие-либо нежелательные реакции, проконсультируйтесь с врачом. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в листке-вкладыше. Вы также можете сообщить о нежелательных реакциях напрямую (см. ниже). Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
Российская Федерация
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор) 109012, г. Москва, Славянская площадь, д. 4, стр. 1
Тел.: +7 800 550 99 03
Электронная почта: pharm@roszdravnadzor.gov.ru Сайт: https://roszdravnadzor.gov.ru
Республика Армения
АОЗТ «Научный центр экспертизы лекарств и медицинских технологий им. академика Э. Габриеляна»
0051, г. Ереван, пр. Комитаса, 49/5
Тел. отдела мониторинга безопасности лекарственных средств: (+374 10) 200505, (+374 96) 220505
Электронная почта: vigilance@pharm.am
admin@pharm.am Сайт: https://www.pharm.am Республика Беларусь
УП «Центр экспертиз и испытаний в здравоохранении» 220037, г. Минск, Товарищеский пер., 2a
Тел. отдела фармаконадзора: +375 (17) 242 00 29
Факс: +375 (17) 242 00 29
Электронная почта: rcpl@rceth.by
rceth@rceth.by Сайт: http://www.rceth.by Республика Казахстан
РГП на ПХВ «Национальный центр экспертизы лекарственных средств и медицинских изделий» Комитета медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан
010000, г. Астана, ул. А. Иманова, д.13 Телефон: 8 (7172) 235 135
Эл. почта: pdlc@dari.kz Сайт: http://www.ndda.kz
-
5. Хранение препарата Форсига
Храните препарат в недоступном для ребенка месте так, чтобы ребенок не мог увидеть его. Не принимайте препарат после истечения срока годности (срока хранения), указанного на картонной пачке или блистере.
Датой истечения срока годности является последний день данного месяца. Храните при температуре не выше 30ºС.
Не выбрасывайте препарат в канализацию. Уточните у работника аптеки, как следует утилизировать (уничтожать) препарат, который больше не потребуется. Эти меры позволят защитить окружающую среду.
-
6. Содержимое упаковки и прочие сведения
Препарат Форсига содержит
Действующим веществом является дапаглифлозин. Форсига, 5 мг, таблетки, покрытые пленочной оболочкой
Каждая таблетка, покрытая пленочной оболочкой, содержит: дапаглифлозина пропандиола моногидрат 6,150 мг в пересчете на дапаглифлозин 5 мг.
Форсига, 10 мг, таблетки, покрытые пленочной оболочкой
Каждая таблетка, покрытая пленочной оболочкой, содержит: дапаглифлозина пропандиола моногидрат 12,30 мг, в пересчете на дапаглифлозин 10 мг.
Прочими ингредиентами (вспомогательными веществами) являются: целлюлоза микрокристаллическая, лактоза безводная, кросповидон, кремния диоксид, магния стеарат, Опадрай® II желтый [поливиниловый спирт частично гидролизованный, титана диоксид, макрогол 3350, тальк, краситель оксид железа желтый].
Препарат Форсига содержит лактозу (см. соответствующий подраздел раздела 2 листка- вкладыша).
Внешний вид препарата Форсига и содержимое упаковки
Таблетки, покрытые пленочной оболочкой, 5 мг:
Препарат представляет собой круглые двояковыпуклые таблетки, покрытые пленочной оболочкой желтого цвета, с гравировкой «5» на одной стороне и «1427» на другой стороне. (при производстве на предприятии АстраЗенека Фармасьютикалс ЛП, США):
по 10 таблеток в перфорированном блистере из алюминиевой фольги, сформированном из формовочного ламината, состоящего из полиамида / мягкой алюминиевой фольги / непластифицированной поливинилхлоридной (ПВХ) пленки, запечатанном закаленной алюминиевой фольгой, покрытой термолаком; по 3 перфорированных блистера с листком- вкладышем в картонной пачке с контролем первого вскрытия.
По 14 таблеток в блистере из алюминиевой фольги, сформированном из формовочного ламината, состоящего из полиамида / мягкой алюминиевой фольги / непластифицированной поливинилхлоридной (ПВХ) пленки, запечатанном закаленной алюминиевой фольгой, покрытой термолаком; по 1 или 2 блистера с листком-вкладышем в картонной пачке с контролем первого вскрытия.
Таблетки, покрытые пленочной оболочкой, 10 мг:
Препарат представляет собой ромбовидные двояковыпуклые таблетки, покрытые пленочной
оболочкой желтого цвета, с гравировкой «10» на одной стороне и «1428» на другой стороне.
(при производстве на предприятии АстраЗенека Фармасьютикалс ЛП, США):
по 10 таблеток в перфорированном блистере из алюминиевой фольги, сформированном из формовочного ламината, состоящего из полиамида / мягкой алюминиевой
фольги / непластифицированной поливинилхлоридной (ПВХ) пленки, запечатанном закаленной алюминиевой фольгой, покрытой термолаком; по 3 перфорированных блистера с листком-вкладышем в картонной пачке с контролем первого вскрытия.
По 14 таблеток в блистере из алюминиевой фольги, сформированном из формовочного ламината, состоящего из полиамида / мягкой алюминиевой фольги / непластифицированной поливинилхлоридной (ПВХ) пленки, запечатанном закаленной алюминиевой фольгой, покрытой термолаком; по 1 или 2 блистера с листком-вкладышем в картонной пачке с контролем первого вскрытия.
(при производстве на предприятии ООО «АстраЗенека Индастриз», Россия):
по 10 таблеток в блистере из алюминиевой фольги, сформированном из формовочного ламината, состоящего из полиамида / мягкой алюминиевой фольги / непластифицированной поливинилхлоридной (ПВХ) пленки, запечатанном закаленной алюминиевой фольгой, покрытой термолаком; по 3 или 9 блистеров с листком-вкладышем в картонной пачке с контролем первого вскрытия.
Держатель регистрационного удостоверения
Великобритания / United Kingdom
АстраЗенека ЮК Лимитед / AstraZeneca UK Limited
1 Френсис Крик Авеню, Кембридж Биомедикал Кампус, Кембридж, Великобритания CB2 0AA / 1 Francis Crick Avenue, Cambridge Biomedical Campus, Cambridge, United Kingdom CB2 0AA
Производитель
США / USA
АстраЗенека Фармасьютикалс ЛП / AstraZeneca Pharmaceuticals LP
4601 Хайуэй 62 Ист, Маунт Вернон, Индиана, 47620, США / 4601 Highway 62 East, Mount Vernon, Indiana, 47620, USA
Российская Федерация
Общество с ограниченной ответственностью «АстраЗенека Индастриз» (ООО «АстраЗенека Индастриз»)
249020, Калужская область, Боровский район, деревня Добрино, 1-ый Восточный проезд, владение 8
Выпускающий контроль качества
Великобритания / United Kingdom
АстраЗенека ЮК Лимитед / AstraZeneca UK Limited
Cилк Роуд Бизнес Парк, Макклcфилд, Чешир SK10 2NA / Silk Road Business Park,
Macclesfield, Cheshire SK10 2NA или
Российская Федерация
Общество с ограниченной ответственностью «АстраЗенека Индастриз» (ООО «АстраЗенека Индастриз»)
249020, Калужская область, Боровский район, деревня Добрино, 1-ый Восточный проезд, владение 8
или
Республика Казахстан
АО «Нобел Алматинская Фармацевтическая Фабрика» 050008, г. Алматы, Алмалинский район, ул. Шевченко 162 Е
За любой информацией о препарате, а также в случаях возникновения претензий следует обращаться к местному представителю держателя регистрационного удостоверения:
Российская Федерация, Республика Армения, Республика Беларусь ООО АстраЗенека Фармасьютикалз
123112, г. Москва, 1-й Красногвардейский проезд, д. 21, стр. 1, этаж 30, комнаты 13 и 14
Тел.: +7 (495) 799 56 99
Электронная почта:
в Российской Федерации: Safety.Russia@astrazeneca.com
ProductQuality.ru@astrazeneca.com в Республике Армения, Республике Беларусь:
Frontiers-PV@astrazeneca.com ProductQualityEurasia@astrazeneca.com
Республика Казахстан
Представительство ЗАК «АстраЗенека Ю-Кей Лимитед» 050000, г. Алматы, ул. Кунаева, д. 77, офис 101
Тел.: +7 727 232 14 15; +7 701 0326745
Электронная почта: adverse.events.kz@astrazeneca.com
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.
Автор статьи
Ибраева Екатерина Анатольевна
,
Профессия: провизор
Название вуза: Пермская государственная фармацевтическая академия (ПГФА)
Специальность: фармация
Стаж работы: 6 лет
Диплом о фармацевтическом образовании: 105924 3510869 рег. номер 31955
Места работы: преподаватель ПГФА на кафедре Управления и экономики фармации, провизор в аптеке, заведующая аптекой, провизор сервиса Мегаптека
Все авторы
Содержание
- Форсига: МНН
- Форсига: действующее вещество
- Форсига: от чего помогает
- Форсига: противопоказания
- Форсига: побочные действия
- Джардинс или Форсига: что лучше?
- Суглат или Форсига: что лучше?
- Форсига или Галвус: что лучше?
- Краткое содержание
По оценкам Всемирной организации здравоохранения в 2019 г. от диабета и вызванных им заболеваний почек умерло 2 миллиона человек. Диабет — хроническое заболевание, которое подразделяют на 2 типа: когда поджелудочная железа вырабатывает мало инсулина (1 тип) или когда организм использует вырабатываемый инсулин неэффективно (2 тип).
Сахарный диабет 2 типа (СД2) поддается лечению. Если соблюдать здоровое питание, отказаться от курения, поддерживать регулярную физическую активность и нормальный вес тела, то можно предотвратить или отсрочить возникновение диабета 2 типа.
В терапии диабета важны правильное медикаментозное лечение и регулярный контроль, а также предупреждение развития осложнений. Пользователи сайта задают вопросы про лекарство Форсига от диабета. Провизор Кристина Хохрина рассказывает о Форсиге: для чего его назначают, действующем веществе, противопоказаниях и побочных действиях. А также сравнивает с противодиабетическими средствами Джардинс, Суглат и Галвус.
Форсига: МНН
Международные непатентованное название препарата (МНН): дапаглифлозин. В России зарегистрирован у Форсиги только один полный аналог по действующему веществу — это Дапаглифлозин Канон.
Форсига: состав
Препарат Форсига выпускается в таблетках, покрытых оболочкой. В их состав входит 5 или 10 мг активного вещества и вспомогательные компоненты: целлюлоза, лактоза, кросповидон, кремния диоксид и магния стеарат.
Форсига: действующее вещество
Действующее вещество в Форсиге согласно РЛС (Регистр лекарственных средств) — дапаглифлозина пропандиола моногидрат. Это вещество с инновационным инсулиннезависимым механизмом действия на уровне почек. Форсига снижает обратное всасывание глюкозы в почечных канальцах, повышает ее содержание в моче и выводит избыток из организма.
Высокая концентрация глюкозы и натрия увеличивает объем выводимой мочи (осмотический диурез). Это приводит к снижению артериального давления, уменьшает преднагрузку и постнагрузку на сердце и сохраняет функцию почек.
Другие эффекты Форсиги — это повышение концентрации эритроцитов в крови и снижение массы тела.
Форсига: от чего помогает
Провизор отвечает на вопрос: «Форсига — лекарство от чего?»:
1. Форсига назначается в дополнение к диете и физической нагрузке при СД2.
- при непереносимости метформина
- в комбинации с метформином и другими гипогликемическими средствами при отсутствии адекватного контроля уровня глюкозы на этих препаратах
- при целесообразности стартовой терапии вместе с метформином
2. Форсига при сердечной недостаточности (установленной) и рисках (пожилой возраст, гипертензия, дислипидемия, курение) назначается для предупреждения госпитализации и смерти по поводу сердечно-сосудистых заболеваний.
3. При хронической болезни почек для снижения риска ее прогрессирования, госпитализации и смерти от сердечной недостаточности.
Форсига: противопоказания
При каких состояниях и болезнях нельзя принимать препарат:
- гиперчувствительность к дапаглифлозину и вспомогательным компонентам
- сахарный диабет 1 типа
- диабетический кетоацидоз
- нарушения в работе почек
- хроническая болезнь почек, требующая проведения диализа
- беременность и лактация
- детский возраст до 18 лет
Форсига: побочные действия
Форсига — препарат с доказанной эффективностью и безопасностью. Были проведены клинические исследования дапаглифлозина при применении для терапии СД2, хронической сердечной недостаточности и хронической болезни почек во время пострегистрационного наблюдения.
Профиль безопасности по изучаемым показателям был сопоставим. Гипогликемия и кетоацидоз наблюдались только у пациентов с сахарным диабетом. Побочные эффекты не зависели от дозы препарата. Наиболее часто встречались:
- головокружение
- гипогликемия при комплексной терапии с другими сахароснижающими препаратами
- сыпь
- боль в спине
- нарушения мочеиспускания
- изменения показателей крови
- вульвовагинит, инфекции генитальные и мочевыводящих путей
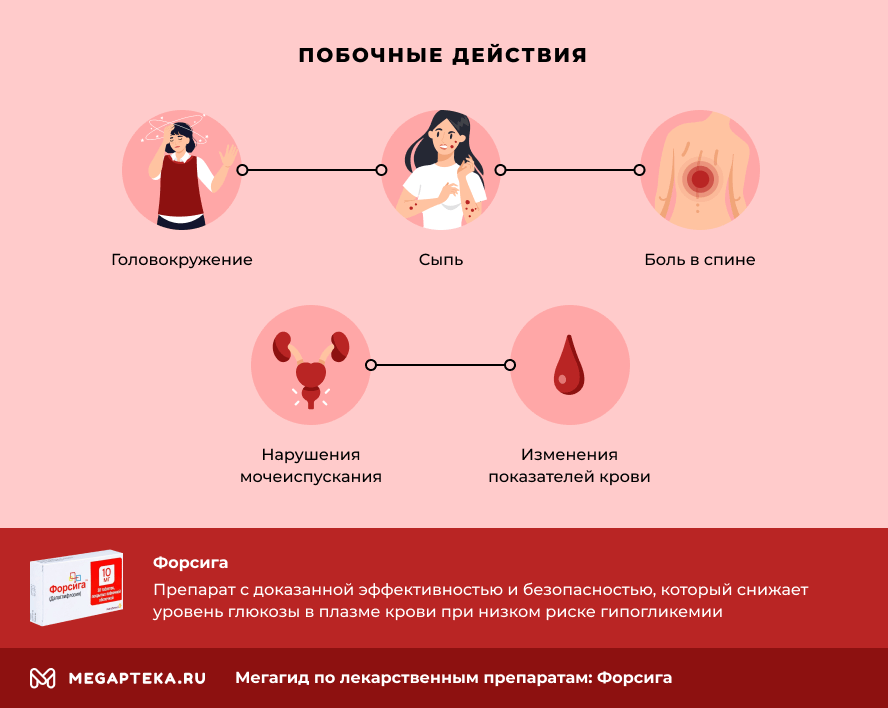
Джардинс или Форсига: что лучше?
Чем Форсига отличается от Джардинса? Прежде всего действующим веществом и дозировками: активное вещество в Джардинсе — эмпаглифлозин, которого содержится таблетках 10 мг или 25 мг.
Эмпаглифлозин и дапаглифлозин имеют одинаковый механизм действия, но Форсига достигает терапевтического эффекта в меньшей дозировке и имеет меньше риска развития негативных реакций. Для назначения дапаглифлозина (Форсига) не требуется коррекции дозы при печеночной недостаточности легкой и средней степени тяжести, а при тяжелой возможен прием под контролем врача. Для Джардинса тяжелая печеночная недостаточность — противопоказание. Кроме этого, Джардинс не применяют при хронической болезни почек для снижения риска госпитализации и смерти.
Действие обоих препаратов не зависит от выработки инсулина. Поэтому лекарства не создают риска гипогликемии. А выведение лишней глюкозы с почками ведет к потере калорий и уменьшению жировой ткани и веса пациента. Провизор обращает внимание, что ни Джардинс, ни Форсига для похудения не применяют! В инструкциях к препаратам нет такого показания, а самолечение опасно для здоровья. К тому же препараты снижают вес умеренно.
Суглат или Форсига: что лучше?
В состав препарат Суглат входит ипраглифлозин с таким же механизмом действия, как у Форсиги. Это тоже пероральное гипогликемическое средство — ингибитор переносчика глюкозы. Дозировка таблеток Суглата 50 мг. Их объединяет с Форсигой эффект от применения:
- повышение экскреции глюкозы с мочой
- уменьшение концентрации глюкозы в плазме крови
- снижение артериального давления
- потеря калорий и массы тела
Суглат показан только для терапии сахарного диабета. Противопоказаний у него больше, чем у Форсиги
Форсига или Галвус: что лучше?
Действующее вещество препарата Галвус — это вилдаглиптин, который назначают при СД2 для контроля уровня глюкозы в крови при неэффективности диеты и физических нагрузок. У Галвуса иной механизм действия: он снижает синтез глюкагона, который стимулирует синтез глюкозы в печени.
Показания к применению Галвуса — это сахарный диабет 2 типа в сочетании с диетотерапией и физическими упражнениями. Назначают его как монопрепарат или в комбинации с инсулином, метформином и другими препаратами.
Сравнивать Форсигу и Галвус нецелесообразно. Выбор терапии должен сделать лечащий врач.
Краткое содержание
- В состав Форсиги входит дапаглифлозин в дозировках 5 и 10 мг. Это гипогликемический препарат для перорального применения.
- Форсига — препарат с доказанной эффективностью и безопасностью: исследования доказали, что он снижает уровень глюкозы в плазме крови при низком риске гипогликемии.
- Преимущества Форсиги заключаются в том, что он снижает артериальное давление, риск развития инфаркта и инсульта, защищает почки. Способствует потере калорий и умеренному снижению веса.
- Аналоги Джардинс и Суглат содержат действующие вещества с таким же механизмом действия, что и Форсига. Показаний к применению у аналогов меньше.
- Галвус относится к другой группе сахароснижающих препаратов, он действует на клетки поджелудочной железы и уменьшает выработку глюкагона и синтез глюкозы в печени.
- Выбор препарата для пациентов с СД2 делает лечащий врач в индивидуальном порядке.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же вы можете поделиться своим опытом с другими читателями Мегасоветов.
от 2 747 ₽
от 2 506 ₽
