УДК 616.72-002
Е. А. Замятина, Г. Г. Багирова
ПРИМЕНЕНИЕ МЕЛОКСИКАМА (МОВАЛИСА)
И АЦЕКЛОФЕНАКА (АЭРТАЛА) У ЛИЦ ПОЖИЛОГО ВОЗРАСТА С ОСТЕОАРТРОЗОМ
Аннотация. В работе приведены данные клинического исследования лиц пожилого возраста с остеоартрозом (средний возраст 64,4 ± 7,8), принимавших мелоксикам (мовалис) или ацеклофенак (аэртал). Мелоксикам (мовалис) назначался в дозе 7,5 мг два раза в сутки в течение 10 дней, ацеклофенак (аэртал) — в дозе 100 мг два раза в сутки в течение такого же периода времени. Больные подвергались стандартным артрологическим и параклиническим исследованиям. Было проведено рентгенологическое и ультразвуковое исследование пораженных суставов. Состояние всех больных оценивалось по шкалам ВАШ и WOMAC, определялся индекс тяжести артроза. После проведенного лечения все больные отмечали уменьшение боли и отека в пораженных суставах. Все изучаемые показатели в обеих группах достоверно снизились практически в равной степени. Сравнение этих двух препаратов показало аналогичную эффективность в отношении уменьшения боли и воспалительных явлений в суставе, их хорошую переносимость больными и наличие единичных случаев неблагоприятных эффектов.
Ключевые слова: остеоартроз, лечение, мелоксикам, ацеклофенак.
Abstract. The research includes data of the clinical examination of elderly people with osteoarthritis (фпу average 64,4 ± 7,8) taking Meloxicam (movalis) and Aceclofenac (Airtal). Meloxicam (movalis) has been prescribed 7,5 mg 2 times a day for
10 days, Aceclofenac (Airtal) — 100 mg 2 times a day for the same period of time. Patients underwent standard arthrological and paraclinical examinations. Roentgenological and ultrasonic examinations of the affected joints were also carried out. The state of the patients has been evaluated according to VAS and WOMAC scales, defining the index of arthrosis. After the given treatment the patients has noticed the reduce of pain and edema of the affected joints. All the indices under study have reduced equally in both groups. The comparison of these two medicines shows efficiency in treatment of pain and edema of the affected joints, good tolerance and single cases of unfavorable effects.
Key words: osteoarthritis, treatment, Meloxicam, Aceclofenac.
Заболевания опорно-двигательного аппарата принадлежат к числу наиболее распространенных у лиц пожилого и старческого возраста. Среди них самым частым является остеоартроз (ОА). Заболевание встречается у 6070 % больных старше 65 лет, причем чаще у женщин. Поражаются главным образом нагрузочные суставы, такие как коленные и тазобедренные [1-5]. Возникающая боль приносит физические страдания, ограничивает способность к передвижению и самообслуживанию, ухудшает качество жизни, нередко приводя к инвалидизации пожилых больных [6]. Лечение этих заболеваний связано с существенными экономическими затратами. Поэтому максимально быстрое купирование боли является основной целью лечения [7]. При этом необходимо подбирать индивидуальную схему лечения для каждого пациента с учетом тяжести заболевания, распространенности поражения суставов, сопутствующих заболеваний и возраста [8, 9].
Наиболее часто в лечении болевого синдрома используются препараты из группы нестероидных противовоспалительных препаратов (НПВП) [10, 11]. Их использование в составе комплексной терапии ОА позволяет достичь быстрого симптоматического улучшения и обеспечить больному комфортное ожидание начала действия «хондропротекторов» и немедикоментозных методов лечения [12]. Однако применение лекарственных средств из этой группы может сопровождаться рядом нежелательных лекарственных реакций [13, 14]. Поэтому при их выборе учитываются: быстрота развития и выраженности эффекта, хорошая переносимость при длительном приеме [15-17]. У лиц пожилого возраста выбор препарата затрудняет наличие у них сопутствующих заболеваний и необходимость их терапии. Также нередко упускают из вида, что НПВП, мало влияя на артериальное давление (АД) у пациентов с его исходно нормальными показателями, достоверно повышают среднее АД у больных с артериальной гипертензией [18]. Это требует применения препаратов с наименьшим спектром побочных эффектов, таких как НПВП с более высокой селективностью [19].
Материал и методы
В исследование было включено 60 женщин в возрасте от 60 до 79 лет, разделенных на две группы: I группа — 30 женщин, средний возраст 63,4 ± 6,8 лет, принимавших в течение 10 дней мовалис; II группа — 30 женщин, средний возраст 65,4 ± 7,7 лет, принимавших в течение 10 дней аэртал. У всех пациентов имелась в анамнезе артериальная гипертензия.
Больные обратились в поликлинику по поводу болей в коленных и тазобедренных суставах. Пациенты жаловались на боли при движении, особенно при спуске по лестнице, припухлость суставов. Больные подвергались стандартным артрологическим и параклиническим исследованиям. Всем было проведено рентгенологическое исследование. Рентгенологическую стадию оценивали по классификации L. Kellgren и L. Lowrens. Для уточнения характера процесса обследуемым было проведено ультразвуковое исследование пораженных суставов.
Мелоксикам (мовалис) назначался в дозе 7,5 мг два раза в сутки в течение 10 дней. Ацеклофенак (аэртал) — в дозе 100 мг два раза в сутки также в течение 10 дней. Состояние больных до и после лечения оценивалось по шкалам ВАШ и WOMAC, и определялся индекс тяжести артроза.
Статистическая обработка данных проводилась на компьютере с помощью программы Statistica 6.0 (StatSoft, США). Количественные данные представлены в следующем виде: средние значения плюс-минус стандартное отклонение (SD).
Результаты исследования
При обследовании суставов было выявлено увеличение их объема у всех пациентов, локальная болезненность по внутренней поверхности коленного сустава — у 80 % больных и в 100 % случаев ограничение активных и пассивных движений в пораженном суставе. По данным рентгенологического исследования, I рентгенологическая стадия отмечалась у 14 (23,4 %) больных, II — у 25 (41,6 %), III — у 21 (35 %). При ультразвуковом исследовании в 83 % случаев выявлено наличие синовита, преимущественно в надпателярной сумке и заворотах коленного сустава, и в 78 % — в сумке m. Ileopsoas в тазобед-
ренных суставах. У 100 % пациентов определялся тендинит, преимущественно тонкой мышцы и медиальной головки икроножной мышцы, из них в 15 % случаев выявлялся теносиновит этих мышц. В 8 % случаев был обнаружен лигаментит собственной и боковых связок надколенника. У 20 % были выявлены кисты Бейкера.
До начала лечения состояние всех больных было оценено по шкалам ВАШ и WOMAC и определялся индекс тяжести артроза (табл. 1, 2).
Таблица 1
Динамика клинических показателей у больных пожилого возраста с ОА, получавших мовалис (п = 30; M ± SD)
Показатель До лечения После лечения P
Боль по ВАШ, мм 7,5 ± 1 4,5 ± 1,2 < 0,0001
Суммарный индекс WOMAC, см 151,8 ± 44,2 126,5 ± 39,5 < 0,0001
Индекс тяжести артроза, баллы 15,1 ± 3,8 10,9 ± 3,3 < 0,0001
Таблица 2
Динамика клинических показателей у больных пожилого возраста с ОА, получавших аэртал (п = 30; M ± SD)
Показатель До лечения После лечения P
Боль по ВАШ, мм 7,4 ± 1,2 5 ± 1,2 < 0,0001
Суммарный индекс WOMAC, см 149 ± 39,6 125,9 ± 38,3 < 0,0001
Индекс тяжести артроза, баллы 15 ± 3,6 11,3 ± 3,4 < 0,0001
Из таблиц следует, что до начала лечения показатели в обеих группах существенно не различались. После проведенного лечения все больные отмечали уменьшение боли и отека в пораженных суставах. Все показатели в обеих группах достоверно снизились и также имели сходное значение. Нежелательных реакций, которые могли бы послужить причиной отмены препаратов, зарегистрировано не было. По мнению больных, переносимость препаратов была хорошей. Лишь у двух больных из I группы и одного больного из
II группы было отмечено незначительное повышение артериального давления на фоне антигипертензивной терапии.
Сравнение этих показателей после лечения между группой, принимающей мелоксикам (мовалис), и группой, принимающей ацеклофенак (аэртал), не показало достоверных отличий (табл. 3).
Таблица 3
Сравнительная характеристика клинических показателей между мовалисом и аэрталом после лечения у больных пожилого возраста с ОА (п = 30; M ± SD)
Показатель Мовалис Аэртал P
Боль по ВАШ, мм 4,5 ± 1,2 5 ± 1,2 > 0,05
Суммарный индекс WOMAC, см 126,5 ± 39,5 125,9 ± 38,3 > 0,05
Индекс тяжести артроза, баллы 10,9 ± 3,3 11,3 ± 3,4 > 0,05
Обсуждение
В настоящее время известно, что назначение НПВП показано всем больным с ревматическими заболеваниями [20]. Однако назначение этих пре-
паратов сопряжено с риском развития нежелательных эффектов, особенно у лиц пожилого возраста в связи с наличием у них сопутствующей патологии. В этом случае необходимо учитывать возможность лекарственных взаимодействий. Поэтому при выборе препарата необходимо свести эти риски к минимуму, но при этом уменьшить боль и купировать воспалительные явления в суставе [21]. В данной работе мы провели сравнение двух препаратов, имеющих различные механизмы действия, на воспаление.
Мелоксикам — НПВП, относящийся к классу оксикамов, оказывающий анальгетическое, противовоспалительное и жаропонижающее действие [22]. Он является селективным ингибитором ЦОГ-2. Он связывается с верхней частью канала ЦОГ-2 и имеет сбалансированный профиль ЦОГ-2-селекти-вности [21, 23]. В результате синтез простагландинов снижается в очаге воспаления в значительно большей степени, чем в слизистой оболочке желудка и почках. Помимо влияния на синтез простагландинов, мелоксикам угнетает перекисное окисление липидов, снижает образование свободных кислородных радикалов, фактора активации тромбоцитов, фактора некроза опухоли-a, протеиназ и других медиаторов воспаления. Мелоксикам не взаимодействует с другими лекарственными средствами, включая цитостатики, диуретики, сердечные гликозиды, адреноблокаторы, что имеет большое значение при ведении больных с сопутствующими заболеваниями [24]. Многочисленные исследования о хондропротективном влиянии мелоксикама показали, что он повышает синтез протеогликанов в эксплантанте остеоартрозного хряща, а также тормозит апоптоз хондроцитов. Кроме того, мелоксикам не экспрессирует противоспалительные цитокины [25]. Это позволяет рассматривать его как НПВП с хондропротективным действием. Однако стоимость препарата достаточно высока (на 2011 г. — около 500 руб. за 20 таблеток).
Таким образом, наличие у мелоксикама хорошего противовоспалительного, аналгезирующего и хондропротективного действия, а также хорошая переносимость позволяют его широко использовать у больных ОА [8].
Ацеклофенак (аэртал) относится к неселективным НПВП. Он ингибирует обе изоформы ЦОГ. Коэффицент ЦОГ-2/ЦОГ-1, т.е. средняя ингибирующая концентрация для ацеклофенака, равняется 0,26 мкМ, тогда как для це-лекоксиба этот коэффицент равен 0,70 мкМ, т.е. он может считаться более селективным в отношении ЦОГ-2 [26-28]. Подтверждением селективности ацеклофенака стала работа B. Hinz и соавторов, которые определяли выраженность блокады ЦОГ-2 и ЦОГ-1 в нейтрофилах человека под влиянием ацеклофенака 100 мг и диклофенака 75 мг. Оказалось, что после приема обоих препаратов активность ЦОГ-2 была подавлена более чем на 97 %, в то время как ЦОГ-1 — на 46 и 82 % соответственно [29]. Помимо блокады ЦОГ-2, ацеклофенак влияет на синтез цитокинов, таких как интерлейкин-1 (ИЛ-1) и фактор некроза опухоли а (ФНО а) [26]. Кроме того, он подавляет процесс ИЛ-1-ассоциированной активации металлопротеиназ, что является одной из причин положительного воздействия ацеклофенака на синтез протеогликанов суставного хряща. Ацеклофенак способствует экспрессии протеогликанов и гиалуроновой кислоты как в преклинической, так и в поздней стадии ОА. Он стимулирует синтез гликозаминогликанов в хряще у больных ОА с диклофе-наком и напроксеном, которые не обладают такими свойствами [2]. Это свойство относится к числу главных достоинств ацеклофенака и определяет целе-
сообразность его применения у больных ОА [2, 30, 31]. L. Blot и соавторы изучили действие ацеклофенака, мелоксикама и диклофенака (контроль) на метаболизм вновь синтезированных молекул протеогликана и гиалуроната в эксплантантах хряща человека, пораженного ОА. Результаты исследования показали, что ацеклофенак и мелоксикам в концентрации, соответствующей их содержанию в синовиальной жидкости, могут оказывать положительное действие на общий метаболизм протеогликанов и гиалуроната в хрящевой ткани при ОА, тогда как диклофенак не оказывал подобного влияния на метаболизм хряща. Это говорит о том, что ацеклофенак и мелоксикам не должны ухудшить биомеханические характеристики сустава и, возможно, способны замедлить разрушение суставов при остеоартрозе [27, 32]. Еще одним преимуществом препарата является умеренная стоимость, что немаловажно для пожилых больных (на 2011 г. — около 300 руб. за 20 таблеток).
В нашем исследовании сравнение этих двух препаратов показало сходную эффективность в отношении уменьшения боли и воспалительных явлений в суставе, их хорошую переносимость больными и наличие минимального количества неблагоприятных эффектов.
Таким образом, применение мелоксикама (мовалиса) и ацеклофенака (аэртала) у больных пожилого возраста с ОА приводит к достоверному стойкому уменьшению болевого синдрома и воспалительных явлений в суставе при хорошей переносимости препарата, и поэтому выбор препарата часто будет определяться его стоимостью.
Список литературы
1. Насонов, Е. Л. Современные направления в фармакотерапии остеоартроза / Е. Л. Насонов // Consilium medicus. — 2001. — № 3. — Р. 408-415.
2. Бадокин, В. В. Нестероидные противовоспалительные препараты в терапии остеоартроза / В. В. Бадокин // Современная ревматология. — 2009. — № 1. — С. 73.
3. Цветкова, Е. С. Мовалис в терапии остеоартроза / Е. С. Цветкова // Научнопрактическая ревматология. — 2005. — № 2. — С. 29.
4. Алексеева, Л. И. Факторы риска при остеоартрозе / Л. И. Алексеева // Научнопрактическая ревматология. — 2000. — № 2. — С. 36.
5. Беневолевская, Л. И. Факторы, способствующие развитию остеоартроза / Л. И. Беневолевская, Н. В. Подчалимова, М. М. Бржезовский и др. // Терапевтический архив. — 1987. — № 4. — С. 35.
6. Насонов, Е. Л. Болевой синдром при патологии опорно-двигательного аппарата / Е. Л. Насонов // Врач. — 2002. — № 4. — С. 15.
7. Насонова, В. А. Мелоксикам (мовалис) — селективный ингибитор ЦОГ-2
в клинической практике / В. А. Насонова // Научно-практическая ревматология. -2000. — № 4. — С. 16.
8. Елисеев, М. С. Применение мелоксикама (амелотекс) у больных гонартрозом / М. С. Елисеев, С. А. Владимиров // Современная ревматология. — 2011. — № 2. -С. 31.
9. Мазуров, В. И. Применение мелоксикама (мовалиса) у больных с ревматическими заболеваниями с сопутствующей ишемической болезнью сердца / В. И. Мазуров // Клиническая медицина. — 2004. — № 12. — С. 54.
10. Алексеева, Л. И. Современные подходы к лечению остеоартроза / Л. И. Алексеева // Российский медицинский журнал. — 2003. — № 11 (4). — С. 5.
11. Каратеев, А. Е. Применение нестероидных противовоспалительных препаратов / А. Е. Каратеев, Н. Н. Яхно, Л. Б. Лазебник и др. // Клинические рекомендации. — М. : ИМА-ПРЕСС, 2009. — С. 168.
12. Каратеев, А. Е. Нестероидные противовоспалительные препараты в современной клинической практике: «за» больше, чем «против» / А. Е. Каратеев // Современная ревматология. — 2008. — № 1. — С. 70.
13. Верткин, А. Л. Деформирующий остеоартроз: стратегия ведения больных при соматической патологии / А. Л. Верткин, А. В. Наумов // Российский медицинский журнал. — 2007. — Т. 15, № 4. — С. 319-324.
14. Верткин, А. Л. Остеоартроз в практике врача-терапевта / А. Л. Верткин, Л. И. Алексеева, А. В. Наумов и др. // Российский медицинский журнал. — 2008. -Т. 16, № 7. — С. 478-480.
15. Насонов, Е. Л. Применение нестероидных противовоспалительных препаратов в медицине в начале XXI века / Е. Л. Насонов // Российский медицинский журнал. — 2003. — № 11. — Р. 375-378.
16. Emery, P. Considerations for nonsteroidal anti-inflammatory drug therapy: benefits / P. Emery // Scand J. Rheumatol. — 1996. — № 25 (Suppl. 105). — Р. 5-12.
17. Rainsford, K. Anti-inflammatory drugs in the 21st century / K. Rainsford // Subcell Biochem. — 2007. — № 42. — Р. 3-27.
18. Егоров, И. В. Особенности лечения суставного синдрома у лиц пожилого возраста с артериальной гипертензией / И. В. Егоров, В. В. Цурко // Современная ревматология. — 2008. — № 4. — С. 52.
19. Зырянов, С. К. Безопасность фармакотерапии боли: современное состояние проблемы / С. К. Зырянов, О. Н. Нельга, Ю. Б. Белоусов // Трудный пациент. -2007. — № 3. — С. 54.
20. Каратеев, А. Е. Критерии выбора нестероидного противовоспалительного препарата / А. Е. Каратеев, В. Г. Барскова // Справочник поликлинического врача. -2007. — № 5. — С. 44.
21. Чичасова, Н. В. Мелоксикам в лечении хронических заболеваний опорнодвигательного аппарата / Н. В. Чичасова // Лечащий врач. — 2011. — № 4. — С. 26.
22. Хитров, Н. А. Лечение болевого синдрома при остеоартрозе / Н. А. Хитров // Современная ревматология. — 2009. — № 2. — С. 48.
23. Yocum, D. Safety and efficacy of meloxicam in the treatment of osteoarthritis: a 12-week, double-blind, multiple doses, placebo controlled trial. The Meloxicam Osteoarthritis Investigators / D. Yocum, R. Fleishmann, P. Dalgin et al. // Arch. Int. Med. -2000. — V. 160. — P. 2947-2954.
24. Бадокин, В. В. Применение мелоксикама при ревматических заболеваниях / В. В. Бадокин // Фарматека. — 2005. — № 13. — С. 1-8.
25. Ding, C. Do NSAID affect the progression of osteoarthritis? / C. Ding // Inflammation. — 2002. — № 26. — Р. 139-142.
26. Saraf, S. Aceclofenac: A potentNon-Steroidal Anti-Inflammatory Drug / S. Saraf // Latest Reviews. — 2006. — № 4 (3).
27. Цурко, В. В. Ацеклофенак (аэртал): экспериментальные данные и результаты клинических исследований при суставном синдроме / В. В. Цурко // Клиническая фармакология и терапия. — 2009. — № 1. — С. 62-65.
28. Lidburg, P. COX-2/COX-1 selectivity of aceclofenac in comparison whith celecox-ib and rofecoxib in the human whole blood assay / P. Lidburg, I. Vojnovic, T. Warner // Osteoarthritis and cartilage. — 2000. — № 8 (Suppl. B), TH0 53.
29. Hinz, B. Aceclofenac spares cyclooxygenase 1 as a resalt of limited but sustained biotransformation to diclofenac / B. Hinz, T. Rau, D. Augel et al. // Clinical Pharmacology & Therapeutics. — 2003. — № 74. — Р. 222-235.
30. Насонова, В. А. Ацеклофенак (аэртал) в ревматологической практике / В. А. Насонова // Терапевтический архив. — 2005. — Т. 77, № 5. — Р. 87-90.
31. Насонова, В. А. Симптоматическая терапия боли при ревматических заболеваниях: место ацеклофенака / В. А. Насонова, А. Е. Каратеев // Современная ревматология. — 2009. — № 3. — С. 58.
32. Blot, L. Effects of diclofenac, aceclofenac and meloxicam on the metabolism of proteoglycans and hyaluronan in osteoarthritic human articular cartilage / L. Blot, A. Marselis, J.-P. Devogelaer, D.-H. Manicourt // Br. J. Pharmacol. — 2000. — № 131. -Р. 1413-1421.
Замятина Екатерина Александровна аспирант, Оренбургская государственная медицинская академия
E-mail: zamyatina.katerina@yandex. ru
Багирова Генриетта Георгиевна доктор медицинских наук, профессор, заведующая кафедрой поликлинической терапии, Оренбургская государственная медицинская академия
E-mail: [email protected]
Zamyatina Ekaterina Alexandrovna Postgraduate student, Orenburg State Medical Academy
Bagirova Genrietta Georgievna Doctor of medical sciences, professor, head of sub-department of polyclinic therapy, Orenburg State Medical Academy
УДК 616.72-002 Замятина, Е. А.
Применение мелоксикама (мовалиса) и ацеклофенака (аэртала) у лиц пожилого возраста с остеоартрозом / Е. А. Замятина, Г. Г. Багирова // Известия высших учебных заведений. Поволжский регион. Медицинские науки. — 2012. — № 1 (21). — С. 40-46.
Статья посвящена анализу литературных данных, описывающих результаты экспериментальных и клинических исследований эффективности и безопасности ацеклофенака (Аэртала), представителя неселективных НПВС. Представлены данные по применению ацеклофенака у пациентов с остеоартрозом, ревматоидным артритом, спондилоартритом и при остром и хроническом болевых синдромах.
Нестероидные противовоспалительные средства (НПВС) заняли большую нишу среди используемых в клинической практике препаратов. Уникальность их свойств (обезболивающее, жаропонижающее, противовоспалительное, иммуномодулирующее) определяет использование препаратов данной группы врачами различных специальностей.
НПВС – лекарственные средства первого ряда в купировании болевых синдромов различной природы. НПВС активно назначаются для купирования симптомов воспаления в ревматологии, неврологии, гинекологии. При использовании НПВС наряду с оценкой эффективности всегда стоит проблема безопасности применения, риска развития побочных эффектов.
Механизм действия НПВС связан с подавлением активности изоферментов циклооксигеназы (ЦОГ) – ЦОГ-1 и ЦОГ-2. В зависимости от избирательности подавления этих изоферментов НПВС разделили на препараты, которые блокируют оба изофермента – неселективные ингибиторы, и блокирующие преимущественно ЦОГ-1 или ЦОГ-2 – селективные ингибиторы. Риск развития наиболее опасных побочных эффектов НПВС – гастропатии и сердечнососудистых осложнений зависит от селективности препаратов. Подавление активности ЦОГ-1 приводит к нарушению синтеза физиологически значимых простагландинов и развитию повреждения органов, функции которых ими регулируются – желудочно-кишечного тракта, печени, почек. В клинической практике часто используются неселективные ингибиторы ЦОГ. Поэтому появление новых или возвращение на фармацевтический рынок страны ранее присутствовавших препаратов, относящихся к НПВС, всегда требует анализа литературных данных об их эффективности и безопасности в различных клинических ситуациях.
Ацеклофенак Аэртал известен белорусским врачам более 10 лет. Однако длительное время препарат был недоступен для клинической практики. Возвращение оригинального ацеклофенака под торговым названием Аэртал, ОАО «Гедеон Рихтер», и возможность его широкого применения делает актуальным обзор литературы, позволяющий представить данные о клинической эффективности и безопасности препарата.
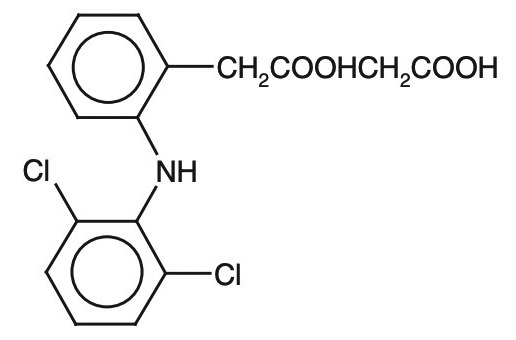
Ацеклофенак Аэртал (2-((2,6-дихлорфенил) амино)-фенил) ацетоксиацетиловой кислоты) имеет структурное сходство с хорошо известным и широко применяемым препаратом диклофенаком. Химическая структура препаратов представлена на рис. 1, 2.
Ацеклофенак Аэртал обладает высокой биодоступностью, быстро и полностью всасывается после перорального приема, что позволяет достигнуть пиковой концентрации в плазме через 1–3 часа.
В человеческом организме он практически полностью метаболизируется в печени, с образованием биологически активного 4-гидроксиацеклофенака (основной метаболит), диклофенака и 4-гидрокси-диклофенака (около 5% от введенной дозы).
Период полувыведения ацеклофенака составляет 4 часа, 70–80% экскретируется с мочой, около 20% – с калом [1, 2].
Ингибирование ЦОГ-1, ЦОГ-2 и синтеза простагландинов – ключевой механизм терапевтической эффективности НПВС и развития побочных эффектов. По данным Saraf S., соотношение ингибирующих концентраций ЦОГ-2/ЦОГ-1 у ацеклофенака составляет 0,26, – это меньше, чем у эталонного селективного ингибитора ЦОГ-2 целекоксиба, – 0,7, но больше, чем у рофекоксиба, – 0,12 [3].
В исследовании, проведенном на эндотелиальных клетках бычьей аорты, было установлено, что для ингибирования ЦОГ-2 и ЦОГ-1 необходимы гораздо меньшие концентрации ацеклофенака, чем с индометацином [4]. Ацеклофенак избирательно ингибирует активность ЦОГ- 2 в неизмененных хондроцитах и хондроцитах при остеоартрозе (ОА) [5], а также образование ПГ Е2 в синовиальной жидкости пациентов с острым процессом в коленных суставах при ревматоидном артрите (РА). В исследовании использованы суточные дозы ацеклофенака – 75 мг и диклофенака – 50 мг. Ацеклофенак существенно подавлял образование ПГ Е2 (р<0,05), диклофенак не влиял на этот процесс (р>0,05) [6].
Противовоспалительные эффекты ацеклофенака связаны не только с ингибированием образования ПГ Е2, но и ИЛ-1β и ФНО-α, синтезируемых синовиоцитами [7–9].
Под влиянием ИЛ-1β и ФНО-α в хрящевой и костной тканях увеличивается синтез оксида азота, усиливающего катаболические процессы в хрящевой ткани при ОА и оказывающего провоспалительные эффекты в кости. Было установлено, что ацеклофенак, в отличие от пироксикама, в концентрациях 5 μg /мл и 10 μg/мл на 40 и 70% соответственно подавляет интерлейкин-стимулированный синтез оксида азота человеческими хондроцитами [10].
Имеются литературные данные о том, что НПВС могут нарушать метаболизм хрящевой ткани, ослабляя процессы синтеза и усиливая процессы деградации суставного хряща. Ацеклофенак Аэртал в дозах 0,4–10 μg/мл значительно увеличивает синтез гликозаминогликанов (ГАГ) в хрящевой ткани пациентов с ОА и снижает ингибиторный эффект ИЛ-1. Для сравнения: диклофенак в сходных концентрациях не влияет на этот процесс, а напроксен в дозах 5–100 μg/мл значительно ингибирует синтез ГАГ в хрящевой ткани больных ОА [11]. Усиление синтеза ГАГ, блокируемого ИЛ-1, зависит от присутствия ростового фактора IGF-1 [12].
В исследованиях in vitro было показано, что ацеклофенак и мелоксикам, в отличие от диклофенака, дозозависимо увеличивают синтез протеогликанов и гиалуронана в хрящевых клетках пациентов с ОА [13].
Терапевтический эффект ацеклофенака Аэртал при РА и ОА может быть также связан со снижением базальной или ИЛ-1β стимулированной продукции про-MMP-1 и про-ММР-3. Подобное действие характерно для основного метаболита ацеклофенака – 4-ОН-aceclofenac [14].
Суммируя представленные в литературе данные, можно отметить следующие фармакологические эффекты ацеклофенака: подавление экспрессии ЦОГ-2, угнетение синтеза простагландинов, ингибирование активности ИЛ-1,6, ФНО-α, подавление продукции оксида азота, стимуляция синтеза протеогликанов и гиалуроновой кислоты, ослабление ИЛ-1 опосредованного торможения синтеза ГАГ, ослабление экспрессии ММР-1 и ММР-3 [43].
Эффективность ацеклофенака Аэртал, как и любого другого препарата, в первую очередь была доказана на экспериментальных моделях острого и хронического воспаления и клеточных культурах. Авторами ряда работ были получены данные о сходной противовоспалительной активности ацеклофенака и диклофенака [15, 16].
Изучение безопасности применения препарата на экспериментальных животных показало, что число язв при введении в организм животных ацеклофенака было в 3,7–4,2 раза меньше, чем при использовании напроксена и диклофенака.
Также показано, что проявления желудочно-кишечных кровотечений у крыс после однодневного лечения ацеклофенаком были значительно реже, чем при приеме диклофенака, однако после 4-дневного приема эти различия исчезали [17].
Клиническая эффективность ацеклофенака была доказана в ряде исследований у пациентов с ревматическими болезнями и болями различной природы.
Проведенные исследования можно разделить на три группы: открытые исследования, плацебо-контролируемые исследования, сравнительные исследования ацеклофенака с другими НПВС.
Открытое исследование выполнено у пациентов с ОА (86 человек) и РА (26 человек). Лечение ацеклофенаком в течение одного месяца приводило к статистически значимому снижению боли, ее усиление наблюдалось только через 12 месяцев наблюдения [18].
Эффективность ацеклофенака Аэртал у пациентов с ОА оценивалась в двух плацебо-контролируемых исследованиях.
В первом из них, двойном слепом многоцентровом, в параллельных группах исследования 146 рандомизированных пациентов (средний возраст 61 год) получали ацеклофенак 100 мг в день или плацебо в течение 4 недель. Выраженность болевого синдрома при движении, в покое, ночью оценивали пациенты и врачи.
К окончанию исследования интенсивность боли снизилась у 79% пациентов, получавших ацеклофенак, и у 52% – в группе плацебо (р=0,005) [19].
В другом двойном слепом исследовании 60 пациентов в возрасте 48–64 года были рандомизированы в две группы, получавшие ацекофенак 100 мг дважды в день или плацебо в течение 28 дней. При включении в исследование пациенты имели выраженный болевой синдром. После лечения только один пациент из группы, получавшей ацеклофенак Аэртал, испытывал сильную боль: в группе плацебо – 14 человек (p<0,001). Достоверные различия уровней боли получены и в промежуточные периоды исследования – на 7, 14, 21 и 28-й дни. Исследователи оценили эффект как хороший у 23 из 29 пациентов, леченных ацеклофенаком: в группе плацебо – у 1 из 29 [20].
Оценка эффективности и безопасности ацеклофенака Аэртал в сравнении с другими НПВС представлена во многих работах. Сравнительная характеристика эффективности ацеклофенака и диклофенака у пациентов с ОА оценивалась в 6 исследованиях. В одном из них 20 пациентов получали ацеклофенак 75 мг и 19 – диклофенак 50 мг дважды в день.
Оценивалась боль в покое, при движении и при пальпации. Через 6 дней лечения уровень боли относительно исходного уровня снизился в обеих группах (p<0,01).
Улучшение функции суставов отмечено у 71,4% пациентов в группе ацеклофенака и у 52,9% – в группе диклофенака. По мнению врачей, эффективность была значительно выше в группе ацеклофенака: оценивалась как очень хорошая у 70% пациентов, получавших ацеклофенак Аэртал, и только у 36,8% больных, получавших диклофенак [21]. Исследование Diaz C. Et al. подтвердило высокую эффетивность ацеклофенака у пациентов с ОА при 4-недельном лечении, а также показало, что продолжительность эффекта разовой дозы ацекофенака составляет 6–12 часов, а дикофенака – 4–6 часов [22].
Длительный (трехмесячный) прием сравниваемых препаратов (116 пациентов в группе ацеклофенака и 113 в группе диклофенака) показал возможность достижения значительного снижения спонтанной боли, тяжести заболевания и боли при физических нагрузках на протяжении всего периода лечения. Авторами исследования не было выявлено принципиальных различий в эффективности сравниваемых препаратов [23].
Наиболее крупное исследование сравнительной эффективности ацеклофенака и диклофенака проведено Diaz C. et al. [24]. Исследование проводилось в течение 6 месяцев у 335 пациентов с ОА. После 15 дней лечения индекс тяжести ОА и выраженность болевого синдрома значимо уменьшились в обеих группах (p<0,001). К концу лечения ацеклофенак и диклофенак значительно улучшали функцию коленного сустава.
В исследовании Ward D.E et al. [25] также показана сравнимая эффективность обоих препаратов, однако указано, что в группе, получавшей ацеклофенак, парацетамол использовался гораздо реже, чем в группе диклофенака (в среднем 14 таблеток в неделю, в группе диклофенака – 22 таблетки; p<0,05).
Для сравнения эффективности ацеклофенака и напроксена проведено мультицентровое двойное слепое исследование у 374 пациентов с ОА. Суточная доза ацеклофенака составляла 200 мг, напроксена – 1000 мг. Значимых различий в эффективности обоих препаратов, оцененной по снижению боли в покое, при движении и пальпации, скованности в суставах не установлено [26].
В двойном слепом рандомизированном трехмесячном исследовании сравнивалась эффективность ацеклофенака (суточная доза 200 мг) и пироксикама (суточная доза 20 мг) у пациентов с ОА.
Уровень боли по ВАШ снижался в обеих группах после 15 дней лечения и далее на протяжении всего исследования (p<0,01).
На фоне терапии у пациентов обеих групп также снижался индекс тяжести ОА, увеличивался объем движений в коленном суставе от 1-го к 3-му месяцу лечения (p<0,01). Значимой разницы в эффективности препаратов не выявлено [27].
Представленные работы позволяют сделать вывод об эффективности ацеклофенака у пациентов с ОА. Применение препарата у данной категории пациентов позволяет снизить уровень боли в покое, при нагрузке и при пальпации, уменьшить индекс активности ОА и увеличить объем движений.
Серия двойных слепых многоцентровых исследований по применению ацеклофенака у пациентов с РА показала, что через месяц от начала терапии ацеклофенак более эффективно, чем плацебо, купирует болевой синдром, уменьшает синдром утренней скованности и ограничения движений [28]. Доказана более высокая эффективность ацеклофенака в сравнении с кетопрофеном [29, 30], сходная эффективность с диклофенаком [31], теноксикамом [32], индометацином [33] с лучшим профилем желудочно-кишечной безопасности [30, 34].
Применение ацеклофенака у пациентов с анкилозирующим спондилитом показало его эффективность в 4 рандомизированных исследованиях, где сравнивалась эффективность препарата с такими широко применяемыми НПВС, как индометацин [35], теноксикам [36], напроксен [37]. Доказана сходная эффективность с препаратами сравнения по снижению уровня боли и лучший профиль безопасности.
Исследование эффективности ацеклофенака при различных видах острой боли (дентальной), боли в нижней части спины показало его лучшую эффективность по сравнению с плацебо, парацетамолом и диклофенаком [38, 39].
Как видно из представленных литературных данных, эффективность ацеклофенака доказана при различных заболеваниях суставов и болевых синдромах.
При выборе препаратов с аналогичной эффективностью преимущества имеют лекарства с лучшей переносимостью.
Исследования ацеклофенака в различных клинических ситуациях позволяют констатировать, что препарат имеет более высокую безопасность, чем пироксикам, диклофенак, напроксен, кетопрофен, теноксикам и индометацин, в плане развития побочных эффектов со стороны желудочно-кишечного тракта, высокую печеночную безопасность [40–42].
Метаанализ по безопасности ацеклофенака включал 13 исследований у пациентов с ОА, РА, АС. Основные результаты можно представить в виде трех позиций: лучший комплайнс (соблюдение рекомендаций), чем при применении классических НПВС; лучшая переносимость, чем классических НПВС; лучшая желудочно-кишечная безопасность и переносимость, чем у диклофенака [43, 44].
Завершая обзор литературных данных по применению оригинального ацеклофенака (Аэртала), можно сделать вывод, что к нам вернулся препарат с высокой эффективностью и безопасностью для лечения пациентов с суставной патологией и болевыми синдромами различной природы.
Белорусская медицинская академия последипломного образования, Минск.
Витебский Государственный ордена Дружбы народов медицинский университет
Т.Д. Тябут, А.Е. Буглова, Г.Д. Тябут.
«Медицинские новости», №12, 2011.
Л И Т Е Р А Т У Р А
1. Brodie R.R., Chasseaud L.F., Irons S.R. Pharmacokinetics and bioavailability of the antiinflammatory agent aceclofenac after single oral doses of human subject: A dose proportionality study. Data of file. Amiral Prodesfarma SA.
2. Creamer J. // Br. J. Clin. Res. – 1992. – Vol.3. – P.99–107.
3. Saraf S. Aceclofenac: A Potent Non-Steroidal Anti-Inflammatory drugs: www.pharmainfo.net/…/ aceclofenac-potent
4. Dannhardt G., Ulbrich H. // Inflamm. Res. –2001. – Vol.50(5). – P.262–269.
5. Blanco F.J., Maneiro E., de Toro F.J. et al. // Lab. Invest. Rheumatol. – 2000. – P. THO17.
6. Cecchettin M., Cerea P., Torri G. // Clin. Trials J. 1988. – Vol.25. – P.144–151.
7. Martel-Pelletier J., Cloutier J.M., Pelletier J.P. // Clin. Drag. Invest 1997. – Vol.14. – P.226–232.
8. Henrotin Y., de Leval X., Mathy-Hartet M.et al. // Inflam. Res. – 2001. – Vol.50 (8). – P.391–399.
9. Sanchez C., Mateus M., Defresne M. et al. // J. Rheumatol. – 2002. – Vol.29(4). – P.772–782.
10. Maniero E., Lopes-Armada M.J., Fernandes-Sueiro J.L. et al. // J. Rheumatol. – 2001. – Vol.28(12). – P.2692–2699.
11. Dingle J.T. // Eur. J. Rheumatol. Inflamm. – 1996. – Vol.16. – P.47–52.
12. Dingl J.T., Parker M. // Rev. Bras. Rheumatol. – 1997. – Vol.37. – P.37–46.
13. Blot L., Marcelis A., Devogelaer J.P., Manicourt D.H. // Br. J. Pharmacol. – 2000. – Vol.13(17). – P.1413–1421.
14. Yamazaki R., Kawai S., Mizushima Y. et.al. // Inflamm. – Res. 2000. – Vol.49. – P.133–138.
15. Grau M., Guasch J., Montero J.L. еt al. // Arzneimittelforschung. – 1991. – Vol.41. – P.1265– 1276.
16. Grau M., Montero J.L., Guasch J. et al. // Agents Action. – 1991. – Vol.32, suppl. – P.125–129.
17. Rimbau V., Fernandez M.F. Guirao I. et al. // Farmaco Ed. Prat. – 1988. – Vol.43. – P.19–26.
18. Accardo S., Seriolo B., Tirri G. et al. // Eur. J. Rheumatol. Inflamm. – 1996. – Vol.16. – P.29–35.
19. Birrell D.H., Roma J., Bowdler J.M. // Br. J. Clin. Res. – 1995. – Vol.6. – P.45–55.
20. Torrejón V.A. // Acta Ther. – 1998. – Vol.14. – P.275–280.
21. Torri G. // Curr Ther Res. – 1987. – Vol.42. – P.453–457.
22. Diaz C., Rodriguez de la Serna A., Geli C. et.al. // Curr. Ther. Res. – 1988. – Vol.44. – P.252–256.
23. Gonarthrosis Study Group. Еfficacy and tolerability aceclofenac in the treatment of gonarthrosis // Rev. Esp. Rheumatol. – 1992. – Vol.19. – P.142–146.
24. Diaz C., Rodriguez de la Serna A., Geli C. et.al. // Eur. J. Rheumatol. Inflamm. – 1996. – Vol.16. – P.17–22.
25. Ward D.E., Veys E.M., Bowdler J.M. et.al. // Clin. Rheum. – 1995. – Vol.14. – P.656–662.
26. Kornasoff D., Maisenbacher J., Bowdler J.M. et.al. // Rheum. Int. – 1996. – Vol.15. – P.225–230.
27. Torri G., Vignati C., Agrifoglio E. et al. // Curr. Ther. Res. – 1994. – Vol.55. – P.576–583.
28. Ballesteros R., Ansoleaga J.J., Tapounet R. // Clin. Trials. J. – 1990. – Vol.27. – P.12–19.
29. Martn-Mola E., Gijon-Banos J., Ansoleaga J.J. // Rheumatol Int. – 1995. – Vol.15(3). – P.111–116.
30. Obach J., Asensi E., Benito P. et al. // Rev. Esp. Rheumatol. – 1992. – Vol.19. – P.263–268.
31. Pasero G., Marcolongo R., Serni U. et al. // Curr. Med. Res. Opin. – 1995. – Vol.13(6). – P.305–315.
32. Peres-Ruiz F., Alonso-Ruiz A., Ansoleaga J.J. // Clin. Rheumatol. – 1996. – Vol.15(5). – P.473–477.
33. Kornasoff D., Maisenbacher J., Bowdler J., Raber A. // Rheumatol. – Int. 1996. – Vol.15(6). – P.225–230.
34. Martin-Mola E., Gijon-Banos J., Ansoleaga J.J. // Rev. Esp. Rheum. – 1992. – Vol.19. – P.263–268.
35. Veys E. A double-blind parallel group evaluation of the safety and efficacy of aceclofenac 100 mg twice daily compared with indometacin 50 mg twice daily in patients with ankylosing spondylitys. Data of file, Almirall Prodespharma SA.
36. Villa-Alcazar L.F., de Buergo M., Rico Lensa H., Montull Fruitos E. // J. Rheumatol. – 1996. – Vol.23(7). – P.1194–9.
37. Pasero J., Ruji G., Marcolongo R. et al. // Curr. Ther. Res. – 1994. – Vol.55. – P.833–842.
38. Bubani G. // Clin. Trial. J. – 1988. – Vol.25. – P.244– 253.
39. Shattenkirchner M., Milachowski K.A. // Clin. Rheumatol. – 2003. – Vol.22(2). –P.127–135.
40. Huskisson E., Irani M., Murray F. // Europ. J. Rheumatol. Inflam. – 2000– Vol.7(1). – P.1–7.
41. Yanagawa A., Endo Т., Kusaraki K. et al. // Jap. J. Rheumatol. – 1998. – Vol.8. –P.245–259.
42. Marsicano L.J., Ocampo M.E. // Rev. Soc. Venezolana Gastroenterol. – 1994. – Vol.48. – P.250–255.
43. Peris F., Martinez E., Badia X., Brossa M. // Pharmacoeconomics. – 2001. – Vol.19(7). – P.779–790.
44. Aceclofenac monograph, 2003; Almiral Prodesfarma S.A. General Mitre 151, 08022 Barselona, Spain. 122 p.
Ацеклофенак (Аэртал) – баланс эффективности и безопасности в лечении боли и воспаления
- Титова Н.В.
- Кафедра неврологии, нейрохирургии и медицинской генетики лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, отдел нейродегенеративных заболеваний ФГБУ Федеральный центр мозга и нейротехнологий ФМБА России
,
- Путятин И.А.
- Кафедра неврологии, нейрохирургии и медицинской генетики лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России
- DOI
- 10.32756/0869-5490-2024-1-23-30
- Количество просмотров
- 3439
Скачать статью в PDF
В обзорной статье обсуждаются механизм действия нестероидного противовоспалительного препарата (НПВП) ацеклофенака и его точки приложения в патогенезе болевых и воспалительных синдромов. Согласно данным проанализированных исследований, ацеклофенак обладает выраженным анальгетическим и противовоспалительным действием, а также способствует активному восстановлению хрящевой ткани, подавляя катаболические процессы, связанные с воспалением. При болях в спине препарат может использоваться в виде монотерапии или в комбинации с миорелаксантом. Значимым преимуществом ацеклофенака перед другими НПВП является благоприятный профиль безопасности и минимальный риск гастро- и кардиотоксичности, что способствует повышению приверженности к лечению. Ацеклофенак является НПВП с благоприятным соотношением “польза/риск”.
Аэртал (ацеклофенак) – относится к классу нестероидных противовоспалительных препаратов (НПВП) и по механизму
действия занимает промежуточное положение между неселективными НПВП и высокоселективными ингибиторами
циклооксигеназы (ЦОГ) 2-го типа (коксибами). Недостатки в отношении переносимости широко используемого НПВП
диклофенака побудили ученых к разработке нового модифицированного НПВП с повышенной безопасностью и сопоставимой
эффективностью. С целью улучшения желудочно-кишечной переносимости в 1991 году был синтезирован ацеклофенак, который
является производным диклофенака [1]. Химичес кая структура ацеклофенака приведена на рис. 1.
Ацеклофенак обладает умеренной селективностью в отношении ЦОГ-2, что предполагает улучшенный профиль безопасности
препарата, в том числе меньшую частоту серьезных осложнений со стороны желудочно-кишечного тракта (ЖКТ) при
отсутствии нарастания риска сердечно-сосудистых осложнений. Блокада ЦОГ-2 и синтеза простагландинов рассматривается
как один из ведущих механизмов противовоспалительной и противоболевой активности НПВП [2]. ЦОГ-зависимый механизм
аналгезии реализуется на периферическом уровне и частично на центральном уровне ноцицептивной системы. Исследова ния
показали, что НПВП влияют также на активность нейроактивных, иммунных и других биохимических веществ, играющих
определенную роль в ЦОГ-независимых механизмах обезболивания. Ацеклофенак ингибирует синтез воспалительных
цитокинов, в частности интерлейкинов (ИЛ) и фактора некроза опухоли (ФНО), и влияет на содержание молекул клеточной
адгезии нейтрофилов [3]. На рис. 2 показаны различные мишени ацеклофенака в реализации противоболевых и
противовоспалительных эффектов [4].
![Мишени ацеклофенака в реализации противоболевых и противовоспалительных эффектов (адаптировано из [4])](https://clinpharm-journal.ru/img/articles/2024.1/aceklofenak-aehrtal-balans-ehffektivnosti-i-bezopasnosti-v-lechenii-boli-i-vospaleniya_fig2.jpg)
противовоспалительных эффектов (адаптировано из [4])
Хондропротекторные эффекты ацеклофенака
В ряде исследований показано, что ацеклофенак способствует восстановлению хрящевой ткани. Это выгодно отличает
его от ряда других НПВП, таких как напроксен, индометацин и ибупрофен, ингибирующих синтез хрящевого матрикса.
J.T. Dingle изучил влияние 13 различных НПВП на синтез гликозаминогликанов и коллагена in vitro в хрящах
пациентов с остеоартитом (ОА) (n=486), ревматоидным артритом (РА) (n=174), а также в хрящах пациентов без
артрита (n=185). Исходя из результатов этого исследования и опубликованных данных, автор разделил все НПВП на
три группы: стимулирующие синтез внеклеточного матрикса, не оказывающие на него влияния и ингибирующие синтез
матрикса хряща. Большая часть НПВП относится ко второй (пироксикам, аспирин, парацетамол) или третьей
(напроксен, ибупрофен, индометацин, нимесулид) группам, тогда как ацеклофенак оказывал значимое положительное
влияние на синтез гликозаминогликанов и коллагена в хрящах пациентов как с ОА, так и РА [5]. В другом
исследовании был показан благоприятный эффект ацеклофенака на метаболизм протеогликанов и гиалуроновой кислоты в
хрящевой ткани у пациентов с тяжелым и умеренным ОА, чего не наблюдалось после приема диклофенака [6].
Обнаружено, что ацеклофенак не оказывает существенного влияния на пролиферацию клеток сухожилия, в отличие от
индометацина и напроксена, ингибирующих деление клеток, что склоняет в сторону выбора ацеклофенака при лечении
боли после травм сухожилий и хирургических вмешательств [7].
При многих патологических процессах в суставах, в частности ОА, важную роль в патогенезе играет избыточная
продукция провоспалительных цитокинов, прежде всего ИЛ-1β и ФНО-α, и ферментов, разрушающих матрикс хряща. ИЛ-1
стимулирует в хондроцитах и синовиальных клетках выработку простагландина E2 (PgE2) и матриксных
металлопротеиназ (ММП), способствующих дегенерации хряща [8]. PgE2 может опосредовать болевые пути в суставном
хряще посредством стимулирующего действия на факторы, ассоциированные с болью, такие как ИЛ-6 и индуцибельная
синтаза оксида азота (iNOS) [9]. E. Gonzalez и соавт. показали значительное снижение повышенной продукции ИЛ-1β
и ФНО-α через 6 месяцев приема ацеклофенака у пациентов с ОА [10]. В другом исследовании был продемонстрирован
ингибирующий эффект ацеклофенака на продукцию ИЛ-6 и ФНО-α [11].
Исследования in vitro на хондроцитах кролика [15] и клетках ревматоидной синовиальной оболочки человека [16]
показали, что метаболит ацеклофенака 4′-гидроксиацеклофенак подавляет выработку интерстициальной проколлагеназы
и проММП-1,3, одновременно снижая уровень их мРНК в клетках. В другом исследовании не было продемонстрировано
явного влияния препарата на синтез ММП, но была выявлена тенденция к увеличению продукции тканевого ингибитора
ММП-1 [11].
Эффективность ацеклофенака
В многоцентровом рандомизированном двойном слепом исследовании сравнивали эффективность и безопасность
ацеклофенака (n=200) и диклофенака (n=197) у пациентов с гонартрозом. В обеих группах наблюдалось значительное
улучшение всех клинических показателей, таких как болезненность суставов, припухлость, боль при движении и
функциональная активность. Однако по субъективной оценке пациентами ацеклофенак имел преимущество перед
диклофенаком. Уменьшение интенсивности боли отметили 71% пациентов, принимавших ацеклофенак, и 59% пациентов,
получавших диклофенак (р=0,005). Переносимость ацеклофенака была лучше, чем диклофенака. При приеме ацеклофенака
было зарегистрировано меньше побочных эффектов со стороны ЖКТ (59 случаев), чем при приеме диклофенака (83
случая) [17].
Преимущества ацеклофенака перед диклофенаком были продемонстрированы в систематическом обзоре проспективных
сравнительных исследований. В анализ были включены 9 исследований, в том числе у пациентов с ОА (n=5), РА (n=1),
различными скелетномышечными заболеваниями (n=1), болью в нижней части спины (n=1) и болью после экстракции зуба
(n=1). Ацеклофенак превосходил диклофенак по эффективностии или не уступал ему, а также имел преимущество по
переносимости [18].
Авторы крупного мета-анализа 44 рандомизированных контролируемых исследований в целом у 19045 пациентов с ОА
выделили самые эффективные НПВП при наибольшей выраженности болевого синдрома. В тройку лидеров вошли
ацеклофенак, эторикоксиб и целекоксиб [20].
По данным обзора исследований ацеклофенака, препарат оказался столь же эффективным, как диклофенак, напроксен и
пироксикам у больных ОА, как диклофенак, кеторолак, теноксикам и индометацин у больных РА и как теноксикам,
напроксен и индометацин у больных анкилозирующим спондилитом (АС). Ацеклофенак также обеспечивал эффективное
обезболивание при других состояниях, таких как зубная или гинекологическая боль, боль в пояснице, а также при
заболеваниях ушей, носа и горла [21].
Для оценки противоболевой эффективности ацеклофенака и удовлетворенности терапией было проведено многоцентровое
европейское исследование (Австрия, Бельгия, Германия и Греция) с участием 23407 пациентов с болью, вызванной
различными воспалительными или дегенеративными ревматологическими заболеваниями. Причиной назначения
ацеклофенака более чем в половине случаев была неудовлетворенность пациентов предшествующей терапией другими
НПВП. По мнению пациентов, ацеклофенак характеризовался превосходным и быстрым анальгетическим эффектом, который
сохранялся на протяжении всего периода исследования. К концу исследования состояние пациентов (параметр,
включающий в себя как анальгетическую эффективность, так и переносимость) по оценке как самих пациентов, так и
врачей в 84% случаев «значительно улучшилось» или «улучшилось». Доля пациентов, которые оценивали боль как
тяжелую, на фоне применения ацеклофенака сократилась с 41% до 2%. Результаты были сходными в разных странах и не
зависели от наличия острой или хронической боли. Удовлетворенность пациентов терапией ацеклофенаком и частота
соблюдения режима лечения были столь же впечатляющими: 90% пациентов остались довольны терапией, а более 90% –
соблюдали режим лечения [22].
У пациентов с болью в нижней части спины ацек лофенак в дозе 100 мг два раза в день также обладал хорошей
эффективностью. В 10-дневном рандомизированном двойном слепом многоцентровом исследовании у пациентов с острой
неосложненной пояснично-крестцовой болью, связанной с дегенеративными заболеваниями позвоночника, ацеклофенак в
дозе 100 мг два раза в день (n = 100) не уступал диклофенаку в дозе 75 мг два раза в день (n = 105) по
анальгетической эффективности (среднее изменение боли по визуальной аналоговой шкале [ВАШ] составило 61,6 и 57,3
мм, соответственно; исходный уровень – около 79 мм). Ацеклофенак превосходил диклофенак по выраженности и
скорости анальгетического действия у пациентов с острой болью [23].
Рациональной и эффективной представляется комбинация ацеклофенака и миорелаксанта для потенциирования
анальгетического эффекта. В открытом проспективном рандомизированном исследовании была изучена эффективность
комбинации ацеклофенака и толперизона гидрохлорида (Мидокалм) при острой боли в нижней части спины. Пациенты
основной группы в течение 14 дней получали комбинацию толперизона (по 150 мг 3 раза в день) и ацеклофенака (по
100 мг 2 раза в день), группы сравнения – монотерапию ацеклофенаком по 100 мг 2 раза в день. Через 8 и 14 дней
комбинированная терапия по анальгетической эффективности достоверно превосходила монотерапию: средняя
интенсивность боли по ВАШ в двух группах снизилась с 9,86±0,50 до 0,28±0,69 балла (p<0,001) и с 9,73±0,61 до
4,11±1,11 балла (p<0,001), соответственно. При этом значимых различий в профиле безопасности между двумя
группами выявлено не было [24].
Профиль безопасности и переносимость ацеклофенака
По данным клинических и постмаркетинговых исследований, ацеклофенак характеризовался хорошей переносимостью.
Отмеченные нежелательные явления соответствовали таковым при применении любых НПВП [25,26].
Во многих исследованиях продемонстрированы лучшая переносимость и большая безопасность ацеклофенака, прежде
всего со стороны ЖКТ, по сравнению с другими НПВП. Ацеклофенак вызывает желудочнокишечные нежелательные явления
реже, чем другие НПВП, что может снизить частоту отмены препарата и повысить приверженность к лечению [21,25]. В
крупном 12-месячном проспективном обсервационном исследовании SAMM у 7890 пациентов с РА, ОА или АС, получавших
ацеклофенак, общая частота нежелательных явлений была значительно ниже, чем у 2252 пациентов, получавших
диклофенак (22% и 27%, соответственно; p<0,001). Оба НПВП в целом хорошо переносились, а большинство
нежелательных явлений были легкими или умеренно выраженными. В обеих группах чаще всего наблюдались легкие
или умеренные желудочно-кишечные нарушения, которые при лечении ацеклофенаком встречались значительно реже,
чем при приеме диклофенака (11% и 15%, соответственно; p<0,001). Нежелательные явления со стороны ЖКТ в двух
группах включали в себя диспепсию (5,4% и 6,7%; p=0,017), боль в животе (2,5% и 4,4%; p<0,001), диарею (1,5%
и 3,6%; p<0,001) и тошноту (1,6% и 2,4%; р=0,01). Нарушения со стороны центральной нервной системы (ЦНС)
также в основном были легкими или умеренными и встречались менее чем у 3% пациентов в двух группах. Частота
неврологических нежелательных явлений при лечении ацеклофенаком была выше, чем в группе диклофенака (3%
против 2%; p=0,007), в основном за счет более высокой частоты головокружения, депрессии и головной боли
[27].
В 6-недельном рандомизированном контролируемом исследовании у 284 пациентов с ОА, получавших
ацеклофенак, нежелательные явления со стороны ЖКТ встречались значительно реже, чем у 285 пациентов
группы диклофенака (57% и 74%, соответственно; p<0,001). Все нежелательные явления были легкими или средней
степени тяжести. Наиболее частыми (>5%) желудочно-кишечными нарушениями в группах
ацеклофенака и диклофенака были диспепсия (28% и 38%, соответственно; р=0,014), боли в животе (19% и
26%; p=0,037) и тошнота (7% и 6%). Два пациента в каждой группе выбыли из исследования из-за
осложнений со стороны ЖКТ [29].
Дополнительные доказательства лучшей переносимости ацеклофенака со стороны ЖКТ по сравнению с другими
НПВП были получены в крупных мета-анализах. При мета-анализе 7 рандомизированных клинических
исследований у пациентов ОА не выявлено существенных различий между ацеклофенаком и препаратами
сравнения (диклофенак, напроксен, пироксикам или парацетамол) по частоте нежелательных явлений
(относительный риск [ОР] 0,90; 95% доверительный интервал [ДИ] 0,72-1,12), частоте отмены исследуемых
препаратов (ОР 0,84; 95% ДИ 0,67-1,05), в том числе изза любых нежелательных явлений (ОР 0,76; 95% ДИ
0,51-1,14) или нежелательных явлений со стороны ЖКТ (ОР 1,30; 95% ДИ 0,62-2,74). Однако относительный
риск желудочно-кишечных нежелательных явлений (о которых сообщалось в четырех исследованиях) при приеме
ацеклофенака был на 31% ниже, чем при лечении диклофенаком и пироксикамом (ОР 0,69; 95% ДИ 0,57-0,83; р
<0,0001). Пациенты, получавшие ацеклофенак, выбывали из исследований реже, чем пациенты группы
парацетамола, который считается наиболее безопасным препаратом с точки зрения желудочно-кишечных
нежелательных явлений [30].
Для сравнения приверженности к лечению и безопасности терапии ацеклофенаком и другими НПВП у
пациентов с ОА, РА и АС и был проведен мета-анализ 13 рандомизированных клинических исследований
(n=3574). Препаратами сравнения были диклофенак, индометацин, напроксен, пироксикам, теноксикам
и кетопрофен. Приверженность к лечению оценивали на основании количества пациентов, завершивших
полный курс терапии, а безопасность – по четырем критериям: (1) количество пациентов без
нежелательных явлений, (2) количество пациентов без нежелательных явлений со стороны ЖКТ, (3)
прекращение лечения изза нежелательных явлений и (4) прекращение лечения из-за нежелательных
явлений со стороны ЖКТ. В целом, приверженность к лечению ацеклофенаком была значительно лучше
приверженности к терапии другими НПВП. При ОА и РА пациенты значительно чаще соблюдали режим
приема ацеклофенака, чем препаратов сравнения. Данный мета-анализ продемонстрировал не только
превосходство ацеклофенака с точки зрения желудочно-кишечной переносимости, но и его более
высокую безопасность в целом по сравнению с диклофенаком, индометацином, напроксеном,
пироксикамом, теноксикамом и кетопрофеном. Частота прекращения лечения из-за нежелательных
явлений, в том числе со стороны ЖКТ, была значительно ниже в группе ацеклофенака. Авторы
отмечают, что лучший профиль безопасности ацеклофенака по сравнению с другими широко
используемыми НПВП позволяет рассматривать ацеклофенак в качестве препарата выбора для лечения
ревматологических заболеваний [31].
Низкий потенциал повреждения слизистой оболочки гастродуоденальной зоны при приеме ацеклофенака
был продемонстрирован с помощью эндоскопии у здоровых добровольцев. В двойном слепом
плацебо-контролируемом исследовании приняли участие 30 здоровых мужчин, которые получали
ацеклофенак 150 мг/сут, диклофенак натрия 75 мг/сут или плацебо в течение 2 недель. Ацеклофенак
вызывал гастропатию значительно реже, чем диклофенак натрия. При приеме плацебо признаков
повреждения слизистой оболочки желудка и двенадцатиперстной кишки не выявили. Содержание
гексозамина в слизистой оболочке желудка и гастродуоденальный кровоток значительно снизились при
приеме диклофенака натрия, в то время как при приеме ацеклофенака содержание гексозамина в
слизистой оболочке желудка увеличилось, а гастродуоденальный кровоток не изменился [32].
Авторы мета-анализа 28 обсервационных исследований рассчитывали ОР осложнений со стороны верхних
отделов ЖКТ при использовании НПВП по сравнению с отсутствием их применения. При лечении
ацеклофенаком он был сопоставим с таковым при приеме целекоксиба и ниже, чем при приеме других
НПВП. В группах ацеклофенака, ибупрофена и целекоксиба ОР осложнений со стороны верхних отделов
ЖКТ был ниже 2, а при лечении другими НПВП составлял от 2 до >5 (рис. 3) [33]. Следует отметить,
что при использовании ацеклофенака не было выявлено значительного увеличения риска осложнений со
стороны верхних отделов ЖКТ по сравнению с отсутствием приема НПВП.
![Мишени ацеклофенака в реализации противоболевых и противовоспалительных эффектов (адаптировано из [4])](https://clinpharm-journal.ru/img/articles/2024.1/aceklofenak-aehrtal-balans-ehffektivnosti-i-bezopasnosti-v-lechenii-boli-i-vospaleniya_fig3.jpg)
осложнений со стороны верхних отделов ЖКТ при лечении НПВП [33]
Благоприятный профиль безопасности ацеклофенака для ЖКТ на практике приводит к существенному
уменьшению потребления гастропротекторов.
Лечение НПВП может сопровождаться нежелательными явлениями со стороны почек, сердечно-сосудистой
системы и кожи [34,35]. Однако в клинических исследованиях и обычной практике при применении
ацеклофенака отмечались редкие и очень редкие случаи кардиологических нарушений (сердечная
недостаточность – «редко», учащенное сердцебиение – «очень редко»), нарушений функции почек
(например, повышение уровня мочевины и креатинина в крови – «нечасто») и нарушений со стороны
кожи и подкожных тканей (например, зуд, сыпь и дерматит – «нечасто»). Используются следующие
показатели частоты побочных реакций: «нечасто» – от ≥1/1000 до <1 /100, «редко» – от ≥1/10
000
до <1/1000, «очень редко» – <1/10 000 [36].
Влияние НПВП на сердечно-сосудистую систему более характерно для селективных ингибиторов
ЦОГ-2 и объясняется активацией тромбоцитов и склонностью к тромбозам в связи с
подавлением синтеза простациклина (PGI2) за счет блокады ЦОГ-2 при сохранении
ЦОГ-1-зависимого синтеза тромбоксана А2 (ТхА2) [37]. Другой проблемой длительного
лечения селективными ингибиторами ЦОГ-2 является ремоделирование сосудов, что может
способствовать развитию артериальной гипертонии и атеросклероза и, соответственно,
постепенному повышению риска сердечно-сосудистых осложнений [38]. Предполагается, что
ингибирование ацеклофенаком ЦОГ-1 может служить фактором, защищающим от нежелательных
сердечно-сосудистых событий. В ряде исследований показано преимущество ацеклофенака
перед другими неселективными НПВП по безопасности для сердечно-сосудистой системы
[39,40]
В международном многоцентровом европейском исследовании, проводившемся методом
случай-контроль, оценивали риск ишемического инсульта (ИИ) при приеме 32 различных НПВП,
а также влияние на него факторов риска ИИ и сопутствующей терапии на основания анализа 6
баз данных систем здравоохранения из 4 стран (более 32 млн пациентов). Среди 4593778
пациентов, которые впервые стали принимать НПВП, были зафиксированы 49170 случаев ИИ.
Для каждого пациента с ИИ были подобраны 100 «контрольных» участников, соответствующих
по полу и возрасту. Лечение ацеклофенаком не сопровождалось увеличением риска развития
ИИ. Самый высокий риск ИИ наблюдался при приеме кеторолака: скорректированное с учетом
потенциальных факторов риска (таких какинфаркт миокарда, сердечная недостаточность,
фибрилляция и трепетание предсердий и т.д.) отношение шансов (ОШ) составило 1,46 (95% ДИ
1,19–1,78). Повышенный риск ИИ был также выявлен (в порядке убывания) при лечении
диклофенаком (ОШ 1,26; 95% ДИ 1,20–1,32), индометацином (ОШ 1,24; 95% ДИ 1,02–1,51),
рофекоксибом (ОШ 1,21; 95% ДИ 1,10– 1,34), ибупрофеном (ОШ 1,15; 95% ДИ 1,09–1,22),
нимесулидом (ОШ 1,14; 95% ДИ 1,06–1,23), диклофенаком в комбинации с мизопростолом (ОШ
1,14; 95% ДИ 1,01–1,29) и пироксикамом (ОШ 1,13; 95% ДИ 1,01–1,27). Риск ИИ, связанный с
применением НПВП, обычно был выше у людей более молодого возраста, мужчин и пациентов с
ИИ в анамнезе [41].
Ацеклофенак относится к НПВП, не повышающим значимо риск развития инфаркта миокарда
(ИМ). В качестве доказательства приводятся данные крупного исследования с использованием
дизайна случай-контроль. В этом исследовании среди 8,5 миллионов пациентов, которые
впервые начали прием НПВП, было зарегистрировано 79553 случаев ИМ. Риск ИМ рассчитывали
для 28 НПВП, включая ацеклофенак. Он был самым высоким при приеме кеторолака (ОШ 2,06;
95% ДИ 1,83–2,32), за которым в порядке убывания следовали индометацин, эторикоксиб,
рофекоксиб, диклофенак, фиксированная комбинация диклофенака с мизопростолом,
пироксикам, ибупрофен, напроксен, целекоксиб, мелоксикам, нимесулид и кетопрофен (OШ
1,12; 95% ДИ 1,03–1,22). Более высокие дозы НПВП ассоциировались с более высоким риском
ИМ по сравнению с более низкими дозами [42].
Анализ выписываемых анальгетиков и НПВП пациентам, перенесшим ИМ, в условиях обычной
клинической практики в Корее показал, что чаще всего их назначают в амбулаторном звене
по поводу скелетномышечной боли. Самым часто назначаемым НПВП у 75131 пациентов был
ацеклофенак (13,7%) [43].
По данным отдельных исследований, ацеклофенак переносился лучше, чем некоторые другие
НПВП, включая напроксен, пироксикам, индометацин и кетопрофен [45-49]. При сравнении
ацеклофенака и парацетамола в двойном слепом рандомизированном исследовании у пациентов
с ОА коленного сустава профиль безопасности ацеклофенака в целом был аналогичен профилю
безопасности парацетамола [50].
Кроме того, анализ всех вновь развившихся побочных реакций, зарегистрированных в базе
данных центра фармаконадзора ВОЗ в течение первого года после регистрации ацеклофенака в
Великобритании, показал следующее. Общая частота всех побочных реакций,
скорректированная на установленную суточную дозу (побочные реакции/106 DDD; defined
daily dose – расчетная средняя поддерживающая суточная доза лекарственного средства,
применяемого по основному показанию у взрослых), при применении ацеклофенака (8,7; 95%
ДИ 6,1–12,0) была ниже, чем при использовании мелоксикама (24,8; 95% ДИ 23,1–26,6) или
рофекоксиба (52,6; 95% ДИ 49,9–55,4). Что касается семи групп состояний, наиболее часто
связанных с НПВП, лечение ацеклофенаком сопровождалось меньшей частотой
желудочно-кишечных кровотечений, болей в животе и артериальной гипертонии по сравнению с
мелоксикамом или рофекоксибом, а также меньшей частотой печеночной токсичности,
тромбоэмболических осложнений и отеков по сравнению с рофекоксибом [51]. Сходные данные
получены при анализе данных службы фармаконадзора Франции: ацеклофенак по переносимости
имел преимущества перед другими НПВП. Самым высоким риск серьезных побочных реакций со
стороны ЖКТ, печени, кожи и почек в данном исследовании был при приеме кетопрофена,
нимесулида, мелоксикама и теноксикама, соответственно. Ацеклофенак ассоциировался с
самой низкой кумулятивной частотой серьезных НЯ среди всех НПВП – 0,30 случаев на
миллион DDD [52].
Использование ацеклофенака у пожилых пациентов
У пожилых пациентов фармакокинетика ацеклофенака существенно не меняется, а изменение его дозы не требуются.
Однако пожилые люди чаще страдают нарушениями функции почек, сердечно-сосудистой системы или печени, имеют более
высокий риск желудочнокишечного кровотечений, изъязвлений или перфораций, а также нередко принимают другие
препараты, которые могут увеличить риск лекарственных взаимодействий и побочных реакций [35,53-55]. Риск
желудочно-кишечных кровотечений или изъязвлений может повышаться при использовании НПВП одновременно с
системными глюкокортикостероидами, антикоагулянтами (например, варфарином), селективными ингибиторами обратного
захвата серотонина или антиагрегантами, например, аспирином. Совместное применение НПВП и метотрексата может
повысить уровень метотрексата в плазме, что приводит к увеличению его токсичности [35,53,56].
Учитывая более высокий риск побочных реакций на НПВП у пожилых людей, особенно желудочно-кишечных кровотечений,
рекомендуется использовать самую низкую эффективную дозу НПВП в течение как можно более короткого периода
времени. У пожилых необходимо регулярно контролировать нежелательные явления со стороны ЖКТ и показатели функции
почек в течение всего срока терапии НПВП [53].
Заключение
Таким образом, результаты многочисленных рандомизированных клинических исследований и мета-анализов подтверждают
высокую анальгетическую и противовоспалительную активность, хорошую переносимость и благоприятное соотношение
«польза/риск» ацелофенака, что позволяют говорить о целесообразности его широкого применения как препарата
первой линии при распространенных заболеваниях суставов и позвоночника [57]. Ацеклофенак в повседневной
клинической практике может использоваться для лечения как острых, так и хронических воспалительных и
дегенеративных заболеваний опорно-двигательного аппарата. Рекомендуемая доза Аэртала (ацеклофенака) составляет
100 мг (одна таблетка) два раза в сутки (максимальная рекомендуемая доза – 200 мг/сут). При использовании
порошка для приготовления суспензии для приема внутрь содержимое пакетиков следует растворять в 40-60 мл воды и
принимать немедленно. Рекомендуемая доза составляет 1 пакетик два раза в сутки.
Используемые источники
- Grau M, Montero JL, Guasch J, et al. The pharmacological profile of aceclofenac, a new nonsteroidal antiinflammatory and analgesic drug. Agents Actions Suppl 1991;32:125–29.
- Yamazaki R, Kawai S, Matsuzaki T, et al. Aceclofenac blocks prostaglandin E2 production following its intracellular conversion into cyclooxygenase inhibitors. Europ J Pharmacol 1997;329(2-3):181–7.
- González-Alvaro I, Carmona L, Díaz-González F, et al. Aceclofenac, a new nonsteroidal antiinflammatory drug, decreases the expression and function of some adhesion molecules on human neutrophils. J Rheumatol 1996;23(4):723–9.
- Raza K, Kumar M, Kumar P, et al. Topical delivery of aceclofenac: challenges and promises of novel drug delivery systems. Biomed Res Int 2014;2014:406731.
- Dingle JT. The effects of NSAID on the matrix of human articular cartilages. Z Rheumatol 1999;58(3):125-9.
- Blot L, Marcelis A, Devogelaer JP, Manicourt DH. Effects of diclofenac, aceclofenac and meloxicam on the metabolism of proteoglycans and hyaluronan in osteoarthritic human cartilage. Br J Pharmacol 2000;131(7):1413-21.
- Riley GP, Cox M, Harrall RL, et al. Inhibition of tendon cell proliferation and matrix glycosaminoglycan synthesis by non-steroidal anti-inflammatory drugs in vitro. J Hand Surg Br 2001;26(3):224-8.
- Marrero-Berrios I, Salter SE, Hirday R, et al. In vitro inflammatory multicellular model of osteoarthritis. Osteoarthr Cartil Open 2024;6(1):100432.
- Lee AS, Ellman MB, Yan D, et al. A current review of molecular mechanisms regarding osteoarthritis and pain. Gene 2013;527(2):440-7.
- Gonzalez E, de la Cruz C, de Nicolas R, et al. Long-term effect of nonsteroidal anti-inflammatory drugs on the production of cytokines and other inflammatory mediators by blood cells of patients with osteoarthritis. Agents Actions 1994;41(3-4):171-8.
- Syggelos SA, Giannopoulou E, Gouvousis PA, et al. In vitro effects of nonsteroidal anti-inflammatory drugs on cytokine, prostanoid and matrix metalloproteinase production by interface membranes from loose hip or knee endoprostheses. Osteoarthr Cartilage 2007;15(5):531-42.
- Maneiro E, López-Armada MJ, Fernández-Sueiro JL, et al. Aceclofenac increases the synthesis of interleukin 1 receptor antagonist and decreases the production of nitric oxide in human articular chondrocytes. J Rheumatol 2001;28(12):2692-9.
- Alvarez-Soria MA, Herrero-Beaumont G, et al. Long-term NSAID treatment directly decreases COX-2 and mPGES-1 production in the articular cartilage of patients with osteoarthritis. Osteoarthr Cartilage 2008;16(12):1484-93.
- Dingle J, Parker M. NSAID stimulation of human cartilage matrix synthesis. A study of the mechanism of action of aceclofenac. Clin Drug Invest 1997;14:353-62.
- Akimoto H, Yamazaki R, Hashimoto S, et al. 4′-Hydroxy aceclofenac suppresses the interleukin-1-induced production of promatrix metalloproteinases and release of sulfated-glycosaminoglycans from rabbit articular chondrocytes. Eur J Pharmacol 2000;401(3):429-36.
- Yamazaki R, Kawai S, Mizushima Y, et al. A major metabolite of aceclofenac, 4′-hydroxy aceclofenac, suppresses the production of interstitial pro-collagenase/proMMP-1 and pro-stromelysin-1/proMMP-3 by human rheumatoid synovial cells. Inflamm Res 2000;49(3):133-8.
- Ward DE, Veys EM, Bowdler JM, Roma J. Comparison of aceclofenac with diclofenac in the treatment of osteoarthritis. Clin Rheumatol 1995;14(6):656-62.
- Vohra F, Raut A. Comparative efficacy, safety, and tolerability of diclofenac and aceclofenac in musculoskeletal pain management: A systematic review. Indian J Pain 2016;30:3-6.
- Patel PB, Patel TK. Efficacy and safety of aceclofenac in osteoarthritis: A metaanalysis of randomized controlled trials. Eur J Rheumatol 2017;4(1):11-8.
- Jung SY, Jang EJ, Nam SW, et al. Comparative effectiveness of oral pharmacologic interventions for knee osteoarthritis: A network metaanalysis. Mod Rheumatol 2018;28(6):1021-8.
- Legrand E. Aceclofenac in the management of inflammatory pain. Expert Opin Pharmacother 2004;5(6):1347-57.
- Lemmel EM, Leeb B, De Bast J, Aslanidis S. Patient and physician satisfaction with aceclofenac: results of the European Observational Cohort Study (experience with aceclofenac for inflammatory pain in daily practice). Aceclofenac is the treatment of choice for patients and physicians in the management of inflammatory pain. Curr Med Res Opin 2002;18(3):146-53.
- Schattenkirchner M, Milachowski KA. A double-blind, multicentre, randomised clinical trial comparing the efficacy and tolerability of aceclofenac with diclofenac resinate in patients with acute low back pain. Clin Rheumatol 2003;22(2):127-35.
- Bhattacharjya B, Naser SM, Biswas A. Effectiveness of tolperisone hydrochloride with aceclofenac as combined therapy in acute low back pain. Indian J Phys Med Rehabil 2012;23(2):74-8.
- Dooley M, Spencer CM, Dunn CJ. Aceclofenac: a reappraisal of its use in the management of pain and rheumatic disease. Drugs 2001;61(9):1351–78.
- Brogden RN, Wiseman LR. Aceclofenac. A review of its pharmacodynamic properties and therapeutic potential in the treatment of rheumatic disorders and in pain management. Drugs 1996;52(1):113-24.
- Hаskinsson E., Irani M., Murray F. A large prospective open-label, multicentre SAMM study, comparing the safety of acуclofenac with diclofenac in patients with rheumatic disease. Eur J Rheum Inflam 2000;17:1-7.
- Zaragoza Marcet A. Comparative incidence of upper gastrointestinal bleeding associated with individual non-steroidal anti-inflammatory drugs. Rev Esp Enferm Dig 2002;94(1):7-18.
- Pareek A, Chandurkar N. Comparison of gastrointestinal safety and tolerability of aceclofenac with diclofenac: a multicenter, randomized, double-blind study in patients with knee osteoarthritis. Curr Med Res Opin 2013;29(7):849-59.
- Patel PB, Patel TK. Efficacy and safety of aceclofenac in osteoarthritis: A metaanalysis of randomized controlled trials. Eur J Rheumatol 2017;4(1):11-8.
- Peris F, Bird HA, Srni U, et al. Treatment compliance and safety of aceclofenac versus standart NSAIDs in patients with common arthritis disorders: a metaanalysis. Eur J Rheum Inflamm 1996;16(1):37-45.
- Yanagawa A, Endo T, Kusakari K, et al. Endoscopic evaluation of aceclofenacinduced gastroduodenal mucosal damage: A double-blind comparison with sodium diclofenac and placebo. J Rheumatol 1998;8:249-59.
- Castellsague J, Riera-Guardia N, Calingaert B, et al. Individual NSAIDs and upper gastrointestinal complications: a systematic review and meta-analysis of observational studies (the SOS project). Drug Saf 2012;35(12):1127–46.
- Scarpignato C, Lanas A, Blandizzi C, et al. International NSAID Consensus Group. Safe prescribing of non-steroidal anti-inflammatory drugs in patients with osteoarthritis – an expert consensus addressing benefits as well as gastrointestinal and cardiovascular risks. BMC Med. 2015;13:55.
- Moore N, Pollack C, Butkerait P. Adverse drug reactions and drug-drug interactions with over-the-counter NSAIDs. Ther Clin Risk Manag 2015;11:1061-75.
- Инструкция по применению препарата ацеклофенак. https://www.vidal.ru/drug/aceclofenac. Дата обращения 20.02.2024.
- Gunaydin C, Bilge SS. Effects of nonsteroidal anti-inflammatory drugs at the molecular level. Eurasian J Med. 2018;50(2):116-21.
- Rudic RD, Brinster D, Cheng Y, et al. COX-2-derived prostacyclin modulates vascular remodeling. Circ Res 2005;96(12):1240-7.
- Helin-Salmivaara A, Virtanen A, Veslainen R, et al. NSAID use and the risk of hospitalization for first myocardial infarction in the general population: a national case-control study from Finland. Eur Heart 2006;27:1657–63.
- Каратеев А.Е., Денисов Л.Н., Маркелова Е.И. и др. Результаты клинического исследования АЭРОПЛАН (анализ эффективности и риска осложнений при лечении артрита ацеклофенаком и нимесулидом). Consilium medicum 2013;2:52-7 [Karateev AE, Denisov LN, Markelova EI, et al. Results of AEROPLAN clinical study (analysis of efficacy and risk of complications in the treatment of arthritis using aceclofenac and nimesulide). Consilium medicum 2013;2:52-7 (In Russ.)].
- Schink T, Kollhorst B, Varas Lorenzo C, et al. Risk of ischemic stroke and the use of individual non-steroidal anti-inflammatory drugs: A multi-country European database study within the SOS Project. PLoS One 2018;13(9):e0203362.
- Masclee GMC, Straatman H, ArfП A, et al. Risk of acute myocardial infarction during use of individual NSAIDs: A nested case-control study from the SOS project. PLoS One 2018;13(11):e0204746.
- Jung S-Y, Song, SY, Kim E. Trends in ambulatory analgesic usage after myocardial infarction: A nationwide cross-sectional study of real-world data. Healthcare 2022;10:446.
- Arfè A, Scotti L, Varas-Lorenzo C, et al. Safety of Non-steroidal Anti-inflammatory Drugs (SOS) Project Consortium. Non-steroidal anti-inflammatory drugs and risk of heart failure in four European countries: nested case-control study. BMJ 2016;354:i4857.
- Torri G, Vignati C, Agrifoglio E et al. Aceclofenac versus piroxicam in the management of osteoarthritis of knee: a double-blind controlled study. Curr Ther Res 1994 55(5):576–83.
- Kornasoff D, Frerick H, Bowdler J, Montull E. Aceclofenac is a well-tolerated alternative to naproxen in the treatment of osteoarthritis. Clin Rheumatol 1997;16(1):32-8.
- Pasero G, Ruju G, Marcolongo R. Aceclofenac versus naproxen in the treatment of ankylosing spondylitis: a double-blind, controlled study. Curr Ther Res 1994;55:833-42.
- Martín-Mola E, Gijón-BaЦos J, Ansoleaga JJ. Aceclofenac in comparison to ketoprofen in the treatment of rheumatoid arthritis. Rheumatol Int 1995;15(3):111-6.
- Kornasoff D, Maisenbacher J, Bowdler J, Raber A. The efficacy and tolerability of aceclofenac compared to indomethacin in patients with rheumatoid arthritis. Rheumatol Int 1996;15(6):225-30.
- Batlle-Gualda E, Román Ivorra J, Martín-Mola E, et al. Aceclofenac vs paracetamol in the management of symptomatic osteoarthritis of the knee: a double-blind 6-week randomized controlled trial. Osteoarthr Cartilage 2007;15(8):900-8.
- Raber A, Heras J, Costa J, et al. Incidence of spontaneous notifications of adverse reactions with aceclofenac, meloxicam, and rofecoxib during the first year after marketing in the United Kingdom. Ther Clin Risk Manag 2007;3(2):225-30.
- Lapeyre-Mestre M, Grolleau S, Montastruc JL; Association FranНaise des Centres RОgionaux de Pharmacovigilance (CRPV). Adverse drug reactions associated with the use of NSAIDs: a case/noncase analysis of spontaneous reports from the French pharmacovigilance database 2002-2006. Fundam Clin Pharmacol 2013;27(2):223-30.
- Iolascon G, Giménez S, Mogyorósi D. A review of aceclofenac: analgesic and anti-inflammatory effects on musculoskeletal disorders. J Pain Res 2021;14:3651-63.
- Gooch K, Culleton BF, Manns BJ, et al. NSAID use and progression of chronic kidney disease. Am J Med 2007;120(3):280.
- Ungprasert P, Cheungpasitporn W, Crowson CS, Matteson EL. Individual nonsteroidal anti-inflammatory drugs and risk of acute kidney injury: A systematic review and meta-analysis of observational studies. Eur J Intern Med 2015;26(4):285-91.
- Manappallil RG, Prasan D, Peringat J, Biju IK. Severe bone marrow suppression due to methotrexate toxicity following aceclofenac-induced acute kidney injury. BMJ Case Rep 2018;2018:bcr2018224722.
- Каратеев А.Е. Оценка популяционной безопасности НПВП в рамках общеевропейской программы SOS: фокус на ацеклофенак. Неврология, нейропсихиатрия и психосоматика 2020;12(2):109-13 [Karateev AE. Evaluation of the population safety of nonsteroidal anti-inflammatory drugs in the framework of the PanEuropean SOS program: focus on aceclofenac. Neurology, Neuropsychiatry, Psychosomatics 2020;12(2):109–13 (In Russ.)].
Версия на английском языке
Целекоксиб, эторикоксиб, мелоксикам и нимесулид: достоинства и недостатки
Статьи
Опубликовано в:
«ЭФ. Ревматология. Травматология. Ортопедия.» »» 1/2011
Д. м. н. А.Е. Каратеев
На российском фармацевтическом рынке представлено 15 нестероидных противовоспалительных препаратов, применяемых для лечения ревматических заболеваний. эквивалентных дозах и при достаточном времени наблюдения все они демонстрируют аналогичную эффективность. Фактором, ограничивающим их применение, является частота класс-специфических осложнений. В обзоре сравниваются четыре селективных ЦОГ-2 ингибитора — мелоксикам, нимесулид, целекоксиб и эторикоксиб — по частоте развития таких побочных явлений, как осложнения со стороны желудочно-кишечного тракта и сердечно-сосудистой системы. Автор анализирует данные наиболее репрезентативных зарубежных многоцентровых рандомизированных клинических исследований, а также популяционных и ретроспективных наблюдательных исследований. Анализ показал: наиболее безопасным препаратом в своем классе является целекоксиб.
Лечение ревматических заболеваний (РЗ) основывается на патогенетическом подходе [1]. Однако патогенетическая терапия не всегда приводит к полному, а главное быстрому облегчению страданий всех больных. Кроме того, добиться терапевтического успеха можно, только когда активное лечение назначается в период дебюта болезни. К сожалению, в реальной клинической практике большинство пациентов с хроническими РЗ болеют в течение длительного времени, зачастую инвалидизированы, у многих из них имеется стойкая деформация суставов и выраженные функциональные нарушения. В этих случаях ревматолог вынужден прибегать к симптоматической терапии — использовать лекарства, хотя и не влияющие на развитие болезни, но способные устранять ее наиболее неприятные клинические проявления.
С этой целью в ревматологической практике наиболее широко используются нестероидные противовоспалительные препараты (НПВП), позволяющие эффективно купировать боль — самое тяжелое проявление патологии опорнодвигательной системы [2, 3].
Значение НПВП для современной ревматологии убедительно показывает исследование германских ученых, результаты которого были опубликованы в октябре 2010 г. Susanne Ziegler и соавт. провели анализ динамики тяжести и исходов ревматоидного артрита (РА) за 10 лет (1997-2007), используя национальную базу данных, содержащую информацию о 38 723 больных с этим заболеванием. Внедрение новых методов лечения, прежде всего генноинженерных биологических препаратов, и комбинированное использование базисных противовоспалительных препаратов позволило достичь впечатляющих успехов. Так, число больных с высоким уровнем активности РА по шкале Disease Activity Score (DAS28>5,1) снизилось с 35,9% в 1997 г. до 10% в 2007; гораздо больше стало лиц с низкой активностью процесса (DAS28<3,2) — 22,5 и 49,1%, а также закономерно больше лиц с ремиссией (DAS28<2,6) — 13,7 и 27,3% соответственно. В то же время уровень боли, оцениваемой по визуальной аналоговой шкале (ВАШ), фактически не изменился. Так, если в 1997 г. средняя оценка боли составляла 4,7 балла, то в 2007 — 4,5 балла; выраженная боль (7-10 баллов) отмечалась у 27,6 и 23,2% пациентов соответственно. Совершенно очевидно, что не изменилась и потребность в симптоматических средствах — если в 1997 г. НПВП получали 47,3% больных, то в 2007 г. лишь чуть меньше — 44,7%, однако при этом возросло число потребителей анальгетиков иных классов — с 7,5 до 11,4% [4].
Спектр НПВП, представленных на российском рынке, весьма широк. Насчитывается 15 различных наименований: ацеклофенак, диклофенак, ибупрофен, кеторолак, лорноксикам, мелоксикам, метамизол, напроксен, нимесулид, пироксикам, теноксикам, фенилбутазон, флубипрофен, целекоксиб и эторикоксиб. В данной связи вполне закономерен вопрос о рациональном выборе препарата для конкретной клинической ситуации. Причем этот выбор, несомненно, должен основываться на объективном сравнении достоинств и недостатков различных представителей этой лекарственной группы.
Отметим: заключение о преимуществах того или иного препарата не следует обосновывать мнением экспертов или локальным клиническим опытом. Оно должно базироваться на четко доказанных положениях по сравнительной эффективности и безопасности, и основным источником достоверной информации здесь, безусловно, являются хорошо организованные многоцентровые рандомизированные клинические исследования (РКИ). Кроме того, важнейшие данные по безопасности лекарства в реальной клинической практике дают исследования эпидемиологов. Популяционные исследования имеют особую ценность, поскольку РКИ в силу своей «искусственности» (в частности, исключения больных с серьезными факторами риска), не всегда позволяют оценить вероятность развития ряда опасных, но относительно редких осложнений [3].
В настоящей работе мы предлагаем анализ достоинств и недостатков четырех препаратов, которые российским научным сообществом принято относить к селективным ЦОГ-2 ингибиторам (с-НПВП): мелоксикама, нимесулида, целекоксиба и эторикоксиба.
Крупных и хорошо организованных исследований, в которых проводилось прямое («head to head») сравнение эффективности интересующих нас препаратов, немного. Так, имеются два РКИ, в которых сравнивалось лечебное действие целекоксиба 200 мг/сутки, эторикоксиба 30 мг/сутки и плацебо у 1200 больных остеоартрозом (ОА). По всем параметрам оценки — выраженности боли, оценке самочувствия и др. — достоверной разницы между двумя коксибами выявлено не было.
Одним из наиболее показательных критериев эффективности лекарства является число больных, которые прерывают лечение из-за его неэффективности. Оценке этого показателя был посвящен специальный анализ, проведенный R. Andrew Moore и соавт. В частности, число отмен при таком заболевании, как остеоартроз, было оценено для целекоксиба в дозе 200/400 мг, эторикоксиба 30/60 мг, ибупрофена 2400 мг, напроксена 1000 мг и плацебо. Напроксен демонстрировал наибольшую эффективность — терапию этим препаратом прервали лишь 4% больных, целекоксиб фактически не отличался от эторикоксиба — 8% против 8-6%, лишь ибупрофен оказался явно хуже — 13% отмен. Однако все НПВП превосходили плацебо, на фоне приема которого прервали лечение 19% больных [6].
Имеется метаанализ, проведенный китайскими учеными и представляющий сравнение эффективности и безопасности 7 различных НПВП по данным 19 РКИ продолжительностью от 2 до 8 недель, выполненных в Китае (суммарно 4657 больных ОА и РА). Согласно полученным результатам, нимесулид демонстрировал несколько лучшее лечебное действие, чем мелоксикам — он был оценен как «эффективный» у 79,8% больных (75,7-84,0%). Мелоксикам давал значимое улучшение у 68,4% (59,2-79,6%) больных. Для примера, среди пациентов, получавших диклофенак, терапия оказалась эффективной у 77,1% (69,2-85,0%) [7].
Следует считать аксиомой: в эквивалентных дозах и при достаточном времени наблюдения (хотя бы несколько дней) все НПВП — как селективные, так и неселективные — демонстрируют одинаковую эффективность. Конечно, в ряде работ между препаратами могли фиксироваться определенные различия. Так, в знаменитом исследовании CLASS (Celecoxid long-term arthritis safety study), в ходе которого ~8000 больных РА и ОА в течение 6 месяцев принимали целекоксиб 800 мг, диклофенак 150 мг или ибупрофен 2400 мг, было показано достоверное (хотя и небольшое) преимущество с-НПВП. На фоне приема целекоксиба терапия была прервана из-за неэффективности у 12,8%, а на фоне препаратов сравнения — у 14,8% больных (р<0,05) [8]. В то же время в не менее крупном, но кратковременном исследовании MELISSA (Meloxicam large-scale international study safety assessment) (4 недели, n = 9323), в котором сравнивались мелоксикам в дозе 7,5 мг и диклофенак 100 мг/сутки, первый препарат оказался менее действенным — терапия была прервана из-за неудовлетворенности больных у 1,7% и 1,0% участников соответственно [9].
Тем не менее эти примеры не изменяют общую тенденцию. И хотя прямых сравнений мелоксикама, нимесулида и коксибов не проводилось (за исключением ряда небольших локальных работ), у нас нет оснований считать, что эти лекарства существенно различаются по своему лечебному действию.
Основным различием между этими препаратами является, безусловно, частота класс-специфических осложнений, прежде всего со стороны желудочно-кишечного тракта и сердечно-сосудистой системы, поскольку именно риск развития этих побочных эффектов является основным фактором, ограничивающим применение НПВП. По этой причине частота осложнений — важнейший критерий, отражающий достоинство тех или иных представителей селективных ЦОГ-2 ингибиторов, ведь, собственно говоря, вся эта лекарственная группа создавалась как более безопасная альтернатива традиционным НПВП.
ЖКТ-безопасность целекоксиба, по данным РКИ
Целекоксиб — единственный препарат из группы НПВП, прошедший многоплановую проверку по всем возможным параметрам безопасности. Исследователи из различных стран придирчиво и скрупулезно оценивают влияние целекоксиба на желудочно-кишечный тракт (ЖКТ), сердечно-сосудистую систему, почки, печень, кожу, органы дыхания и др., поэтому так называемая доказательная база для определения степени риска при использовании целекоксиба является наиболее репрезентативной.
Достоверное снижение риска развития опасных осложнений со стороны ЖКТ подтверждено данными масштабных РКИ — CLASS и SUCCESS-1 [8, 10]. Об этом свидетельствуют результаты метаанализа R. Andrew Moore, основанного на данных 31 РКИ целекоксиба против неселективных НПВП (н-НПВП), проведенных к 2005 г. и включавших 39 605 больных РА и ОА. В этих работах было зафиксировано суммарно 184 эпизода клинически выраженных язв и кровотечений. Было показано, что опасные осложнения со стороны ЖКТ на фоне приема целекоксиба возникали более чем в 2 раза реже, чем в контроле — 0,4 и 0,9% соответственно [11].
В 1999 г. были опубликованы данные двух масштабных РКИ, в которых оценивалось появление язв желудка и/или двенадцатиперстной кишки (ДПК) на фоне приема целекоксиба 400 мг/сутки, напроксена 1000 мг/сутки и диклофенака 150 мг/сутки, по данным эндоскопического исследования, которое проводилось всем включенным в исследование пациентам с РА (n=659 и n=400). За период наблюдения, составивший 3 и 6 месяцев, язвы были выявлены у 4 и 25% (р=0,001) и 4 и 15% (р=0,001) соответственно [12, 13].
Следует отметить, что в последние годы подход к оценке патологии ЖКТ, возникающей на фоне приема НПВП, коренным образом изменился. Если раньше областью основного внимания было развитие так называемой НПВП-гастропатии, характеризующейся повреждением верхних отделов ЖКТ, то сейчас исследователи в качестве параметра безопасности рассматривают состояние всей пищеварительной трубки. Этот подход вполне логичен, ведь НПВП могут вызывать осложнения не только со стороны желудка и начальных отделов двенадцатиперстной кишки, но также тонкой и толстой кишки. Причем нередко данная патология проявляется малозаметной кровопотерей, источником которой могут быть трудно диагностируемые изменения слизистой тощей кишки, приводящие к развитию клинически выраженной железодефицитной анемии (ЖДА).
Примером современного комплексного подхода к оценке осложнений со стороны ЖКТ, вызываемых НПВП, является работа Gurkirpal Singh и соавт. Она представляет собой метаанализ 52 РКИ (n=51048), в которых целекоксиб сравнивался с плацебо и н-НПВП — преимущественно с диклофенаком, ибупрофеном и напроксеном. Согласно полученным результатам, частота осложнений со стороны ЖКТ, включающая ЖКТ-кровотечения и перфорации верхних и нижних отделов ЖКТ, язвы желудка и ДПК, а также ЖДА, на фоне приема целекоксиба составила 1,8%. Это было несколько (недостоверно) выше, чем на плацебо — 1,2%, но намного ниже, чем при использовании «традиционных» препаратов — 5,3% (p<0,0001) [14].
В 2010 г. были опубликованы результаты РКИ CONDOR (Celecoxib versus omeprazole and diclofenac in patients with osteoarthritis and rheumatoid arthritis) — исследования, которое, несомненно, является одним из наиболее ярких и ожидаемых научных событий последних лет. Эта масштабная работа объективно доказала преимущество целекоксиба над н-НПВП и позволила дать четкий ответ на вопрос, давно волновавший практикующих врачей и организаторов медицины: что безопаснее в плане развития осложнений со стороны ЖКТ — с-НПВП или «традиционные» препараты в комбинации с ингибиторами протонной помпы (ИПП). Причем ответ на этот вопрос был получен именно с точки зрения современного комплексного подхода к оценке состояния пищеварительного тракта.
В ходе этого исследования 4481 больной с РА или ОА, имеющие факторы риска НПВП-гастропатии (язвенный анамнез или возраст старше 60 лет), но при этом не инфицированные H. pylori, в течение 6 месяцев принимали целекоксиб 400 мг/сутки или диклофенак 150 мг/сутки + омепразол 20 мг. Согласно полученным данным, комбинация «традиционного» НПВП и ИПП отчетливо уступала по своей безопасности с-НПВП. Так, число серьезных осложнений со стороны ЖКТ при использовании комбинации оказалось достоверно выше: язвы желудка/ДПК возникли у 20 и 5 больных, железодефицитная анемия — у 77 и 15, а отмена лечения из-за осложнений со стороны ЖКТ потребовалась 8 и 6% больных соответственно (р<0,001) [15].
Серьезным, хотя и не столь важным в сравнении с CONDOR доказательством относительной безопасности целекоксиба в отношении патологии тонкой кишки стало исследование Jay L. Goldstein и соавт. Эта работа основана на применении методики капсульной эндоскопии. В ходе исследования 356 добровольцев, прошедших капсульную эндоскопию и у которых не было выявлено какой-либо патологии тонкой кишки, в течение двух недель получали целекоксиб 400 мг, напроксен 1000 мг + омепразол 20 мг или плацебо. Согласно полученным результатам, изменения со стороны верхних отделов ЖКТ отмечались с одинаковой частотой. Однако в отношении патологии тонкой кишки ситуация была другой. На фоне приема целекоксиба число больных с выявленным повреждением слизистой тонкой кишки было достоверно меньше в сравнении с больными, получавшими напроксен, — 16 и 55% (p<0,001), хотя и больше в сравнении с плацебо (7%) [16].
ЖКТ-безопасность эторикоксиба, по данным РКИ
Эторикоксиб, так же как и целекоксиб, был создан для решения проблемы негативного влияния НПВП на ЖКТ. На сегодняшний день эторикоксиб — самый селективный ЦОГ-2 ингибитор. Безопасность в отношении ЖКТ (вернее, достоверно меньшая опасность развития осложнений в сравнении с н-НПВП) — его основное достоинство, подтвержденное серией масштабных, организованных с соблюдением всех требований доказательной медицины, исследований. Однако здесь имеются некоторые спорные вопросы, на которых необходимо остановить наше внимание.
Метаанализ данных РКИ, законченных к 2003 г. (всего 5441 больной), в ходе которых сравнивалась безопасность эторикоксиба и ряда н-НПВП у больных РЗ, продемонстрировал существенно меньшую частоту опасных осложнений со стороны ЖКТ при использовании этого препарата. Общая частота ЖКТ-кровотечений, перфораций и клинически выраженных язв на фоне приема эторикоксиба 60-120 мг составила 1,24%, в то время как при использовании препаратов сравнения (диклофенак, напроксен, ибупрофен) — 2,48% (p<0,001) [17].
Четким подтверждением большей безопасности эторикоксиба в отношении развития НПВП-гастропатии стали 2 крупных двенадцатинедельных РКИ (n = 742 и n = 680), в которых оценивалась частота развития эндоскопических язв у пациентов РА и ОА, принимавших эторикоксиб в дозе 120 мг, ибупрофен 2400 мг, напроксен 1000 мг или плацебо. Суммарная частота язв желудка и ДПК на фоне приема эторикоксиба составила 8,1 и 7,4%, что оказалось более чем в 2 раза меньше по сравнению с н-НПВП — 17 и 25,3% (p<0,001), хотя и выше в сравнении с плацебо (1,9 и 1,4%). Следует отметить, что прием эторикоксиба не увеличивал выделение крови с калом, в то время как на фоне ибупрофена кровопотеря возрастала более чем в 3 раза (3,26, p<0,001) [18].
Самой главной проверкой достоинств эторикоксиба стала исследовательская программа MEDAL (Multinational etoricoxib and diclofenac arthritis long-term programme). Это наиболее крупное и длительное исследование НПВП в мировой практике — в него был включен 34 701 пациент с ОА и РА, которые в среднем в течение 1,5 лет непрерывно принимали эторикоксиб в дозе 60 или 90 мг, или диклофенак 150 мг/сутки. Дизайн MEDAL моделировал реальную клиническую практику и допускал использование гастропротекторов у больных с серьезными факторами риска НПВП-гастропатии, а также аспирина в низкой дозе при наличии кардиоваскулярных факторов риска [19].
Полученные результаты подтвердили лучшую переносимость эторикоксиба. Общая частота осложнений со стороны ЖКТ при использовании этого препарата оказалась существенно ниже в сравнении с диклофенаком — 1,0 и 1,4% соответственно (р<0,001). Число отмен терапии из-за осложнений со стороны ЖКТ также было значительно ниже при использовании эторикоксиба и достигало (в зависимости от дозы и диагноза) 8,6%, в то время как в контрольной группе составляло до 11,2% (р<0,001) [20].
В то же время число эпизодов ЖКТ-кровотечений и перфораций на фоне приема эторикоксиба и диклофенака было практически одинаковым — 0,3 и 0,32 на 100 пациентов/лет. Этот факт вызывает некоторое недоумение, ведь именно снижение риска опасных осложнений со стороны ЖКТ считается основным достоинством эторикоксиба по сравнению с «традиционными» НПВП. Конечно, имеется вполне рациональное объяснение данного результата: существенная доля больных получала низкие дозы аспирина (а он, как известно, значительно повышает опасность развития осложнений со стороны ЖКТ при использовании с-НПВП). К тому же не менее значимая доля больных получали ИПП, которые «защищали» пациентов с факторами риска НПВП-гастропатии и принимавших диклофенак [20].
Сложнее объяснить другой факт — оказалось, что частота осложнений со стороны нижних отделов ЖКТ также фактически не различалась при приеме эторикоксиба и диклофенака. Их общее количество составило 0,32 и 0,38 на 100 пациентов/лет, причем наиболее часто из этих осложнений были отмечены кишечные кровотечения — 0,19 и 0,23 эпизода соответственно. И здесь уже невозможно говорить о роли ИПП, ведь гастропротекторы защищают только верхние отделы ЖКТ [21].
ЖКТ-безопасность мелоксикама и нимесулида, по данным РКИ
В нашей стране мелоксикам и нимесулид принято причислять к селективным НПВП. Хотя с этим согласны далеко не все эксперты, однако едва ли имеет смысл вступать в терминологическую дискуссию, тем более что для клинической практики важно не наименование препарата в соответствии с той или иной классификацией, а реальный уровень его безопасности.
ЖКТ-безопасность мелоксикама прошла серьезную проверку. Не вызывает сомнения, что этот препарат лучше переносится, чем н-НПВП, однако это верно только в случае, если его использовать в дозе 7,5 мг/сутки. Такое заключение можно сделать на основании данных двух масштабных четырехнедельных РКИ (суммарно почти 18 тыс. больных) — MELISSA и SELECT (Safety and efficacy largescale evaluation of COX-inhibiting therapies trial in osteoarthritis) [9, 22]. Так, в исследовании MELISSA (n=9323) прием мелоксикама в дозе 7,5 мг достоверно реже по сравнению с диклофенаком 100 мг вызывал нежелательные эффекты со стороны ЖКТ — 13,3 и 18,7%, в том числе потребовавшие прекращения терапии — 3,0 и 6,1% (р<0,001). При этом серьезные осложнения со стороны ЖКТ на фоне приема мелоксикама отмечались недостоверно реже — 5 и 7 случаев соответственно. РКИ SELECT (n=8656) имело аналогичный дизайн, однако в качестве сравнения использовался пироксикам в дозе 20 мг. Это исследование показало достоверное преимущество мелоксикама в отношении риска развития серьезных осложнений со стороны ЖКТ, возникших у 7 и 16 больных соответственно (р<0,05). Так же, как и в MELISSA, диспепсия и связанные с ней эпизоды отмены терапии достоверно чаще отмечалась у больных, получавших препарат сравнения — 10,3 и 3,8% против 15,4 и 5,3% соответственно (р<0,001).
Однако длительные исследования, в которых изучалась безопасность более высоких доз мелоксикама — 15 мг и 22,5 мг/сутки, — не позволили выявить существенных различий в частоте опасных осложнений со стороны ЖКТ между этим препаратом и диклофенаком [23, 24]. Это четко показывают результаты метаанализа 28 РКИ (n=24196), в которых мелоксикам сравнивался с н-НПВП: частота ЖКТ-кровотечений при использовании дозы 7,5 мг/сутки составила 0,03%, а 15 мг — уже 0,2%, в то время как на фоне приема диклофенака в дозе 100-150 мг/сутки — 0,15% [25].
Сравнительная безопасность нимесулида не проходила проверки в РКИ, сопоставимых по своим размерам с исследованиями целекоксиба, эторикоксиба и мелоксикама. В то же время в Европе и России было проведено немало работ по оценке лечебного действия и переносимости нимесулида при самых различных заболеваниях. Среди них есть и длительные, 6-12-месячные исследования нимесулида у больных ОА. Их результаты демонстрируют, что суммарное число осложнений со стороны ЖКТ при использовании нимесулида достоверно ниже, чем на фоне приема н-НПВП. Однако речь идет лишь о диспепсии или неосложненных язвах. Поскольку число пациентов в этих исследованиях было относительно невелико (от нескольких десятков до 300), четких данных о снижении риска опасных осложнений со стороны ЖКТ, таких как кровотечения, в этих работах получить не удалось [26-32].
Мы не располагаем информацией о крупных и хорошо организованных испытаниях мелоксикама и нимесулида, основанных на проведении плановой эндоскопии верхних отделов ЖКТ всем включенным в них больных (так называемые эндоскопические исследования). Для этих препаратов также нет четких данных о риске развития осложнений со стороны нижних отделов ЖКТ.
Кардиоваскулярные осложнения при использовании целекоксиба, эторикоксиба, мелоксикама и нимесулида, по данным РКИ
После печально знаменитого «кризиса коксибов» риск осложнений со стороны сердечно-сосудистой системы при использовании целекоксиба и эторикоксиба оказался областью пристального внимания исследователей и организаторов медицины.
По данным метаанализа РКИ (n=33763), в которых целекоксиб в дозе от 200 до 800 мг/сутки применялся для лечения боли, связанной с ревматологической патологией, риск кардиоваскулярных катастроф при использовании этого представителя коксибов не превышал аналогичный для н-НПВП. Суммарно сердечно-сосудистые осложнения возникли на фоне приема целекоксиба и н-НПВП у 0,96 и 1,12% больных, из них острая коронарная смерть — у 0,21 и 0,41%, инфаркт миокарда — у 0,57 и 0,34%, а ишемический инсульт — у 0,18 и 0,34% [33].
Большое значение для оценки кардиоваскулярной безопасности НПВП имеет риск дестабилизации артериальной гипертензии. С одной стороны, артериальное давление легко поддается инструментальному контролю, и поэтому может считаться весьма удобным показателем негативного влияния НПВП на сердечно-сосудистую систему. С другой стороны, артериальная гипертензия — один из наиболее важных факторов риска кардиоваскулярных катастроф.
В данной связи большой интерес представляет работа William B. White и соавт., которые оценивали влияние целекоксиба в дозе 400 мг/сутки и плацебо на уровень артериального давления (по данным суточного мониторирования артериального давления). Исследуемую группу составили 178 больных, получавших эффективную антигипертензивную терапию (лизиноприл 10-40 мг/сутки). Через 4 недели наблюдения не было отмечено достоверной отрицательной динамики артериального давления, как в основной, так и в контрольных группах — изменение систолического артериального давления (САД) в среднем составило 2,6±0,9 и 1,0±1,0, а диастолического (ДАД) — 1,5±0,6 и 0,3±0,6 мм рт. ст. соответственно. При этом соотношение больных, у которых при контрольном суточном мониторировании артериального давления отмечалось его повышение в среднем более 5 мм рт. ст., оказалось одинаковым [34].
Важные результаты были получены в РКИ CRESCENT (Celecoxib rofecoxib efficacy and safety in comorbidities evaluation trial), в котором оценивалось влияние целекоксиба на артериальное давление у больных с высоким кардиоваскулярным риском. В работу были включены 411 пациентов с остеоартрозом и сахарным диабетом второго типа, имевших контролируемую артериальную гипертензию. Согласно плану исследования, они в течение 6 недель принимали целекоксиб в дозе 200 мг, рофекоксиб 25 мг или напроксен 1000 мг/сутки. Дестабилизация артериальной гипертензии (среднее повышение САД выше 135 мм рт. ст.) на фоне приема целекоксиба была отмечена у 16% больных, в то время как на фоне приема напроксена — у 19%, а рофекоксиба — у 30%. Таким образом, целекоксиб влиял на артериальное давление даже в меньшей степени, чем общепризнанный стандарт кардиоваскулярной безопасности — напроксен [35].
Эторикоксиб также активно изучался в плане риска развития сердечно-сосудистых осложнений. Анализ предрегистрационных исследований (фаза IIb/III), в которых проводилось сравнение эффективности и безопасности эторикоксиба с плацебо и н-НПВП у пациентов, страдающих остеоартрозом, ревматоидным артритом, анкилозирующим спондилоартритом и болью в нижней части спины, не показал существенного риска. Среди ~6500 больных, включенных в эти исследования, кардиоваскулярные катастрофы были отмечены у 64 человек. Оказалось, что существенной разницы между эторикоксибом и плацебо в отношении риска развития этой патологии не было (относительный риск (ОР) 1,11; 0,32-3,81). В сравнении с ибупрофеном и диклофенаком, прием эторикоксиба ассоциировался с меньшей частотой кардиоваскулярных осложнений (ОР 0,83; 0,26-2,64), хотя и уступал напроксену (ОР 1,70; 0,91-3,18) [36].
Главной проверкой кардиоваскулярной переносимости эторикоксиба стало упомянутое выше исследование MEDAL. Следует отметить, что исследуемая группа была серьезно отягощена кардиоваскулярными факторами риска. При среднем возрасте 63,2 года около 41% в каждой группе составляли лица старше 65 лет, по 38% имели 2 и более стандартных фактора риска сердечно-сосудистых осложнений. В обеих группах, примерно 47% больных страдали диагностированной артериальной гипертензией. Тем не менее частота кардиоваскулярных осложнений на фоне приема эторикоксиба и диклофенака была одинаковой — всего 320 и 323 эпизодов (1,24 и 1,3 случаев на 100 пациентов/лет). Одинаковым оказалось и число летальных исходов, связанных с кардиоваскулярными осложнениями — по 43 (0,26%) [37].
Однако эторикоксиб при этом отчетливо негативно влиял на артериальное давление. Так, для эторикоксиба и диклофенака среднее повышение систолического/диастолического давления составило 3,4-3,6/1,0-1,5 и 0,9-1,9/0,0-0,5 мм рт. ст. соответственно. Терапия была прервана из-за развития или дестабилизации артериальной гипертензии у 2,2-2,5% больных, получавших эторикоксиб, и у 0,7-1,6%, получавших диклофенак [37].
Кардиоваскулярная безопасность мелоксикама изучена недостаточно. Практически все исследования этого препарата проводились в 1990-х гг., когда активного внимания проблеме сердечно-сосудистых осложнений НПВП еще не уделялось. С другой стороны, наиболее крупные РКИ — MELISSA и SELECT — слишком кратковременны, чтобы выявить существенную разницу по частоте подобных осложнений между мелоксикамом и препаратами сравнения.
Данные плацебо контролируемых РКИ показывают отсутствие разницы между мелоксикамом и плацебо в отношении влияния на развитие тромбоэмболических осложнений, однако эти работы кратковременны и невелики [38].
Согласно данным метаанализа 28 РКИ (10 709 пациентов, принимавших мелоксикам в дозе 7,5 мг, 4644 — мелоксикам в дозе 15 мг и 5957 — диклофенак 100-150 мг), частота сердечно-сосудистых осложнений при использовании мелоксикама 7,5 мг составляла 0,09%, 15 мг — 0,19%, а для диклофенака — 0,22% [25].
Четкие данные о кардиоваскулярной безопасности нимесулида, основанные на результатах контролируемых клинических исследований, отсутствуют.
Сравнение безопасности различных с-НПВП, по данным РКИ
Как было отмечено выше, клинические исследования, в которых проводилось прямое сопоставление эффективности и безопасности с-НПВП, весьма немногочисленны. Одной из таких работ является сравнение эторикоксиба в дозе 30 мг/сутки и целекоксиба 200 мг/сутки в ходе двух хорошо организованных многоцентровых шестимесячных РКИ. Препараты назначались больным ОА, при этом 477 пациентов получали эторикоксиб, 488 — целекоксиб, а 244 — плацебо. Число осложнений достоверно не различалось — суммарно терапия из-за побочных эффектов была прервана у 3,9, 4,1 и 7,4% больных соответственно, при этом проблемы со стороны ЖКТ потребовали прекращения лечения у 1,3, 0,82 и 2,0% больных. Серьезных осложнений со стороны ЖКТ было лишь два — по одному на фоне приема эторикоксиба и целекоксиба (клинически выраженные язвы). Число кардиоваскулярных осложнений не различалось — за все время было отмечено лишь 3 таких эпизода (2 на целекоксибе и 1 на эторикоксибе). При этом развитие или дестабилизация артериальной гипертензии потребовала прервать лечение у 4% больных, получавших эторикоксиб, у 2,5% пациентов, получавших целекоксиб, и у 0,8% больных на плацебо [5].
Нам не удалось найти информацию о хорошо организованных исследованиях, посвященных сравнению безопасности нимесулида, целекоксиба и эторикоксиба. Сопоставить частоту осложнений, возникающих на фоне мелоксикама и нимесулида, можно по данным приведенного выше метаанализа 19 РКИ, выполненных в Китае (n = 4657). Согласно его результатам, мелоксикам оказался безопаснее: суммарное число осложнений при его использовании составило 10,2% (4,2-16,2%), тогда как на нимесулиде в 2 раза больше — 20,2% (16,0-24,3%). Для сравнения, использование диклофенака сопровождалось осложнениями у 19,3% (11,9-26,7%) больных. К сожалению, оценить уровень значимости этого интереснейшего исследования затруднительно из-за сложности доступа к первоисточникам (статья на китайском языке) [7].
Сравнение безопасности различных с-НПВП, по данным популяционных и ретроспективных наблюдательных исследований
Крупные эпидемиологические и ретроспективные наблюдательные исследования — важнейший источник объективной информации об уровне безопасности препаратов в реальной клинической практике. Работы этого рода позволяют сопоставить риск развития ЖКТ- и сердечно-сосудистых осложнений при использовании различных с-НПВП, компенсируя тем самым недостаточное количество сравнительных РКИ.
Так, сравнительный риск ЖКТ-кровотечений при использовании целекоксиба, мелоксикама и нимесулида можно оценить по результатам исследования Joan-Ramon Laporte и соавт. (случай — контроль). Для своих расчетов авторы использовали информацию о 2813 эпизодах этого тяжелого осложнения, 7193 пациента составили соответствующий контроль. Относительный риск кровотечения был наименьшим для целекоксиба — 0,3, существенно выше для мелоксикама — 5,7 и нимесулида — 3,2. Для примера, диклофенак ассоциировался с аналогичным риском — ОР 3,7 [39].
Весьма показательны результаты метаанализа, в котором изучался сравнительный риск ЖКТ-кровотечений для наиболее популярных в Европе НПВП в соответствии с данными всех крупных популяционных работ, опубликованных с 2000 по 2008 г. Elvira L. Masso Gonzalez и соавт. продемонстрировали: мелоксикам отчетливо уступает целекоксибу: риск кровотечения для него составил 4,2 (несколько выше, чем для диклофенака — 4,0), а для целекоксиба — 1,4. Любопытно отметить, что в этом исследовании один из представителей н-НПВП — ацеклофенак — показал низкий уровень риска ЖКТ-кровотечений, аналогичный целекоксибу, — 1,42 [40].
Ретроспективный анализ сравнительной безопасности мелоксикама и целекоксиба был проведен британскими учеными. Они изучили частоту клинически значимых осложнений со стороны ЖКТ на фоне мелоксикама (19 111 больных (1996-1997)) и целекоксиба (17 567 больных (2000)) в реальной клинической практике. Согласно полученным данным, какое-либо осложнение со стороны ЖКТ было отмечено у 7,2% больных, получавших мелоксикам, и у 6,0% больных, принимавших целекоксиб. Кровотечения и перфорации язв на фоне приема мелоксикама в сравнении с целекоксибом возникли в 2 раза чаще — у 0,4 и 0,2% больных соответственно. Приняв за 1,0 риск развития ЖКТ-кровотечения на фоне приема н-НПВП, после пересчета данных с учетом наличия факторов риска (с-НПВП чаще назначались у больных с высоким риском) снижение аналогичного риска при использовании мелоксикама составило 14%, а для целекоксиба — 62% [41].
К сожалению, эторикоксиб очень редко фигурирует в популяционных работах, вероятно, потому что этот препарат используется сравнительно недавно. Тем не менее можно привести ретроспективное исследование таиландских ученых, в котором сравнивается безопасность этого препарата и целекоксиба. Авторы наблюдали когорту из 1030 больных, которые за период с 2004 по2007 г. регулярно получали НПВП — 31,6% н-НПВП (к которым, кстати, были отнесены нимесулид и мелоксикам), 35,2% — целекоксиб, а 33,2% — эторикоксиб. Взяв риск осложнений со стороны ЖКТ при использовании н-НПВП за 1,0, они рассчитали, что риск развития данной патологии для целекоксиба составляет 0,36, а для эторикоксиба — 0,52 [42].
Серия эпидемиологических исследований, выполненных в последние годы в разных частях света, позволяет оценить сравнительный уровень риска кардиоваскулярных осложнений при использовании различных с-НПВП. Правда, большая часть информации по этому вопросу получена для целекоксиба и мелоксикама, а эторикоксиб и нимесулид фигурируют лишь в единичных работах.
Таблица 1. Риск осложнений со стороны ЖКТ и сердечно-сосудистой системы при использовании селективных и неселективных НПВП, по данным клинических исследований
| Параметры оценки безопасности | Препарат | |||
| Целекоксиб | Эторикоксиб | Мелоксикам | Нимесулид | |
| Общая частота осложнений со стороны ЖКТ (включая диспепсию) |
Достоверно ниже в сравнении с н-НПВП |
Достоверно ниже в сравнении с н-НПВП |
Достоверно ниже в сравнении с н-НПВП |
Достоверно ниже в сравнении с н-НПВП |
| Серьезные осложнения со стороны верхних отделов ЖКТ |
Достоверно ниже в сравнении с н-НПВП |
Достоверно ниже в сравнении с н-НПВП |
Ниже по сравнению с н-НПВП в дозе 7,5 мг; в более высоких дозах не отличается от н-НПВП |
Неизвестно |
| Эндоскопические язвы | Достоверно ниже в сравнении с н-НПВП |
Достоверно ниже в сравнении с н-НПВП |
Неизвестно* | Неизвестно* |
| Серьезные осложнения со стороны нижних отделов ЖКТ |
Достоверно ниже в сравнении с н-НПВП |
Не отличается от н-НПВП (диклофенак) |
Неизвестно | Неизвестно |
| Кардиоваскулярные осложнения | Не отличается от н-НПВП |
Не отличается от н-НПВП** |
Не отличается от н-НПВП |
Не отличается от н-НПВП |
* Имеются отдельные открытые кратковременные или ретроспективные исследования, показывающие меньший риск развития эндоскопических язв при использовании нимесулида и мелоксикама в сравнении с н-НПВП, однако уровень исполнения этих исследований не слишком высокий.
** Оказывает четко негативное влияние на дестабилизацию артериальной гипертензии.
Последним крупным популяционным исследованием сравнительной сердечно-сосудистой безопасности НПВП, стала работа датских ученых, опубликованная в 2010 г. Emil Loldrup Fosbol и соавт. проанализировали частоту кардиоваскулярных катастроф у 1 028 427 условно здоровых жителей Дании, которые за 5 лет до исследования не госпитализировались по поводу какого-либо заболевания. Почти половине из них за период с 1997 по 2005 г. хотя бы один раз назначались НПВП: 301001 человек получал ибупрофен, 172362 — диклофенак, 40904 — напроксен, 16079 — рофекоксиб и 15599 — целекоксиб. Из 545945 пациентов от патологии сердечнососудистой системы скончались 2204 человека. Сопоставив частоту кардиоваскулярных осложнений между людьми, получавшими и не получавшими НПВП, авторы определили относительный риск развития данной патологии для различных препаратов этой лекарственной группы. Так, риск гибели от кардиоваскулярных причин не был повышен для напроксена, ибупрофена и целекоксиба — ОР 0,84 (0,50-1,42), ОР 1,08 (0,90-1,29) и ОР 0,92 (0,56-1,51) соответственно, но был значимо выше для рофекоксиба — ОР 1,66 (1,06-2,59) и особенно диклофенака — ОР 1,91 (1,62-2,42). Весьма интересными оказались результаты анализа риска развития отдельных осложнений — кардио- и цереброваскулярных. Риск коронарной смерти и нефатального инфаркта миокарда был повышен для ибупрофена, диклофенака и обоих коксибов — 1,52, 1,82, 1,72, 1,93 соответственно. Лишь напроксен не ассоциировался с повышением этого риска — 0,98. Зато прием напроксена отчетливо повышал риск развития фатального и нефатального инсульта — 1,91, даже больше, чем диклофенак — 1,71; ибупрофен, рофекоксиб и целекоксиб выглядели существенно более безопасными — ОР составил 1,29, 1,14 и 1,2 соответственно. Как видно, по всем параметрам целекоксиб оказался более безопасным в отношении сердечно-сосудистой системы, чем диклофенак [43].
Уровень кардиоваскулярного риска при использовании различных с-НПВП можно сопоставить, ориентируясь на данные эпидемиологических исследований, проведенных в США (Gurkirpal Singh и соавт.: 15343 больных с инфарктом миокарда, 61372 — контроль) и Финляндии (Arja Helin-Salmivaara и соавт.: 33309 больных с инфарктом миокарда, 138949 — контроль). В обеих работах мелоксикам демонстрировал несколько более высокий риск развития инфаркта миокарда (1,32, 1,25) в сравнении с целекоксибом (1,09, 1,06) и диклофенаком (1,05, 1,35) [44, 45].
Аналогичные результаты показала работа Patricia McGettigan и David Henry, которые провели метаанализ данных 17 исследований «случай — контроль»: 86193 больных с ИМ и 527236 — контроль; 6 когортных исследований: 75520 на с-НПВП, 375619 на н-НПВП и 594720 лиц в качестве контроля. Относительный риск инфаркта миокарда для целекоксиба составил 1,06, для мелоксикама — 1,25 [46].
Оценка кардиоваскулярного риска, связанного с приемом нимесулида, по всей видимости, может быть ограничено лишь работой Arja Helin-Salmivaara и соавт. Нимесулид демонстрировал частоту инфаркта миокарда, близкую другим НПВП (ОR 1,69); при приеме целекоксиба этот показатель был ниже (ОR 1,09) [45].
Таблица 2. Риск осложнений со стороны ЖКТ и сердечно-сосудистой системы при использовании селективных и неселективных НПВП, по данным популяционных и ретроспективных наблюдательных исследований
| Препарат | Параметры оценки безопасности | |
| Серьезные осложнения со стороны ЖКТ | Кардиоваскулярные катастрофы | |
| Целекоксиб | Существенно ниже в сравнении с н-НПВП, мелоксикамом и нимесулидом |
Ниже в сравнении с диклофенаком, но выше напроксена |
| Эторикоксиб | Нет данных | Нет данных |
| Мелоксикам | Не отличается от н-НПВП (диклофенак, ибупрофен, напроксен) |
Примерно равен другим НПВП, включая целекоксиб |
| Нимесулид | Не отличается от н-НПВП (диклофенак, ибупрофен, напроксен) |
Примерно равен другим НПВП, включая целекоксиб |
По данным цитированного ретроспективного анализа, проведенного в Великобритании, общее число сердечно-сосудистых осложнений при использовании целекоксиба несколько (но недостоверно) выше, в сравнении с мелоксикамом, — частота кардиоваскулярных проблем составила 0,16 и 0,1%, цереброваскулярных — 0,39 и 0,27% соответственно. При этом тромбозы периферических сосудов возникали с одинаковой частотой — 0,1% [47].
Заключение
Таким образом, на сегодняшний день, по данным клинических, ретроспективных наблюдательных и популяционных исследований, наиболее безопасным среди с-НПВП является целекоксиб. В сравнении с «традиционными» НПВП, для него доказан достоверно более низкий риск развития осложнений со стороны ЖКТ, причем как верхних отделов (кровотечения, эндоскопические язвы, диспепсия), так и нижних отделов (энтеропатия, кишечные кровотечения, железодефицитная анемия, связанная с повышением кишечной проницаемости). По данным наблюдательных ретроспективных и эпидемиологических исследований, в реальной клинической практике целекоксиб реже вызывает серьезные осложнения со стороны ЖКТ, чем мелоксикам и нимесулид (табл. 1).
На популяционном уровне у лиц, принимающих целекоксиб (так же, как на фоне приема любых других НПВП, включая напроксен), отмечается более высокий риск развития осложнений со стороны сердечно-сосудистой системы, чем у людей, не получавших каких-либо препаратов из этой группы. Однако этот риск несколько ниже в сравнении с мелоксикамом и нимесулидом (табл. 2).
Эторикоксиб, так же как целекоксиб, демонстрирует более низкую частоту осложнений со стороны ЖКТ в сравнении с н-НПВП. Это положение подтверждается серией хорошо организованных клинических исследований. Однако речь идет лишь о патологии верхних отделов (кровотечения, эндоскопические язвы, диспепсия). В отношении нижних отделов ЖКТ ситуация с эторикоксибом остается неясной, поскольку результаты наиболее крупного РКИ этого препарата (MEDAL) не показали достоверной разницы по частоте кишечных осложнений, в сравнении с диклофенаком.
Согласно данным клинических исследований, риск развития кардиоваскулярных катастроф на фоне приема эторикоксиба не отличается от н-НПВП. Однако при этом эторикоксиб, в отличие от других с-НПВП, четко негативно влияет на артериальное давление, способствуя дестабилизации артериальной гипертензии.
Результаты двух РКИ показали, что эторикоксиб не отличается по частоте осложнений со стороны ЖКТ от целекоксиба. Поскольку эторикоксиб не фигурирует в крупных популяционных или ретроспективных исследованиях, нет возможности сопоставить реальный уровень развития риска осложнений со стороны ЖКТ и сердечно-сосудистой системы при терапии эторикоксибом и другими представителями группы с-НПВП.
Не вызывает сомнений, что мелоксикам и нимесулид в целом лучше переносятся, чем н-НПВП. Однако снижение частоты серьезных осложнений со стороны ЖКТ доказано лишь при использовании мелоксикама в дозе 7,5 мг, но не больших доз. Ситуация с нимесулидом остается не совсем ясной, так как четких подтверждений его большей безопасности в отношении серьезных осложнений со стороны ЖКТ до настоящего времени не получено. Нет неоспоримых доказательств, что мелоксикам и нимесулид реже вызывают язвы верхних отделов ЖКТ, а также патологию тонкого и толстого кишечника, в сравнении с н-НПВП.
Популяционные исследования не подтверждают существенного различия по риску развития ЖКТ- и кардиоваскулярных осложнений при использовании мелоксикама и нимесулида в сравнении с «традиционными» НПВП.
Список использованной литературы
- Ревматология: клинические рекомендации / Под ред. Е.Л. Насонова. М.: ГЭОТАР-Медиа, 2010. 752 с.
- Насонов Е.Л. Нестероидные противовоспалительные препараты (Перспективы применения в медицине). М.: Анко, 2000. 142 с.
- Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б., Кукушкин М.Л., Дроздов В.Н., Исаков В.А., Насонов Е.Л. Применение нестероидных противовоспалительных препаратов: клинические рекомендации. М., ИМА-ПРЕСС, 2009. 167 с.
- Ziegler S., Huscher D., Karberg K., Krause A, Wassenberg S, Zink A. Trends in treatment and outcomes of rheumatoid arthritis in Germany 1997-2007: results from the National Database of the German Collaborative arthritis Centers // Ann. Rheum. Dis. Vol. 69. 2010. № 10. P. 1803-1808.
- Bingham C.O., Sebba A.I., Rubin B.R., Ruoff G.E., Kremer J., Bird S., Smugar S.S., Fitzgerald B.J., O’Brien K., Tershakovec A.M. Efficacy and safety of etoricoxib 30 mg and celecoxib 200 mg in the treatment of osteoarthritis in two identically designed, randomized, placebo-controlled, non-inferiority studies // Rheumatology (Oxf.). Vol. 46. 2007. № 3. P. 496-507.
- Moore R.A., Derry S., McQuay H.J. Discontinuation rates in clinical trials in musculoskeletal pain: meta-analysis from etoricoxib clinical trial reports // Arthritis Res. Ther. Vol. 10. 2008. № 3. R53.
- Shi W., Wang Y.M., Cheng N.N., Chen B.Y., Li D. Meta-analysis on the effect and adverse reaction on patients with osteoarthritis and rheumatoid arthritis treated with non-steroidal anti-inflammatory drugs // Zhonghua Liu Xing Bing Xue Za Zhi. Vol. 24. 2003. № 11. P. 1044-1048.
- Silverstein F.E., Faich G., Goldstein J.L. et al. Gastrointestinal toxicity with celecoxib versus nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: a randomized controlled trial. Celecoxid long-term arthritis safety study // JAMA. Vol. 284. 2000. № 10. P. 1247-1255.
- Hawkey C., Kahan A., Steinbruck K., Alegre C., Baumelou E., Begaud B., Dequeker J., Isomaki H., Littlejohn G., Mau J., Papazoglou S. Gastrointestinal tolerability of meloxicam compared to diclofenac in osteoarthritis patients. International MELISSA Study Group. Meloxicam Large-scale International Study Safety Assessment // Br. J. Rheumatol. Vol. 37. 1998. № 9. P. 937-945.
- Singh G., Fort J.G., Goldstein J.L., Levy R.A., Hanrahan P.S., Bello A.E., Andrade-Ortega L., Wallemark C., Agrawal N.M., Eisen G.M., Stenson W.F., Triadafilopoulos G. Celecoxib versus naproxen and diclofenac in osteoarthritis patients: SUCCESS-I Study // Am. J. Med. Vol. 119. 2006. № 3. P. 255-266.
- Moore R.A., Derry S., Makinson G.T., McQuay H.J. Tolerability and adverse events in clinical trials of celecoxib in osteoarthritis and rheumatoid arthritis: systematic review and meta-analysis of information from company clinical trial reports // Arthritis Res. Ther. Vol. 7. 2005. № 3. P. 644-665.
- Simon L.S., Weaver A.L., Graham D.Y., Kivitz A.J., Lipsky P.E., Hubbard R.C., Isakson P.C., Verburg K.M., Yu S.S., Zhao W.W., Geis G.S. Anti-inflammatory and upper gastrointestinal effects of celecoxib in rheumatoid arthritis: a randomized controlled trial // JAMA. Vol. 282. 1999. № 20. P. 1921-1928.
- Emery P., Zeidler H., Kvien T.K., Guslandi M., Naudin R., Stead H., Verburg K.M., Isakson P.C., Hubbard R.C., Geis G.S. Celecoxib versus diclofenac in long-term management of rheumatoid arthritis: randomized double-blind comparison // Lancet. Vol. 354. 1999. № 9196. P. 2106-2111.
- Singh G., Triadafilopoulos G., Agrawal N., Makinson G., Li C., Nguyen H. Safety without borders: upper and lower gastrointestinal safety of celecoxib in a pooled analysis of 52 prospective, randomised, doubleblinded, parallel-group clinical trials [abstract] // Arthritis Rheum. Vol. 62. 2010. Suppl. 10. P. 2205.
- Chan F.K., Lanas A., Scheiman J., Berger M.F., Nguyen H., Goldstein J.L. Celecoxib versus omeprazole and diclofenac in patients with osteoarthritis and rheumatoid arthritis (CONDOR): a randomised trial // Lancet. Vol. 376. 2010. № 9736. P. 173-179.
- Goldstein J.L., Eisen G.M., Lewis B., Gralnek I.M., Zlotnick S., Fort J.G. Video capsule endoscopy to prospectively assess small bowel injury with celecoxib, naproxen plus omeprazole, and placebo // Clin. Gastroenterol. Hepatol. Vol. 3. 2005. № 2. P. 133-141.
- Ramey D.R., Watson D.J., Yu C., Bolognese J.A., Curtis S.P., Reicin A.S. The incidence of upper gastrointestinal adverse events in clinical trials of etoricoxib vs. non-selective NSAIDs: an updated combined analysis // Curr. Med. Res. Opin. Vol. 21. 2005. № 5. P. 715-722.
- Hunt R.H., Harper S., Watson D.J., Yu C., Quan H., Lee M., Evans J.K., Oxenius B. The gastrointestinal safety of the COX-2 selective inhibitor etoricoxib assessed by both endoscopy and analysis of upper gastrointestinal events // Am. J. Gastroenterol. Vol. 98. 2003. № 8. P. 1725-1733.
- Cannon C.P., Curtis S.P., FitzGerald G.A., Krum H., Kaur A., Bolognese J.A., Reicin A.S., Bombardier C., Weinblatt M.E., van der Heijde D., Erdmann E., Laine L. Cardiovascular outcomes with etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) programme: a randomised comparison // Lancet. Vol. 368. 2006. № 9549. P. 1771-1781.
- Laine L., Curtis S.P., Cryer B., Kaur A., Cannon C.P. Assessment of upper gastrointestinal safety of etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) programme: a randomized comparison // Lancet. Vol. 369. 2007. № 9560. P. 465-473.
- Laine L., Curtis S.P., Langman M., Jensen D.M., Cryer B., Kaur A., Cannon C.P. Lower gastrointestinal events in a double-blind trial of the cyclo-oxygenase-2 selective inhibitor etoricoxib and the traditional nonsteroidal anti-inflammatory drug diclofenac // Gastroenterology. Vol. 135. 2008. № 5. P. 1517-1525.
- Dequeker J., Hawkey C., Kahan A., Steinbruck K., Alegre C., Baumelou E., Begaud B., Isomaki H., Littlejohn G., Mau J., Papazoglou S. Improvement in gastrointestinal tolerability of the selective cyclooxygenase (COX)-2 inhibitor, meloxicam, compared with piroxicam: results of the Safety and Efficacy Large-scale Evaluation of COX-inhibiting Therapies (SELECT) trial in osteoarthritis // Br. J. Rheumatol. Vol. 37. 1998. № 9. P. 946-951.
- Yocum D., Fleischmann R., Dalgin P., Caldwell J., Hall D., Roszko P. Safety and efficacy of meloxicam in the treatment of osteoarthritis: a 12-week, double-blind, multiple-dose, placebo-controlled trial. The Meloxicam Osteoarthritis Investigators // Arch. Intern. Med. Vol. 160. 2000. № 19. P. 2947-2954.
- Furst D.E., Kolba K.S., Fleischmann R., Silverfield J., Greenwald M., Roth S., Hall D.B., Roszko P.J. Dose response and safety study of meloxicam up to 22.5 mg daily in rheumatoid arthritis: a 12 week multicenter, double blind, dose response study versus placebo and diclofenac // J. Rheumatol. Vol. 29. 2002. № 3. P. 436-446.
- Singh G., Lanes S., Triadafilopoulos G. Risk of serious upper gastrointestinal and cardiovascular thromboembolic complications with meloxicam // Am. J. Med. Vol. 117. 2004. № 2. P. 100-106.
- Lucker P.W., Pawlowski C., Friedrich I., Faiella F., Magni E. Doubleblind, randomised, multi-centre clinical study evaluating the efficacy and tolerability of nimesulide in comparison with etodalac in patients suffering from osteoarthritis of the knee // Eur. J. Rheumatol. Inflamm. Vol. 14. 1994. № 2. P. 29-38.
- Huskisson E.C., Macciocchi A., Rahlfs V.W., Bernstein R.M., Bremner A.D., Doyle D.V., Molloy M.G., Burton A.E. Nimesulide versus diclofenac in the treatment of osteoarthritis of the hip or knee: an active controlled equivalence study // Curr. Ther. Res. Vol. 60. 1999. № 5. P. 253-265.
- Kriegel W., Korff K.J., Ehrlich J.C., Lehnhardt K., Macciocchi A., Moresino C., Pawlowski C. Double-blind study comparing the long-term efficacy of the COX-2 inhibitor nimesulide and naproxen in patients with osteoarthritis // Int. J. Clin. Pract. Vol. 55. 2001. № 8. P. 510-514.
- Bradbury F. How important is the role of the physician in the correct use of a drug? An observational cohort study in general practice // Int. J. Clin. Pract. Vol. 58. 2004. Suppl. s144. P. 27-32.
- Минушкин О.Н. Использование препарата «Найз» у больных, страдающих сочетанной патологией суставов и поражением верхних отделов желудочно-кишечного тракта // Науч.-практич. ревматол. 2003. № 5. С. 72-76.
- Каратеев А.Е., Каратеев Д.Е., Лучихина Е.Л., Насонов Е.Л., Багирова Г.Г., Барсукова Н.А., Воеводина Т.С., Волкорезов И.А., Коновалова Н.В., Негметзянова Е.С., Пешехонова Л.К., Ребров А.П., Фадиенко Г.Р., Якушин С.С. Эффективность и безопасность монотерапии высокими дозами НПВП при раннем артрите (открытое рандомизированное контролируемое 4-недельное исследование эффективности высоких и среднетерапевтических доз нимесулида и диклофенака при раннем артрите: предварительные данные) // РМЖ. Т. 14. 2006. № 25. С. 1805-1809.
- Каратеев А.Е., Каратеев Д.Е., Насонов Е.Л. Гастродуоденальная переносимость нимесулида (НИМЕСИЛ, Berlin Chemie) у больных с язвенным анамнезом: первое проспективное исследование безопасности селективных ЦОГ-2 ингибиторов у больных с высоким риском развития НПВП-индуцированных гастропатий // Науч.-практич. ревматол. 2003. № 1. С. 45-48.
- White W.B., West C.R., Borer J.S., Gorelick P.B., Lavange L., Pan S.X., Weiner E., Verburg K.M. Risk of cardiovascular events in patients receiving celecoxib: a meta-analysis of randomized clinical trials // Am. J. Cardiol. Vol. 99. 2007. № 1. P. 91-98.
- White W.B., Kent J., Taylor A., Verburg K.M., Lefkowith J.B., Whelton A. Effects of celecoxib on ambulatory blood pressure in hypertensive patients on ACE inhibitors // Hypertension. Vol. 39. 2002. № 4. P. 929-934.
- Sowers J.R., White W.B., Pitt B., Whelton A., Simon L.S., Winer N., Kivitz A., van Ingen H., Brabant T., Fort J.G. The effects of cyclooxygenase-2 inhibitors and nonsteroidal anti-inflammatory therapy on 24-hour blood pressure in patients with hypertension, osteoarthritis, and type 2 diabetes mellitus // Arch. Intern. Med. Vol. 165. 2005. № 2. P. 161-168.
- Curtis S.P., Ko A.T., Bolognese J.A., Cavanaugh P.F., Reicin A.S. Pooled analysis of thrombotic cardiovascular events in clinical trials of the COX-2 selective Inhibitor etoricoxib // Сurr. Med. Res. Opin. Vol. 22. 2006. № 12. P. 2365-2374.
- Combe B., Swergold G., McLay J., McCarthy T., Zerbini C., Emery P., Connors L., Kaur A., Curtis S., Laine L., Cannon C.P. Cardiovascular safety and gastrointestinal tolerability of etoricoxib vs diclofenac in a randomized controlled clinical trial (The MEDAL study) // Rheumatology (Oxf.). Vol. 48. 2009. № 4. P. 425-432.
- Chen Y.F., Jobanputra P., Barton P., Bryan S., Fry-Smith A., Harris G., Taylor R.S. Cyclooxygenase-2 selective non-steroidal anti-inflammatory drugs (etodolac, meloxicam, celecoxib, rofecoxib, etoricoxib, valdecoxib and lumiracoxib) for osteoarthritis and rheumatoid arthritis: a systematic review and economic evaluation // Health Technol. Assess. Vol. 12. 2008. № 11. P. 1-278.
- Laporte J.R., Ibanez L., Vidal X., Vendrell L., Leone R. Upper gastrointestinal bleeding associated with the use of NSAIDs: newer versus older agents // Drug Saf. Vol. 27. 2004. № 6. P. 411-420. 40. Masso Gonzalez E.L., Patrignani P., Tacconelli S., Garcia Rodriguez L.A. Variability among nonsteroidal antiinflammatory drugs in risk of upper gastrointestinal bleeding // Arthritis Rheum. Vol. 62. 2010. № 6. P. 1592-1601.
- MacDonald T.M., Morant S.V., Goldstein J.L., Burke T.A., Pettitt D. Channelling bias and the incidence of gastrointestinal haemorrhage in users of meloxicam, coxibs, and older, non-specific non-steroidal anti-inflammatory drugs // Gut. Vol. 52. 2003. № 9. P. 1265-1270. 42. Turajane T., Wongbunnak R., Patcharatrakul T., Ratansumawong K., Poigampetch Y., Songpatanasilp T. Gastrointestinal and cardiovascular risk of non-selective NSAIDs and COX-2 inhibitors in elderly patients with knee osteoarthritis // J. Med. Assoc. Thai. Vol. 92. 2009. Suppl. 6. P. 19-26.
- Fosbol E.L., Folke F., Jacobsen S., Rasmussen J.N., Sorensen R., Schramm T.K., Andersen S.S., Rasmussen S., Poulsen H.E., Kober L., Torp-Pedersen C., Gislason G.H. Cause-specific cardiovascular risk associated with nonsteroidal antiinflammatory drugs among healthy individuals // Circ. Cardiovasc. Qual. Outcomes. Vol. 3. 2010. № 4. P. 395-405.
- Singh G., Mithal A., Triadafilopoulos G. Both selective COX-2 inhibitors and non-selective NSAIDS increase the risk of acute myocardial infarction in patients with arthritis: selectivity is with the patient, not the drug class [abstract] // Ann. Rheum. Dis. Vol. 64. 2005. Suppl. 3. № 85.
- Helin-Salmivaara A., Virtanen A., Vesalainen R., Gronroos J.M., Klaukka T., Idanpaan-Heikkila J.E., Huupponen R. NSAID use and the risk of hospitalization for first myocardial infarction in the general population: a nationwide case-control study from Finland // Eur. Heart J. Vol. 27. 2006. № 14. P. 1657-1663.
- McGettigan P., Henry D. Cardiovascular risk and inhibition of cyclooxygenase: a systematic review of the observational studies of selective and nonselective inhibitors of cyclooxygenase 2 // JAMA. Vol. 296.2006. № 13. P. 1633-1644.
- Layton D., Hughes K., Harris S., Shakir S.A.W. Comparison of the incidence rates of thromboembolic events reported for patients prescribed celecoxib and meloxicam in general practice in England using Prescription-Event Monitoring (PEM) data // Rheumatology (Oxf.). Vol. 42. 2003. № 11. P. 1354-1364.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Цель исследования: оценка клинической эффективности и безопасности применения двух нестероидных противовоспалительных препаратов, обладающих умеренной селективностью в отношении циклооксигеназы 2: ацеклофенака и мелоксикама – в лечении пациентов с острой вертеброгенной дорсалгией.
Материал и методы. 158 пациентов с вертеброгенными дорсалгиями (неспецифической болью в нижней части спины) (код M.54 по Международной классификации болезней 10-го пересмотра) рандомизированы на две группы: первая получала ацеклофенак (Аэртал®) 200 мг/сут, вторая – мелоксикам 15 мг/сут. Продолжительность приема определялась индивидуально в зависимости от клинического течения заболевания. Эффективность терапии анализировалась с помощью Цифровой рейтинговой шкалы (Numerical Rating Scale – NRS), опросника Роланда – Морриса (Roland-Morris Disability Questionnaire – RM24), также учитывалась частота хронизации болевого синдрома. Оценка безопасности проводилась путем учета нежелательных явлений.
Результаты. Оба препарата достоверно (р < 0,05) уменьшали выраженность болевого синдрома (по шкале NRS) и увеличивали повседневную активность пациентов (в соответствии с опросником RM24) уже к десятым суткам лечения, при этом достоверных различий в этом отношении между группами не выявлено. Ацелофенак оказывал более быстрый противоболевой эффект (р = 0,043) по сравнению с мелоксикамом и реже приводил к хронизации боли (р = 0,044). Оба препарата обладали сравнимым благоприятным профилем переносимости, за исключением более высокого относительного риска нежелательных явлений со стороны сердечно-сосудистой системы на фоне приема мелоксикама (отношение рисков 3,02, 95%-ный доверительный интервал 1,12–8,16, p = 0,029), главным образом вследствие повышения артериального давления (p = 0,039).
Выводы. Кратковременное (до 30 суток) применение ацеклофенака (препарат Аэртал®) и мелоксикама эффективно и относительно безопасно в лечении пациентов с вертеброгенными дорсалгиями. Между препаратами существуют достоверные различия в отдельных параметрах (более быстрая скорость развития аналгезии у ацеклофенака и более высокая частота хронизации болевого синдрома у мелоксикама) и переносимости (более высокий относительный риск нежелательных явлений со стороны сердечно-сосудистой системы при использовании мелоксикама), что требует уточнения в дальнейших исследованиях.
Рис. 1. Дизайн исследования КАМЕЛИЯ
Таблица 1. Характеристика больных, участвовавших в исследовании КАМЕЛИЯ
Таблица 2. Оценка эффективности проводимой терапии
Рис. 2. Частота хронизации болевого синдрома в группах через три месяца от начала терапии
Таблица 3. Частота и стратификация нежелательных явлений, возникших в процессе лечения, абс. (%)
Рис. 3. Относительный риск развития нежелательных явлений
Таблица 4. Относительный риск развития побочных эффектов с 95%-ным доверительным интервалом (группа ацеклофенака считалась референтной), абс. (%)
Вертеброгенные дорсалгии пояснично-крестцовой локализации – одна из наиболее часто встречающихся медицинских проблем во всем мире. Они имеют колоссальную социальную, психологическую и экономическую значимость [1], поскольку наблюдаются практически во всех возрастных группах и служат наиболее частой причиной нетрудоспособности в различных популяциях [2]. Установлено, что боль в нижней части спины может возникнуть у 15–20% взрослых людей на протяжении года, а вероятность развития хотя бы одного острого эпизода вертеброгенной дорсалгии в течение всей жизни составляет 50–80% [3].
В подавляющем большинстве случаев (81–95%) клинические проявления заболевания тотально регрессируют в достаточно короткие сроки (несколько недель), и лишь у небольшой части пациентов (5–19%) болевой синдром сохраняется дольше 12 недель [4]. Однако ввиду огромного абсолютного числа пациентов с болью в нижней части спины общее количество больных с хроническим течением вертеброгенной дорсалгии достаточно внушительно.
Стратегии лечения пациентов с вертеброгенной дорсалгией значительно варьируются. Например, США намного опережают другие государства по доле оперативных вмешательств и назначению наркотических аналгетиков [5, 6]. В большинстве стран стратегия ведения пациентов с вертеброгенной дорсалгией заключается в следующем:
- дифференциация пациентов в зависимости от типа боли: неспецифическая (костно-мышечная или миофасциальная) боль, радикулопатия и алгический синдром, вероятно вызванный серьезной патологией;
- скрининг пациентов с вероятной серьезной патологией, основанный на поиске так называемых красных флажков;
- обязательный неврологический осмотр с оценкой двигательной и чувствительной сфер, а также использованием специфических тестов (Ласега, Спурлинга);
- исключение психогенного генеза клинических симптомов (так называемые желтые флажки) при отсутствии какого-либо эффекта от инициального лечения;
- применение современных методов нейровизуализации (компьютерной и магнитно-резонансной томографии) только в случаях, когда ожидается, что полученный результат может повлиять на тактику лечения и соответственно исход терапии.
К лекарственным средствам, наиболее часто назначаемым при вертеброгенной дорсалгии, относятся нестероидные противовоспалительные препараты (НПВП). Согласно последнему Кохрейновскому метаанализу результатов исследований, посвященных оценке эффективности НПВП при боли в области нижней части спины, прием НПВП оказался более эффективен, чем плацебо, в отношении уменьшения выраженности болевого синдрома и снижения периода временной нетрудоспособности [7]. При этом не получено достоверного различия в терапевтической эффективности различных типов НПВП. По вопросу безопасности их применения (в том числе долгосрочного) к каким-либо четким выводам авторам работы прийти не удалось. Тем не менее в последнее время накопилось достаточно убедительных данных, которые позволяют сделать несколько выводов.
Во-первых, прием НПВП ассоциирован с широким спектром побочных эффектов [8].
Во-вторых, предпочтительный выбор того или иного препарата из группы НПВП не должен основываться на коэффициенте его селективности к циклооксигеназе (ЦОГ) 2, который рассчитывается in vitro как соотношение ЦОГ-1/ЦОГ-2 значений 50%-ной ингибирующей концентрации (IC50). Полученный таким образом показатель абсолютно не отражает реальную степень ингибирования данных ферментов in vivo при приеме того или иного НПВП. В этой связи целесообразно использовать более наглядный параметр – степень абсолютного избирательного воздействия препарата отдельно на ЦОГ-1 и ЦОГ-2, которая устанавливается in vivo на добровольцах, что позволяет рассчитать достигаемую селективность к ЦОГ-1/ЦОГ-2 для любого НПВП. Важно отметить, что достигаемая селективность напрямую зависит от дозы, поэтому у одного и того же препарата может кардинально отличаться выраженность побочных эффектов [9]. При этом чем выше степень реального ингибирования ЦОГ-1 (а не значение рассчитанного in vitro коэффициента ЦОГ-1/ЦОГ-2 IC50, свидетельствующего о преимущественном действии препарата на ЦОГ-1), тем выше риск гастроинтестинальных осложнений, и соответственно чем выше степень ингибирования ЦОГ-2, тем выше риск сердечно-сосудистых осложнений. Однако при достижении абсолютного ингибирования ЦОГ-1 выше 95% у препарата появляется протективный эффект в отношении кардио- и цереброваскулярных осложнений, что было продемонстрировано при использовании высоких доз напроксена [10]. Диклофенак (75 мг два раза в день), который относится к «старым» традиционным неселективным НПВП и соответственно ассоциируется с высоким риском гастроинтестинальных осложнений, обладает гораздо меньшей степенью селективности к ЦОГ-2 по сравнению, например, с целекоксибом (200 мг два раза в день) или эторикоксибом (90 мг один раз в день) (при расчете in vitro ЦОГ-1/ЦОГ-2 IC50). А в абсолютном значении (достигаемая селективность) диклофенак ингибирует ЦОГ-2 на 93,9% (больше, чем целекоксиб и эторикоксиб), что обусловливает высокий риск сердечно-сосудистых нежелательных явлений при его применении [9, 11].
Таким образом, представляется актуальным выявить преимущества и недостатки близких по свойствам НПВП в клинической практике.
Цель исследования
Сравнительная оценка клинической эффективности и безопасности ацеклофенака (Аэртал®) и мелоксикама в комплексном лечении пациентов с острой вертеброгенной дорсалгией.
Материал и методы
В открытом наблюдательном проспективном когортном исследовании приняло участие 186 пациентов с ведущей жалобой на боль в нижней части спины, соответствующих следующим критериям включения:
- верифицированный диагноз вертеброгенной дорсалгии пояснично-крестцовой локализации (M.54 по Международной классификации болезней 10-го пересмотра);
- возраст старше 18 лет;
- болевой синдром продолжительностью не более семи дней.
Критерии исключения:
- противопоказания к приему ацеклофенака и мелоксикама:
- эрозивно-язвенные поражения желудочно-кишечного тракта в фазе обострения;
- желудочно-кишечное кровотечение в анамнезе или подозрение на него;
- указания в анамнезе на бронхоспазм, крапивницу, ринит после приема ацетилсалициловой кислоты или других НПВП (полный или неполный синдром непереносимости ацетилсалициловой кислоты – риносинусит, крапивница, полипы слизистой оболочки носа, бронхиальная астма);
- ранний период (до трех месяцев) после аортокоронарного шунтирования;
- выраженная печеночная недостаточность или активное заболевание печени;
- нарушения кроветворения и коагуляции;
- выраженная почечная недостаточность, прогрессирующие заболевания почек;
- подтвержденная гиперкалиемия;
- беременность;
- период лактации (грудное вскармливание);
- недавно перенесенные цереброваскулярные кровотечения;
- болезнь Крона или язвенный колит в стадии обострения;
- выраженная неконтролируемая сердечная недостаточность;
- ишемическая болезнь сердца;
- дефицит сахаразы/изомальтазы, непереносимость фруктозы, глюкозо-галактозная мальабсорбция;
- фенилкетонурия;
- радикулопатия;
- невозможность вербального контакта с пациентом, балльной оценки эффективности лечения (вследствие деменции, психических заболеваний и т.д.);
- использование глюкокортикоидов в течение ближайшего месяца до начала исследования;
- применение симптоматических противовоспалительных препаратов замедленного действия для лечения остеоартроза (Symptomatic Slow-Acting Drugs in Osteoarthritis – SYSADOA) в период исследования;
- известная специфическая причина боли невертеброгенной природы (новообразование, герпетический ганглионеврит, вирус иммунодефицита человека, травма и проч.);
- химиотерапия по поводу онкологического заболевания в течение последних пяти лет.
Все пациенты стратифицированы на две равноценные группы: первой группе был назначен ацеклофенак (Аэртал®) в виде порошка по 200 мг, второй – мелоксикам в виде таблеток по 15 мг. Продолжительность приема НПВП определялась индивидуально в зависимости от клинического течения заболевания, однако оценка эффективности и переносимости препаратов ограничивалась 30 сутками. Дизайн исследования подразумевал четыре визита: первый – скрининг, и далее еще три визита каждые десять дней в течение первого месяца. В случае сохранения болевого синдрома пациент предпринимал еще два визита через два и три месяца от начала лечения. Таким образом, общая длительность периода наблюдения составила 90 дней.
Эффективность терапии оценивалась с учетом анализа результатов нескольких опросников и шкал.
- Цифровая рейтинговая шкала (Numerical Rating Scale – NRS), предназначенная для субъективной оценки выраженности боли, получила широкое распространение в связи с легкостью применения, воспроизводимостью и отличной корреляцией с другими инструментами, используемыми с этой же целью [16]. На первом визите выраженность болевого синдрома с помощью NRS оценивалась дважды. Сначала регистрировался исходный уровень интенсивности боли, затем через два часа после принятия первой дозы НПВП пациент по телефону сообщал об инициальном обезболивающем эффекте. Дальнейшее анкетирование выполнялось на визитах согласно протоколу исследования. Изменение результатов шкалы NRS более чем на 20%, фиксируемое на двух временных точках, считалось клинически значимым [17].
- Опросник Роланда – Морриса (Roland-Morris Disability Questionnaire – RM24) – один из инструментов, позволяющих оценить влияние болевого синдрома на повседневную активность пациента.
- Частота хронизации болевого синдрома, выраженная в абсолютных значениях (количество пациентов) и процентах.
- Число больных, которых необходимо лечить (Number-Needed-to-Treat – NNT) – количество пациентов, которым необходимо дать препарат для того, чтобы у одного из них интенсивность болевого синдрома снизилась на 50% через четыре – шесть часов от момента приема лекарства. Данный параметр – один из важнейших для клинической практики, поскольку отражает эффективность противоболевой терапии.
- Продолжительность терапии НПВП (дни) – общая длительность использования препарата. Препарат отменялся на основании субъективной (позиция пациента) и объективной (врачебный осмотр) оценки результатов лечения в случае тотального нивелирования болевого синдрома или увеличения двигательной активности больного и значительного снижения выраженности боли.
Безопасность лечения оценивалась путем анализа частоты нежелательных явлений, возникших в ходе лечения (НЯВЛ), серьезных нежелательных явлений, нежелательных явлений, которые стали причиной отказа от лечения. На всех визитах пациенты проходили физикальный и неврологический осмотр. Кроме того, у 95 больных (48 пациентов в группе ацеклофенака и 47 в группе мелоксикама) можно было оценить результаты электрокардиографии, а также анализов крови (общеклинический анализ, биохимический анализ – уровень аланинаминотрансферазы, глюкозы, мочевины, креатинина, калия, натрия, общего билирубина, креатинфосфокиназы, общего холестерина) и мочи до и после лечения. Все пациенты самостоятельно измеряли артериальное давление дважды в день.
Для статистической обработки данные были внесены в базу, сформированную на основе программного обеспечения Microsoft Excel. Статистический анализ осуществлялся с помощью общепринятых методов из пакета программ SAS 9.4.
Для сравнительного анализа качественных параметров использовали критерии χ2 или Фишера (при малом числе наблюдений). Значимость различий между количественными величинами оценивали по t-критерию Стьюдента (для нормально распределенных величин) или по непараметрическому критерию Манна – Уитни. Расчет относительного риска проводился согласно рекомендациям D.G. Altman (1991) [18]. Различия признавали значимыми при p < 0,05.
Результаты
Из 186 пациентов с болью в области нижней части спины после скринингового визита и определения соответствия критериям включения/исключения 173 больных рандомизированы на две группы. В первой группе (n = 94, 54,3%) лечение осуществлялось ацеклофенаком, во второй (n = 79, 45,7%) – мелоксикамом (рис. 1). Вследствие ряда причин 15 (8,7%) пациентов исключены из исследования. Таким образом, статистический анализ и интерпретация полученных результатов выполнялись исходя из общего числа больных 158 человек.
Средний возраст пациентов составил 56,7 ± 6,5 года, большая часть респондентов оказалась женского пола (n = 93, 58,9%). Другие характеристики групп (наличие коморбидных заболеваний, сведения о приеме сопутствующих лекарственных препаратов и др.) приведены в табл. 1.
Эффективность терапии
Анализ результатов лечения по шкале NRS показал, что уже на десятые сутки выраженность болевого синдрома достоверно (р < 0,05) снизилась по сравнению с исходным уровнем в обеих группах и в дальнейшем продолжала снижаться (табл. 2). Статистически достоверного различия в отношении интенсивности болевого синдрома между группами начиная с десятых суток терапии и далее зарегистрировано не было. В группе ацеклофенака инициальный эффект (в первые два часа) от приема препарата оказался достоверно (р = 0,043) более выраженным по сравнению с группой мелоксикама.
NNT, рассчитанное для интервала четыре – шесть часов от момента приема первой дозы препарата, в первой группе было недостоверно (р = 0,171) ниже (1,8), чем во второй группе (2,0).
Оценка продолжительности терапии показала, что большинство пациентов завершили прием препаратов к 20-м суткам лечения: в группе ацеклофенака – 72 (81,8%) больных, в группе мелоксикама – 50 (71,4%) больных. Тем не менее пять (5,7%) пациентов первой группы и 11 (15,7%) пациентов второй группы продолжали прием препаратов даже после 30 суток наблюдения ввиду сохраняющегося болевого синдрома (р = 0,048).
Анализ результатов тестирования пациентов по опроснику RM24 не установил достоверного различия между группами по увеличению повседневной активности: у больных обеих групп достоверно (р < 0,05) отмечалось значительное улучшение физического состояния начиная с десятых суток лечения по сравнению с исходным значением, и в дальнейшем эта тенденция сохранялась.
Хронизация болевого синдрома достоверно чаще наблюдалась у больных, принимавших мелоксикам (n = 10), по сравнению с пациентами, получавшими ацеклофенак (n = 4) (р = 0,044) (рис. 2).
В обеих группах зафиксированы случаи неэффективности лечения: один (1,1%) в группе ацеклофенака и два (2,8%) в группе мелоксикама (снижение по шкале NRS < 20%). Эти больные получали НПВП в течение 10–20 суток и отказались от дальнейшего приема препаратов, что послужило поводом к исключению их из исследования. В дальнейшем эти пациенты были направлены на углубленное обследование и подбор индивидуальной терапии.
Безопасность лечения
За период наблюдения НЯВЛ отмечены у 35 (22,1%) пациентов, причем в первой группе у трех (3,3%) больных возникшие нежелательные явления стали причиной отказа от дальнейшего лечения, во второй группе таких больных оказалось пять (6,7%) (р = 0,299). Ни одного серьезного нежелательного явления не отмечено. Наиболее часто встречались нежелательные явления со стороны желудочно-кишечного тракта и сердечно-сосудистой системы – по 17 (10,8%) случаев (табл. 3).
Относительный риск развития НЯВЛ (любого вида) в первой группе (здесь и далее эта группа считалась референтной) составил 1,57 (95%-ный доверительный интервал (ДИ) 0,88–2,80) (различия недостоверны, р = 0,175) (табл. 4, рис. 3).
НЯВЛ со стороны желудочно-кишечного тракта. В первой группе боль в животе, диспепсия, диарея наблюдались у десяти (11,4%) пациентов, в то время как во второй группе – у семи (10%). Относительный риск развития НЯВЛ со стороны желудочно-кишечного тракта во второй группе составил 0,80 (95% ДИ 0,32–1,99) (различия не достоверны, р = 0,633) (см. табл. 4).
НЯВЛ со стороны сердечно-сосудистой системы. За все время наблюдения выявлено два варианта НЯВЛ этой категории – повышение артериального давления и появление периферических отеков. При этом повышение артериального давления достоверно чаще отмечалось во второй группе – у семи (10%) больных (в первой группе – у одного (1,1%) больного) (р = 0,039). Относительный риск развития НЯВЛ со стороны сердечно-сосудистой системы во второй группе составил 3,02 (95% ДИ 1,12–8,16) (различия достоверны, р = 0,029) (см. табл. 4).
НЯВЛ со стороны кожи и кожных придатков. Зарегистрирован всего один (1,1%) случай аллергического дерматита за весь период лечения в первой группе (р = 0,591). Относительный риск развития НЯВЛ со стороны кожи и кожных придатков во второй группе составил 0,42 (95% ДИ 0,02–10,10) (различия недостоверны, р = 0,591) (см. табл. 4).
Анализ результатов электрокардиографии, а также ряда параметров крови (общеклинический анализ, биохимический анализ – уровень аланинаминотрансферазы, глюкозы, мочевины, креатинина, калия, натрия, общего билирубина, креатинфосфокиназы, общего холестерина) никаких значимых отклонений в обеих группах не выявил. К моменту окончания терапии у четырех (8,3%) пациентов первой группы и пяти (10,6%) пациентов второй группы зафиксировано незначительное повышение уровня аланинаминотрансферазы в крови (на 10,5 ± 3,4 и 8,9 ± 4,7 Ед/л соответственно) (различия между группами не достоверны, р = 0,135).
Обсуждение результатов
В настоящем открытом наблюдательном исследовании изучены клиническая эффективность и безопасность применения двух препаратов: ацеклофенака и мелоксикама – в лечении пациентов с острой болью в нижней части спины (M.54).
Выбор лекарственных средств не был случайным – они занимают лидирующее место на фармацевтическом рынке Российской Федерации и позиционируются как препараты, обладающие умеренной селективностью в отношении ЦОГ-2 (золотая середина).
Ацеклофенак (Аэртал®) представляет собой производное фенилацетиловой кислоты, то есть близок по строению к диклофенаку. Однако гидроксильная группа в молекуле диклофенака была заменена на карбоксильную у ацеклофенака, что существенно изменило фармакологические свойства препарата. По данным S. Saraf, коэффициент селективности для ацеклофенака составляет 26 [19]. Клинические и эпидемиологические исследования показали, что препарат характеризуется хорошей переносимостью со стороны желудочно-кишечного тракта и сердечно-сосудистой системы [20]. Достоинство ацеклофенака – высокая биодоступность, близкая к 100%. Пиковая концентрация в плазме крови достигается через 75–180 минут после приема внутрь, при этом прием пищи замедляет всасывание препарата, но не влияет на его степень. Важная особенность ацеклофенака для клинической практики – способность проникать в синовиальную жидкость, где его концентрация достигает 60% от содержания в плазме крови.
Помимо основного фармакологического эффекта (блокада ЦОГ) ацеклофенак влияет на синтез важнейших цитокинов, таких как интерлейкин 1 и фактор некроза опухоли. Кроме того, ацеклофенак способен подавлять процесс ассоциированной с интерлейкином 1 активации металлопротеиназ, что наряду с другими факторами обусловливает его положительное воздействие на синтез протеогликанов суставного хряща [21]. В ряде исследований установлено, что ацеклофенак не только не разрушал хрящ (что свойственно для ибупрофена, индометацина, диклофенака), но и способствовал его активному восстановлению, подавляя катаболизм хрящевой ткани [22, 23]. Рекомендуемая доза препарата – 100 мг два раза в сутки (утром и вечером).
Мелоксикам представляет собой производное эноловой кислоты с большим периодом полувыведения: максимальная концентрация (Cmax) в плазме после приема 15 мг достигается через пять-шесть часов, период полувыведения составляет 20–24 часа, поэтому препарат назначают однократно по 7,5 или 15 мг/сут [24]. Около 77% всех продаваемых упаковок приходится на максимальную дозировку – 15 мг [25].
Структурно отличаясь от других ингибиторов ЦОГ-2, например коксибов, мелоксикам вступает в контакт с верхней, а не с боковой частью канала ЦОГ-2. Он практически полностью связывается с белками плазмы (99,5%), а его концентрация в синовиальной жидкости составляет 45–57% от концентрации в плазме [26]. Коэффициент селективности для мелоксикама равен 18 [27], средний процент in vivo ингибирования ЦОГ-2 – 77,5%, а ЦОГ-1 – 53% [28].
Эффективность мелоксикама при лечении больных остеоартрозом сопоставима с таковой ряда традиционных НПВП (диклофенака, пироксикама) [29]. Мелоксикам, вероятно, обладает более благоприятным профилем воздействия на желудочно-кишечный тракт по сравнению с диклофенаком и пироксикамом. Однако однозначно утверждать это некорректно, поскольку такое представление о влиянии мелоксикама на желудочно-кишечный тракт появилось после завершения двух крупных кратковременных (28 дней) исследований – MELISSA и SELECT, где препарат использовался в редкой для него низкой дозе 7,5 мг/сут.
Наше прямое сравнительное исследование – первое в своем роде, где была предпринята попытка оценить эффективность и безопасность кратковременного применения ацеклофенака и мелоксикама в лечении пациентов с вертеброгенной дорсалгией. Помимо кратности приема препараты отличались формой выпуска: ацеклофенак применялся в виде порошка для приготовления суспензии для приема внутрь, а мелоксикам – в виде таблеток.
Исследуемая когорта больных характеризовалась гетерогенностью по возрасту, коморбидным заболеваниям и приему сопутствующих препаратов. Тем не менее удалось рандомизировать пациентов на две группы без достоверных различий в отношении факторов, которые могли бы прямо или косвенно повлиять на исход исследования.
Анализ эффективности
Оба препарата продемонстрировали достаточную эффективность, выражавшуюся в снижении интенсивности болевого синдрома и улучшении повседневной активности у большинства пациентов. Анализ изменений данных по шкале NRS показал, что достоверное снижение интенсивности боли уже к десятым суткам лечения отмечалось в обеих группах, эта тенденция сохранилась и в дальнейшем.
Ацеклофенак в виде порошка для приготовления суспензии для приема внутрь ожидаемо гораздо раньше оказывал противоболевой эффект по сравнению с мелоксикамом в виде таблеток (NRS через два часа, р = 0,043). Это важный аспект в лечении пациентов с болевым синдромом, поскольку наличие боли требует ее незамедлительного купирования, а быстрый эффект значительно повышает комплаентность [30]. Сходная ситуация наблюдалась также при оценке результатов опросника RM24 – достоверное улучшение через десять суток терапии по сравнению с исходными баллами и сохраняющейся положительной динамикой в дальнейшем. Большинство пациентов (44,3% в группе ацеклофенака и 40% в группе мелоксикама) принимали НПВП только в течение десяти дней – этого оказалось достаточно для излечения.
Тем не менее, несмотря на терапию, у части больных достичь клинического эффекта не удалось: наблюдалось четыре (6,8%) случая хронизации болевого синдрома в первой группе и десять (14,3%) – во второй (разница достоверна, р = 0,044). Следует отметить, что 12 (85,7%) пациентов (трое больных в первой группе и девять во второй), у которых был диагностирован хронический болевой синдром, изначально страдали депрессией/тревожным расстройством и принимали препараты из группы селективных ингибиторов обратного захвата серотонина (СИОЗС). Вероятно, именно этот факт стал определяющим в появлении достоверного различия между группами.
В настоящее время анализ особенностей взаимодействия НПВП и СИОЗС – одно из приоритетных направлений в исследованиях в области психиатрии по нескольким причинам. Во-первых, воспалительный процесс в организме рассматривается рядом авторов как этиологический фактор [31] или фактор риска [32] развития депрессии. Во-вторых, назначение НПВП пациентам, которые уже принимают СИОЗС, может существенно изменить течение имеющихся аффективных расстройств [33]. Согласно данным литературы, результаты сочетанного приема НПВП и СИОЗС весьма противоречивы. В некоторых работах показано, что ацетилсалициловая кислота и целекоксиб обладают прямым антидепрессивным эффектом [34, 35]. Другие исследования свидетельствуют о том, что НПВП и парацетамол снижают эффективность СИОЗС, в частности циталопрама [36]. И, наконец, высказываются мнения о том, что прием НПВП не влияет на эффективность СИОЗС у пациентов с аффективными нарушениями [37]. При этом общепризнанно, что СИОЗС потенцируют риск возникновения ассоциированных с приемом НПВП серьезных нежелательных явлений со стороны желудочно-кишечного тракта и сердечно-сосудистой системы [38, 39]. В то же время к одним из важнейших модифицируемых факторов риска хронизации боли в спине относятся именно психологические факторы: стресс, тревожное расстройство, депрессия и т.д. [40].
Таким образом, полученная в нашем исследовании достоверно более высокая частота хронизации вертеброгенной дорсалгии на фоне приема мелоксикама, возможно, объясняется его способностью снижать эффективность СИОЗС. Наиболее вероятно имеет место периферическое взаимодействие НПВП и СИОЗС (в том числе блокада транспортных белков), поскольку мелоксикам не так легко проникает через гематоэнцефалический барьер [41], чтобы создавать достаточную концентрацию в мозговой ткани для возникновения подобного клинического эффекта.
Анализ безопасности
Как ацеклофенак, так и мелоксикам продемонстрировали хорошую переносимость: серьезные нежелательные явления отсутствовали, а общее количество нежелательных явлений в первой группе составило 16 (18,1%) случаев, а во второй группе – 19 (27,1%) (р = 0,175). За весь период исследования наблюдались три типа нежелательных явлений – со стороны желудочно-кишечного тракта (диспепсия, боль в животе, диарея), сердечно-сосудистой системы (повышение артериального давления, отечность) и кожи и кожных придатков (кожная сыпь). Достоверных различий по относительному риску возникновения нежелательных явлений со стороны желудочно-кишечного тракта, а также кожи и кожных придатков в группах не зарегистрировано (ОР 0,80, 95% ДИ 0,32–1,99, р = 0,633 и ОР 0,42, 95% ДИ 0,02–10,10, р = 0,591 соответственно). По причине выраженности нежелательных явлений со стороны желудочно-кишечного тракта три (3,3%) пациента в первой группе и пять (6,7%) больных во второй группе приняли решение отказаться от дальнейшего приема НПВП (р = 0,299).
При анализе структуры нежелательных явлений со стороны сердечно-сосудистой системы определен их достоверно более высокий относительный риск возникновения (ОР 3,02, 95% ДИ 1,12–8,16, p = 0,029) в первой группе, причем он реализован преимущественно за счет повышения артериального давления (р = 0,039). В настоящее время очевидно, что все НПВП способны в той или иной степени повышать артериальное давление [42]. Согласно метаанализу C. Chan и соавт., в большей степени это характерно для коксибов (ОР по сравнению с плацебо 1,49, p = 0,04, по сравнению с неселективными НПВП – 1,12, p = 0,23) [43]. При этом влияние коксибов на артериальное давление неодинаково – наиболее оно выражено у рофекоксиба и эторикоксиба. Таким образом, именно влияние на ЦОГ-2 главным образом «ответственно» за данный тип нежелательных явлений. Основными патогенетическими механизмами при этом служат:
- задержка в организме ионов натрия и соответственно воды;
- уменьшение образования в сосудистой стенке естественного вазодилататора простациклина;
- ослабление эффекта ряда антигипертензивных препаратов [44].
Последний механизм, вероятно, один из самых важных, поскольку, например, в метаанализе A.G. Johnson и соавт. достоверное повышение артериального давления на фоне приема НПВП наблюдалось именно у пациентов с артериальной гипертензией, у которых ранее медикаментозно была достигнута нормотензия [44]. При этом степень ослабления эффекта различных антигипертензивных препаратов при одновременном приеме НПВП сильно варьируется. Она наиболее значима при использовании бета-блокаторов и лекарственных средств, блокирующих ренин-ангиотензин-альдостероновую систему [45]. Это обусловлено тем, что в нормальных условиях при приеме НПВП происходит снижение синтеза ренина в качестве компенсации за задержку в организме ионов натрия и воды, а также вследствие прямого ингибирования ЦОГ-2. В том случае, когда ренин-ангиотензин-альдостероновая система хронически «подавлена» использованием соответствующих антигипертензивных препаратов, указанный выше компенсаторный механизм неэффективен, что приводит к увеличению артериального давления [46].
Кроме того, важный фактор, определяющий частоту и выраженность нежелательных явлений со стороны сердечно-сосудистой системы, – период полувыведения НПВП. Полагают, что при коротком периоде полувыведения у ряда НПВП, обладающих значительным потенциалом ингибирования ЦОГ-2, активность последней в период между приемом препаратов частично восстанавливается, что может способствовать меньшей частоте и выраженности нежелательных явлений со стороны сердечно-сосудистой и реноваскулярной систем [47]. Таким образом, более высокий относительный риск повышения артериального давления и соответственно нежелательных явлений со стороны сердечно-сосудистой системы может объясняться более длительным по сравнению с ацеклофенаком периодом полувыведения мелоксикама и использованием данного препарата в максимальной дозе – 15 мг/сут, что индуцирует более стойкое блокирование ЦОГ-2. В этой связи в исследовании ожидалось более выраженное противоболевое действие мелоксикама по сравнению с ацеклофенаком, но этого не произошло, на наш взгляд, из-за лучшей способности ацеклофенака проникать в синовиальную жидкость. Поскольку при вертеброгенной дорсалгии один из важнейших источников боли – фасеточные суставы [48], то по противоболевой эффективности ацеклофенак не уступал мелоксикаму.
При анализе результатов электрокардиографии, а также большинства параметров крови никаких значимых отклонений в обеих группах не получено. У части больных наблюдалась гиперферментемия (повышение аланинаминотрансферазы), выраженность которой достоверно не отличалась между группами (р = 0,135) и не привела к отмене НПВП.
Заключение
Кратковременное (до 30 суток) применение ацеклофенака (препарат Аэртал®) 200 мг/сут и мелоксикама 15 мг/сут эффективно и относительно безопасно при вертеброгенной дорсалгии. Оба препарата достоверно уменьшают выраженность болевого синдрома (по шкале NRS) и увеличивают повседневную активность пациентов (в соответствии с опросником RM24) уже к десятым суткам лечения, при этом достоверных различий между группами не обнаружено.
Аэртал® в виде порошка для приготовления суспензии для приема внутрь оказывает более быстрый противоболевой эффект по сравнению с мелоксикамом в виде таблеток и реже приводит к хронизации боли. Последний факт, наиболее вероятно, объясняется ингибирующим воздействием мелоксикама на эффективность действия СИОЗС.
Оба препарата обладают сравнимым благоприятным профилем переносимости, за исключением более высокого относительного риска развития нежелательных явлений со стороны сердечно-сосудистой системы (повышение артериального давления) на фоне приема мелоксикама, что связано, по всей вероятности, с более длительным по сравнению с ацеклофенаком периодом полувыведения препарата.
