Ранее для лечения преждевременной недостаточности яичников применялась гормональная терапия. Но даже при индивидуальном подборе медикаментов оставался нерешенным вопрос осложнений, сопряженный с приемом гормональных средств. Настоящим прорывом в лечении бесплодия при недостаточности яичников стала разработка японского доктора Казухиро Кавамуры.
Показания для активации яичников
- Истощением яичников по разным причинам
- Множественные неудачные попытки ЭКО в анамнезе
- Синдром «пустых» фолликулов (количество фолликулов при стимуляции для ЭКО значимо выше числа полученных яйцеклеток при пункции)
- Рост малого количества фолликулов на дозах гонадотропинов выше среднетерапевтических и определённые заболевания организма
Самым скорым и удобным способом решения достижения беременности в этих случаях могло бы быть использование яйцеклеток донора. Однако, в некоторых случаях биологический материал донора использовать невозможно. Тогда хирургическая активация яичников даёт единственную в наше время надежду забеременеть.
Как делают активацию яичников?
Определено, что у многих женщин, у которых даже прошли годы отсутствия своих месячных, в ткани яичника сохранились зачатки яйцеклеток. Но, они находятся в «спящем» состоянии. Найдены сложные генетические механизмы, сдерживающие переход этих клеток (преантральных фолликулов) в антральные. Преантральные фолликулы нечувствительны к препаратам гонадотропинов, которые используют для стимуляции функции яичников в программах ЭКО и других вспомогательных репродуктивных технологиях. Однако, антральные фолликулы уже отвечают на воздействие (стимуляцию) гонадотропинами ростом и созреванием в них яйцеклетки.
Профессор, доктор медицины Казухиро Кавамура (Kazuhiro Kawamura) научился активировать «спящие» яйцеклетки в яичнике. Технология активации происходит вне человеческого тела, в лаборатории ЭКО, где и снимают природный генетический блок с клеток. Абсолютно необходимым этапом является лапароскопичесая операция на яичниках пациентки и высокотехнологичное получение ткани яичника специальными инструментами и методами.
Обработанная (активированная) ткань яичника возвращается обратно в тело пациентки, и, затем, там самостоятельно развивается, продуцируя фолликулы. У женщины даже появляются собственные месячные, как правило, на 1-3 цикла. Если в этот период провести стимуляцию функции яичников, то можно получить яйцеклетки, пригодные к оплодотворению.
Эффективность операции
Мировые исследования на сегодняшний день показывают, что примерно у 50% женщин после операции происходит фолликулярная активация в яичниках, этого достаточно для получения яйцеклеток, оплодотворения и подсадки эмбрионов.
У некоторых женщин появляются или восстанавливаются менструации. К сожалению, до операции неизвестно, сколько «спящих» фолликулов в яичниках женщины сохранилось и как они реагируют на активацию. Метод IVA может получить яйцеклетки у женщин, чье естественное производство яйцеклеток прекратилось. Однако этот метод не может улучшить качество яйцеклеток. это означает, что этот метод больше всего подходит женщинам до 41 года, особенно женщинам до 35 лет, когда менопауза длилась менее 4 лет. Даже в возрасте 41 года метод IVA дает большую вероятность получения яйцеклеток, но качество яйцеклеток будет соответствовать возрасту. После 43 лет качество яйцеклеток резко падает.
Хирургическая активация яичников по методу Кавамура

Сильное истощение овариального резерва снижает не только шансы на зачатие естественным путем, но и вероятность успеха во время цикла ЭКО.
В тяжелых случаях развивается стойкое бесплодие, а циклы экстракорпорального оплодотворения один за другим заканчиваются ничем.
Многие женщины, столкнувшиеся с такой проблемой, слышали, что яичники можно попробовать «оживить» с помощью операции.
Эта методика была разработана в 2010 году Казухиро Кавамура и носит его имя, а ее второе название – in vitro activation, сокращенно IVA.
Первый ребенок после применения такого метода появился на свет в 2013 году.
В настоящее время хирургическую активацию яичников по методу Кавамура выполняют не только в Японии, но и в других странах, включая Россию, Китай, Польшу, Испанию, Индию, Мексику.
Поговорим о том, что это за методика, насколько она эффективна и стоит ли ее применять.
Фото с https://ru.freepik.com/
В каких случаях применяется методика?
Клиники, предоставляющие такую медицинскую услугу, обычно перечисляют следующие показания:
- Естественное или преждевременное снижение овариального резерва, вызванное различными причинами. В яичниках женщины остается мало яйцеклеток, и не удается забеременеть ни самостоятельно, ни с помощью ЭКО с применением гормональной стимуляции овуляции.
- Невозможность получить яйцеклетки в цикле ЭКО.
- Синдром пустых фолликулов – состояние, при котором во время цикла ЭКО фолликулы, вроде бы, нормально растут, а получить яйцеклетки всё равно не удается.
- Отсутствие роста фолликулов во время стимуляции овуляции, даже если врач использует высокие дозы гормонов.
Идея хирургической активации состоит в том, чтобы «разбудить» спящие фолликулы и заставить их созревать.
Как активируют яичники?
На первом этапе врач осматривает женщину, собирает анамнез, проводит обследование, тщательно оценивает состояние репродуктивной функции и здоровья в целом. Иногда уже в это время назначают гормональные препараты. Далее выполняют лапароскопическую операцию – она проводится под наркозом и продолжается примерно 1,5 часа. Во время вмешательства хирург удаляет небольшой кусочек яичника размером 2х2 см. Далее существуют три разных подхода:
- Классическая IVA (Conventional IVA). Удаленную ткань яичника замораживают (проводят криоконсервацию), затем, после разморозки, разрезают на мелкие кусочки, культивируют в течение определенного времени в специальной питательной среде и на конечном этапе помещают обратно в организм женщины.
- IVA с применением «свежей» ткани (Fresh IVA). При использовании такой методики отсутствует этап с замораживанием. Ткань яичников сразу разрезают, культивируют и потом проводят трансплантацию.
- IVA с трансплантацией в тот же день – наиболее быстрая методика. Ткань яичника возвращают в организм женщины в тот же день, когда ее извлекают.
Важным моментом в активации яичников является фрагментация, когда удаленную ткань нарезают на мелкие кусочки. Доктор Кавамура с коллегами считают, что такое механическое воздействие приводит к нарушению в сигнальном пути под названием Hippo. Это сложная цепочка биохимических реакций, которая регулирует пролиферацию (размножение) и созревание клеток, рост органов, заживление повреждений. Предыдущие исследования показали, что путь Hippo весьма чувствителен к нарушению целостности тканей и клеток.
Вот что говорит коллега доктора Кавамура, доктор Сюэ, который участвовал в разработке метода IVA:
«Когда девочка появляется на свет, в ее яичниках есть около 800 тысяч небольших фолликулов. Только часть из них начинает расти во время каждого менструального цикла, а остальные бездействуют. И лишь один созревает настолько, чтобы произвести яйцеклетку, готовую к оплодотворению. Неизвестно, по какому принципу яичник выбирает, какие именно фолликулы начинают расти, и почему все они инактивируются при первичной недостаточности яичников. Наш метод IVA помогает «разбудить» некоторые фолликулы и заставляет их функционировать».
После трансплантации активированной ткани яичников женщина обычно находится под наблюдением в течение 10–12 месяцев. Как только врачи заметят, что в яичниках начали расти фолликулы, они назначат гормональные препараты, а затем проведут ЭКО. В целом методики и подходы могут различаться. Все этапы IVA нужно уточнять в клинике, где она будет проводиться.
Эффективность метода, плюсы и минусы
Согласно некоторым данным, после применения метода IVA удается забеременеть примерно половине женщин с недостаточностью яичников. В случаях же, когда недостаточность сочетается с аменореей (отсутствие месячных более 6 месяцев), и врач говорит, что беременность невозможна, эффективность активации по методу Кавамура достигает 20%.
Многие врачи очень воодушевлены этой методикой. Иногда даже можно услышать, что это самый значительный прорыв в репродуктивной медицине после изобретения ЭКО.
Однако при всех преимуществах IVA имеет и существенные ограничения, и о них важно помнить:
- успех не гарантирован, эффективность методики далеко не 100%;
- IVA не поможет улучшить качество яйцеклеток, а с возрастом оно неминуемо снижается;
- при этом методика весьма дорогостоящая.
Альтернативы
Если женщина столкнулась с недостаточностью яичников, не может забеременеть самостоятельно, и попытки ЭКО заканчиваются неуспешно, то есть две основные альтернативы:
- провести хирургическую активацию яичников по методу Кавамура;
- использовать донорские ооциты.
Что лучше – вопрос, на который нет однозначного ответа. В каждом случае решение нужно принимать индивидуально. Но ввиду более низкой стоимости и более высокой доступности для многих оптимальным вариантом становятся именно донорские половые клетки.
Если же женщина откладывает рождение ребенка на потом, то у нее есть возможность «застраховать» свою репродуктивную функцию. Можно сохранить свои яйцеклетки в криобанке. Они могут находиться в замороженном состоянии годами, не теряя своих качеств. В дальнейшем ооциты будут как «свежие», криоконсервация не повлияет на течение беременности и здоровье ребенка.
В Репробанке можно как сохранить собственные яйцеклетки, так и воспользоваться донорскими. Свяжитесь с нами, и наши специалисты подробно расскажут об этих услугах.
Автор статьи
Гарфутдинова Юлия Олеговна
Врач-консультант, акушер-гинеколог
Ведет прием: пн.-пт.
с 9:00 до 17:00
+7 (499) 116-54-05
info@reprobank.ru
Статья на конкурс «био/мол/текст»: Процент женщин, лишенных радости материнства, с каждым годом возрастает. Среди причин бесплодия всё чаще выделяют первичную недостаточность яичников (ПНЯ). Данная патология заключается в отсутствии фолликулов или нарушении их созревания в ответ на гормональную стимуляцию. Решение проблемы эндокринного бесплодия вследствие синдрома истощения яичников предложили ученые из США и Японии. Им удалось активировать фолликулы яичников в условиях in vitro и имплантировать фрагменты ткани в верхний отдел фаллопиевых труб, что дает женщине шанс стать матерью.
Корни проблемы
Яичник — уникальная эндокринная система, в которой ежемесячно возникает новая секреторная структура — граафов фолликул (рис. 1). Он развивается из микроскопического примордиального фолликула, потенциальная функциональность которого и определяет регулярность менструального цикла женщины.
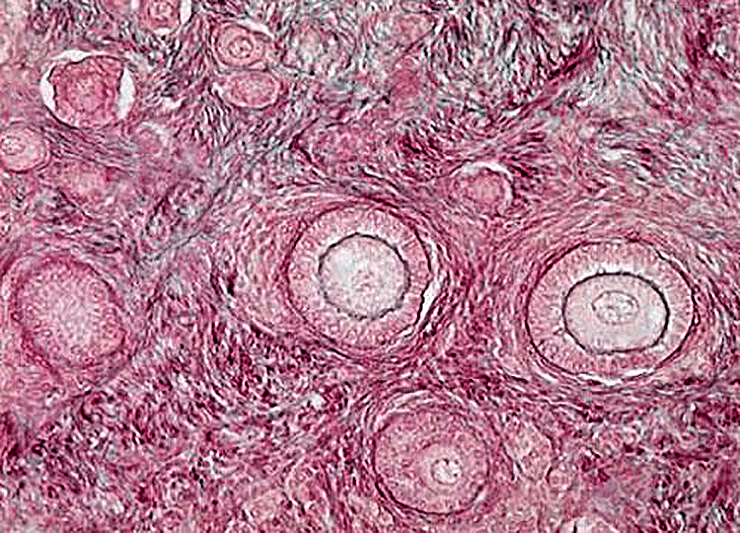
Рисунок 1. Фолликулы яичников
pouchofdouglas
Функция яичников регулируется двумя гормонами гипофиза: фолликулостимулирующим гормоном (ФСГ) и лютеинизирующим гормоном (ЛГ) (рис. 2). В свою очередь, яичники продуцируют гормоны, регулирующие секрецию ФСГ и ЛГ по принципу отрицательной обратной связи: эстрогены, ингибины и прогестерон [1].
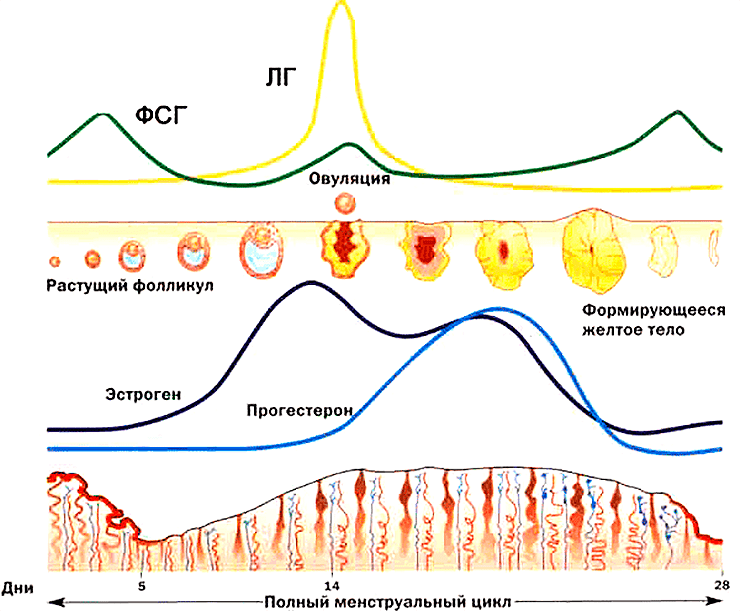
Рисунок 2. ФСГ стимулирует рост и созревание фолликула в яичнике. ЛГ стимулирует выход созревшей яйцеклетки из фолликула (овуляцию).
При недостаточности функции яичников для поддержания снижающейся концентрации яичниковых гормонов происходит резкое повышение секреции гонадотропинов. За их выработку отвечает гипоталамус (рис. 3).
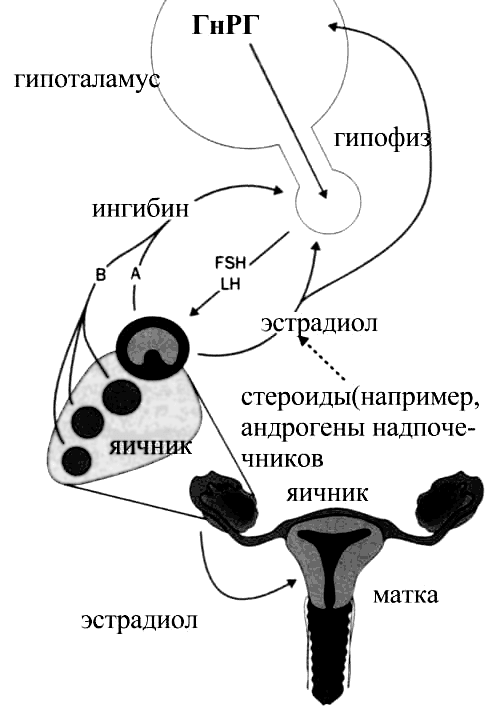
Рисунок 3. Связь функционирования яичников с эндокринной системой
Причины, приводящие к развитию первичной недостаточности яичников (ПНЯ), весьма гетерогенны: генетические, ферментативные, аутоиммунные, инфекционно-токсические, психогенные. Кроме того, в эту группу относят и дефекты в структуре гонадотропинов. В последние годы большое внимание исследователей уделяется молекулярно-генетическим аспектам этой патологии яичников, поскольку выявлен определенный набор генов, который может отвечать за развитие ПНЯ.
Стоит отметить, что термин «первичная недостаточность яичников» в настоящее время применяется для определения состояния, которое ранее называли «преждевременной менопаузой». Ключевое различие заключается в том, что термин «ПНЯ», предложенный еще в 1942 году, характеризует нарушение функции яичников в динамике, а не конечное состояние, что наблюдается при менопаузе [1].
Что происходит на гормональном уровне
Один из половых гормонов — 17β-эстрадиол (рис. 4), который играет важную роль в выполнении репродуктивной функции женщины, — вырабатывается преимущественно в яичниках из мужских половых гормонов — андростендиона и тестостерона [2]; небольшое количество этого гормона также вырабатывается надпочечниками. В процессе угасания функций яичников количество растущих фолликулов в них уменьшается, что приводит к значительному понижению выработки 17β-эстрадиола. Поэтому у женщин с так называемым синдромом истощения яичников наблюдается нехватка этого гормона, которая частично компенсируется большей выработкой 17β-эстрадиола в надпочечниках. Так как менструации становятся нерегулярными, уровень 17β-эстрадиола начинает колебаться, и с прекращением менструаций резко понижается, что приводит к повышению фолликулостимулирующего гормона (ФСГ).

Рисунок 4. β-эстрадиол (кристаллы). Поляризация LM X100.
Механизм активации незрелых фолликулов
Для женщин, страдающих бесплодием по причине рассмотренного заболевания, существует единственная возможность материнства — имплантация оплодотворенной донорской яйцеклетки. Однако группа специалистов из Стэнфордского университета (США) и Медицинского факультета Университета им. Святой Марианны (Япония) предложили альтернативу — метод, позволяющий исключить известные хирургические вмешательства для стимуляции овуляции, такие как клиновидная резекция яичников или лазерное сверление. Врачи удалили яичники у участниц исследования, поделили их на несколько частей, а затем воздействовали на фрагменты яичников препаратами, стимулирующими рост. Спустя несколько дней некоторые из фрагментов ткани были имплантированы в фаллопиевы трубы женщин. Затем специалисты наблюдали за развитием фолликулов. У некоторых участниц исследования сформировались зрелые яйцеклетки, что позволило провести им стандартную процедуру экстракорпорального оплодотворения (ЭКО [3]). Результаты исследования опубликованы в журнале Proceedings of the National Academy of Sciences [4].
Важно отметить, что возможность провести подобное лечение возникла благодаря изучению сигнального клеточного пути под названием Hippo [5], который представляет собой один из ключевых компонентов регуляции таких важных процессов, как контактное ингибирование роста клеток и связанного с ним контроля размера внутренних органов [6]. Первоначально белковый комплекс Hippo был открыт у дрозофил. Мухи, у которых его функционирование было нарушено, буквально увеличивались в размерах (из-за чего регулятор и получил своё название: «Hippo» происходит от слова «гиппопотам»). Затем его обнаружили и у млекопитающих.
Развитие эмбриона, деление эмбриональных клеток и рост тканей и органов эволюционно контролируются работой различных регуляторов. По словам одного из авторов исследования Арона Сюэ (Aaron Hsueh) — акушера-гинеколога из Стэнфордского Университета в Калифорнии — у женщин с синдромом истощения яичников наблюдается повышенная активность регулятора Hippo [8]. Другими словами, он блокирует созревание практически всех фолликулов яичника, что минимизирует возможность наступления овуляции и дальнейшего оплодотворения.
Ученые нарушили работу сигнального пути Hippo в удаленных яичниках и, таким образом, предотвратили преждевременную остановку развития фолликулов. Далее специалисты стимулировали активность другого сигнального пути, называемого Akt, что способствовало ускорению роста фолликулов [9], [10].
Клинические исследования проводились сначала на лабораторных животных. На следующем этапе в эксперименте согласились принять участие 27 женщин, страдающих от первичной дисфункции яичников. В ходе исследования выяснилось, что у некоторых женщин в яичниках не было фолликулов. В яичниках 13 пациенток обнаружили незрелые фолликулы; из них у восьми женщин применение нового метода лечения способствовало росту жизнеспособных фолликулов. Для 14 женщин лечение оказалось неэффективным.
В результате зрелые яйцеклетки были получены у пяти женщин и использованы для ЭКО. Одна из пациенток в возрасте 29 лет во время курса лечения на 37 неделе беременности родила ребенка весом 3,3 кг (рис. 6). Научная группа надеется, что эффективность нового метода лечения достигнет 30%. И, более того, по их словам, этот метод может также помочь женщинам, перенесшим лучевую или химиотерапию, и пациенткам в возрасте 40–45 лет с нерегулярным менструальным циклом [11].
Рисунок 6. Казухиро Кавамура (Kazuhiro Kawamura) — один из ученых, участвовавший в исследовании — держит на руках новорожденного мальчика, которого родила первоначально бесплодная женщина
Kazuhiro Kawamura
Мнения и прогнозы
По мнению Марчелле Цедарса (Marcelle Cedars) — специалиста в области репродуктивной онкологии из Университета Калифорнии в Сан-Франциско — исследователи поторопились апробировать новый метод лечения бесплодия на человеке: «Ученые продемонстрировали рождение здорового потомства при проведении предварительных исследований на мышах, но не было получено доказательств роста, развития и/или плодовитости этого поколения» [12].
Авторы исследования полагают, что метод подходит бесплодным женщинам среднего возраста, а также тем, кому диагностировали первичную недостаточность яичников, вследствие которой в более чем 50% случаев беременность не наступает. Однако не все эксперты разделяют их оптимизм. Руководитель врачебной группы, изучающей оплодотворение, из Университета Южной Калифорнии Ричард Паульсон (Richard Paulson) убежден, что ключевое условие эффективности разработанного механизма лабораторной «активации» фолликула — наличие в нем здоровой яйцеклетки. Кроме того, Паульсон заостряет внимание на том, что неразумно сопоставлять результаты лечения женщины в возрасте 29 лет с результатами лечения женщины в 40 лет, поскольку гормональная стимуляция роста и развития фолликулов в разные возрастные периоды происходит с различной интенсивностью.
Рассмотренный консервативный метод стимуляции овуляции путем блокировки сигнального пути Hippo в отдельных фрагментах ткани яичников может быть полезен женщинам, больным раком или проходящим процедуры стерилизации. Но все же главное достижение ученых — это рождение ребенка у женщины, которая без их участия никогда не смогла бы стать матерью.
- Lawrence M. Nelson. (2009). Primary Ovarian Insufficiency. N Engl J Med. 360, 606-614;
- Березовская Е.П. (2013). Менопауза (климакс). «Доктор Комаровский»;
- «За экстракорпоральное оплодотворение» — это не тост, а Нобелевская премия!;
- K. Kawamura, Y. Cheng, N. Suzuki, M. Deguchi, Y. Sato, et. al.. (2013). Hippo signaling disruption and Akt stimulation of ovarian follicles for infertility treatment. Proceedings of the National Academy of Sciences. 110, 17474-17479;
- Jianzhong Yu, John Poulton, Yi-Chun Huang, Wu-Min Deng. (2008). The Hippo Pathway Promotes Notch Signaling in Regulation of Cell Differentiation, Proliferation, and Oocyte Polarity. PLoS ONE. 3, e1761;
- Fernando D. Camargo, Sumita Gokhale, Jonathan B. Johnnidis, Dongdong Fu, George W. Bell, et. al.. (2007). YAP1 Increases Organ Size and Expands Undifferentiated Progenitor Cells. Current Biology. 17, 2054-2060;
- Leslie J. Saucedo, Bruce A. Edgar. (2007). Filling out the Hippo pathway. Nat Rev Mol Cell Biol. 8, 613-621;
- Hsueh A. (2013). Maturation of human oocytes for SCNT and embryonic stem cell derivation. California’s stem cell agency;
- D. Pan. (2007). Hippo signaling in organ size control. Genes & Development. 21, 886-897;
- J. I. Lin, C. L. C. Poon, K. F. Harvey. (2013). The Hippo Size Control Pathway—Ever Expanding. Science Signaling. 6, pe4-pe4;
- Whiteman H. (2013). Breakthrough method gives infertile women hope. Medical News Today;
- Karen Ravn. (2013). Grafted ovaries lead to successful pregnancy. Nature.
Всё чаще в современном мире рождение первенца откладывается женщинами до момента достижения определенного уровня жизни и успеха. В России средний возраст рождения первого ребенка составляет 28 лет. В некоторых странах Европы этот возраст соответствует 31 году.
В связи с тенденцией к откладыванию материнства медицина активно изучает способы определения потенциала фертильности женщины – то есть способности конкретной женщины к зачатию.
Оценка овариального резерва входит в обследование пары при бесплодии, невынашивании беременности, планировании беременности и для оценки прогноза фертильности женщины.
Что такое овариальный резерв?
Одним из методов определения фертильности женщины является оценка овариального резерва (резерв или запас яичников). Однако нужно понимать, что не всегда высокий овариальный резерв гарантирует быстрое наступление беременности, и наоборот, женщины с крайне низким овариальным резервом вовсе не лишены способности к зачатию.
Это связано с тем, что овариальный резерв – это генетически заложенный запас фолликулов в яичниках, а для наступления беременности необходимо не только наличие фолликула, но и слаженная работа гормональной системы, яичников, маточных труб и матки, а также важно качество сперматозоидов.
Именно поэтому, оценив только лишь овариальный резерв, нельзя сделать точный прогноз на наступление беременности.
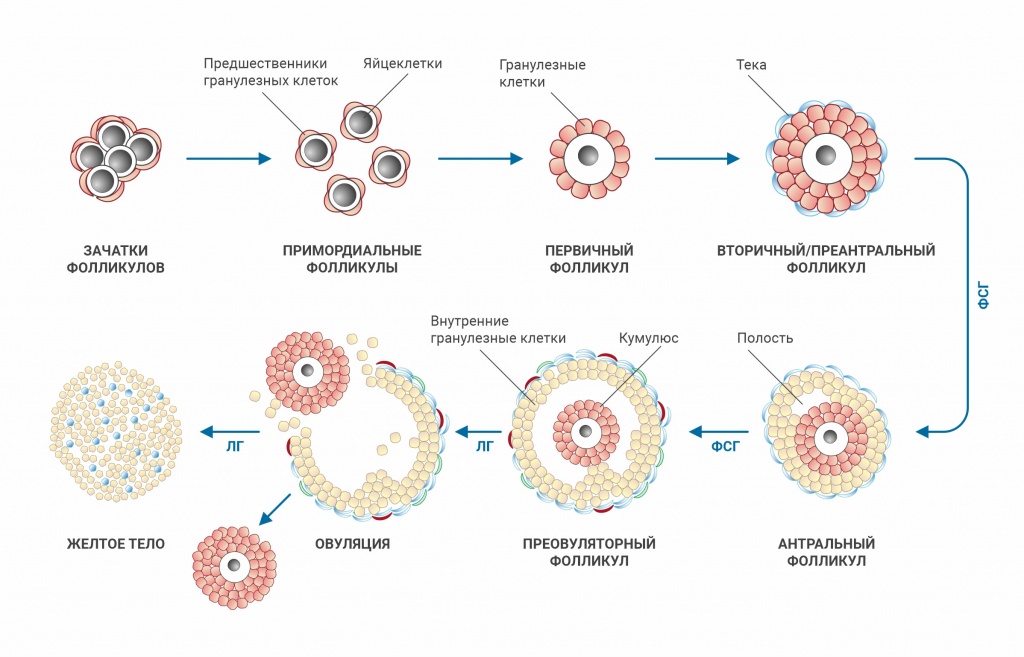
Фолликулогенез
Фолликулогенез – это процесс развития фолликулов (и яйцеклеток) в яичнике.
Формирование женских половых клеток начинается ещё до момента рождения.
Во время эмбрионального периода развития плода образуются первичные половые клетки, которые многократно делятся путем митоза, образуя оогонии, а затем образуются ооциты первого порядка, которые содержат диплоидный набор хромосом (46 хромосом или 23 пары). Ооциты первого порядка, окруженные одним слоем клеток гранулезной оболочки, образуют примордиальные фолликулы.
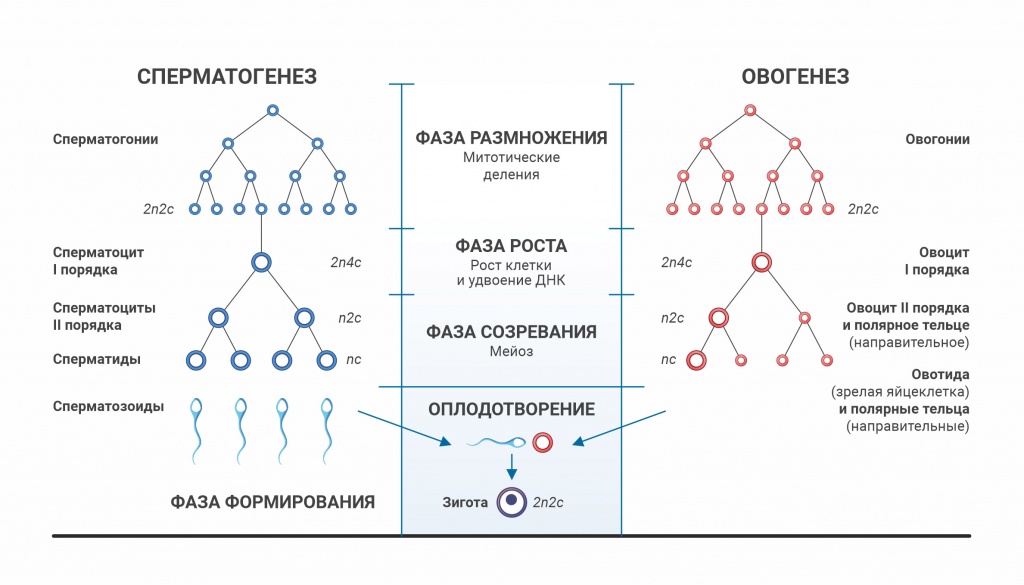
Именно количество примордиальных фолликулов (примордиальный пул) в яичнике определяет овариальный резерв.
Сколько яйцеклеток у женщины?
К моменту начала менструации в яичнике девочки в норме находится около 270 000 – 470 000 фолликулов. И только 300 — 500 из них продолжат своё развитие до стадии ооцитов второго порядка (т.е. достигнут овуляции), а остальная часть подвергнется атрезии на различных этапах развития.
Процесс уменьшения количества яйцеклеток начинается еще во внутриутробном периоде развития девочки и продолжается до менопаузы. Этот процесс невозможно замедлить, атрезия продолжается даже на фоне беременности, лактации и приёма оральных контрацептивов. А также, вопреки всем мифам, этот процесс невозможно ускорить путем стимуляции овуляции и ЭКО. Это связано с тем, что на ранней стадии развития фолликулы не чувствительны к гормонам организма и вводимые гормональные препараты не оказывают на них влияния.
Периоды фолликулогенеза
- Гормон-независимый период. Фолликулы растут от стадии примордиального до стадии вторичного (преантрального) в условиях отсутствия гипофизарных гормонов. Этот период длительный и в настоящее время нет каких-либо маркёров, которые могли бы дать характеристику этой фазы у конкретной женщины.
- Гормон-чувствительная фаза. Фолликулы растут при базальных уровнях гипофизарных гормонов, от стадии вторичного (преантрального) до стадии антрального, размер которого составляет 1-2 мм в диаметре. Этот период длится примерно 100-120 дней (3-4 менструальных цикла). Получить информацию о количестве данного пула фолликулов можно по уровню АМГ в крови – поскольку именно этот гормон выделяется клетками гранулёзы фолликулов в течение всего гормон-чувствительного периода, т.е. уровень этого гормона определяется числом фолликулов на данной стадии роста.
- Гормонозависимый период. Начинается в конце второй фазы менструального цикла – начинает формироваться группа фолликулов, которые под действием гипофизарных гормонов (особенно ФСГ) вырастают от стадии большого антрального в преовуляторные – и достигают момента овуляции. За один цикл только один фолликул достигнет овуляции (редко два или три), остальные подвергаются атрезии. Большинство лабораторных тестов характеризуют именно этот период фолликулогенеза: ФСГ, ЛГ, эстрадиол, ингибин В, а также ультразвуковое определение числа антральных фолликулов и объема яичников.
Более подробно о фолликулогенезе и овариальном резерве смотрите в видео И.И.Гузова: Новые способы получения яйцеклеток при истощении овариального резерва.
Маркёры резерва яичников
Возраст
Бесспорно, одним из самых главных факторов, определяющих овариальный резерв, является возраст. Овариальный резерв обратно пропорционален возрасту, то есть, он необратимо снижается с течением времени.
С каждым менструальным циклом общее количество фолликулов уменьшается на всех стадиях роста фолликула и механизмы этих процессов до сих пор хорошо не изучены. Также имеет значение скорость исчезновения фолликулов, которая удваивается при снижении пула примордиальных фолликулов до 25000, что примерно соответствует возрасту 37 лет. Именно после этого возраста овариальный резерв снижается критически.
Важно отметить, что сохранность менструальной функции и даже овуляции не всегда отражает репродуктивный потенциал. Средний возраст менопаузы 51-52 года и до этого периода менструальная функция может быть не нарушена и может случаться овуляция, однако количество естественных беременностей после 42-45 лет крайне низкое.
Старение репродуктивной системы, так же как и воздействие на организм различных факторов среды (ятрогенные, различные интоксикации, курение, алкоголь и т.д), которые вызывают схожие со старением механизмы – могут влиять не только на количество, но и на качество яйцеклеток, поэтому с возрастом также снижается и качество ооцитов.
По одной из теорий качество ооцитов закладывается внутриутробно, и в последующем ооциты, менее подверженные нерасхождению хромосом, овулируют первыми, в то время как ооциты низкого качества достигают овуляции в более позднем периоде жизни женщины. Также имеют значение различные повреждающие воздействия на половые клетки в течение жизни, что приводит к нарушению микроциркуляции, окислительному стрессу, гипоксическим процессам в фолликулярной жидкости.
Антимюллеров гормон — АМГ
Антимюллеров гормон – гормон, который выделяется клетками гранулёзы фолликулов диаметром до 6-8 мм и который отражает количество фолликулов в яичнике на стадии гормон-чувствительного роста.
Этот гормон считается самым ранним и наиболее чувствительным маркером репродуктивного старения, позволяет прогнозировать ответ яичников на гормональную стимуляцию, а также время наступления менопаузы.
Яичники плода женского пола начинают продуцировать АМГ примерно на 36-й неделе беременности. В период полового созревания уровень повышается, достигая пика в возрасте 25 лет, после чего начинает постепенно снижаться практически до нулевых значений в период менопаузы.
Когда сдавать антимюллеров гормон
АМГ можно оценивать в любой день менструального цикла. Уровень гормона совсем незначительно колеблется на протяжении цикла, при этом наибольшие отклонения отмечаются у молодых женщин с более высоким базальным АМГ по сравнению с женщинами старшего репродуктивного возраста, у которых выявляются более низкие базальные уровни АМГ.
Повышение антимюллерова гормона
Уровень гормона напрямую зависит от гинекологических заболеваний и от некоторых внешних факторов. Например, при СПКЯ диагностируются значительно повышенные уровни AMГ, которые коррелируют со степенью выраженности заболевания, а также несут риски гиперстимуляции и многоплодия при проведении стимуляции овуляции.
Причины снижения АМГ
К заболеваниям, снижающим овариальный резерв и уровень АМГ, относится эндометриоз, генетические факторы (например, премутация FMR1), операции на яичниках. У курящих женщин отмечено более раннее снижение уровня АМГ и более раннее начало менопаузы, предположительно, за счет истощения антральных фолликулов. Прием комбинированных оральных контрацептивов может снижать уровень гормона в крови, который возвращается к исходным значениям через 2-4 месяца после отмены препарата.
Что значит и когда сдавать антимюллеров гормон
Исследование уровня АМГ у женщин репродуктивного возраста позволят своевременно диагностировать снижение овариального резерва и ориентировать пациенток на реализацию репродуктивной функции.
Базальный уровень ФСГ и ингибина В
Данные показатели определяются на 2-3 дни менструального цикла.
Под воздействием фолликулостимулирующего гормона гипофиза (ФСГ) фолликулы в яичнике начинают расти, а клетки гранулёзы фолликулов начинают продуцировать ингибин В. Уровень ингибина В коррелирует с количеством фолликулов в яичниках. С возрастом число примордиальных фолликулов резко уменьшается и, следовательно, продукция ингибина снижается, что ведет к повышению ФСГ. Важно отметить, что снижение уровня ингибина В в крови происходит несколько ранее, чем повышение ФСГ, поэтому ингибин В является индикатором начинающегося угасания репродуктивной функции.
Повышение ФСГ более 10-12 МЕ/л говорит о снижении овариального резерва, при этом менструальный цикл может быть не нарушенным. А повышение ФСГ более 25 МЕ/л свидетельствует о приближающейся менопаузе. Такой компенсаторный механизм «заставляет» работать яичники более усиленно, позволяя ещё некоторое время сохранить овуляторную функцию.
Подробнее о гормональном обследовании смотрите видео: Гормоны и оценка овариального резерва
Подсчет антральных фолликулов (AFC)
Antral Follicle Count (AFC) — подсчёт антральных фолликулов – это ультразвуковой метод оценки овариального резерва, во время которого в каждом яичнике считаются фолликулы, имеющие размер от 2 до 10 мм на 2-3-й дни менструального цикла. Также производится измерение объема яичников.
Количество фолликулов более 10-11 в обоих яичниках говорит о сохранном овариальном резерве. Объем яичников в репродуктивном возрасте составляет от 4 до 10см3 и чем меньше фолликулов в яичнике, тем меньше будет его объем.
Более подробно можно прочитать здесь: Подсчёт антральных фолликулов, AFC, овариальный резерв.
EFORT-тест
EFORT-тест — это оценка функционального резерва яичников по их реакции на введение экзогенного фолликулостимулирующего гормона (ФСГ).
Метод основан на двукратном измерении в крови уровней гормонов (ингибина В и АМГ) и оценки их динамики после введения фолликулостимулирующего гормона.
Первый забор крови производится на 3 день цикла. Затем вводится препарат фолликулостимулирующего гормона и через 24 часа производится повторный забор крови на анализы.
В норме после введения гонадотропного препарата уровень АМГ должен снизиться, а концентрация ингибина В — повыситься. При истощении овариального резерва ответ яичников будет недостаточным, поэтому показатели ингибина В и АМГ могут измениться в обратном соотношении или остаться прежними.
Несоответствие показателей овариального резерва
Существует множество показателей для оценки овариального резерва и прогнозирования реакции яичников на стимуляцию. В целом, с возрастом уровни ФСГ повышаются, а уровни АМГ, ингибина В и количества антральных фолликулов (AFC) снижаются. Дополняют картину ингибин B и эстрадиол в раннюю фолликулярную фазу.
В ходе диагностики и лечения у каждой пятой женщины наблюдаются несоответствия в этих показателях. Поэтому для оценки используется не какой-то один маркер, а комплекс исследований, на основании которых делается вывод. Врач учитывает всю картину, включая возраст, акушерский анамнез, заболевания и лечение.
В исследовании Gleicher et al. было показано, что реакция на стимуляцию снижалась в следующем порядке: нормальные уровни АМГ и ФСГ, нормальные уровни АМГ, но снижение уровни ФСГ, снижение уровни АМГ, но нормальные уровни ФСГ и снижение АМГ и ФСГ.
Уровень АМГ и количество антральных фолликулов являются двумя наиболее точными показателями для прогнозирования резерва и реакции яичников. Как АМГ, так и AFC показали значительную корреляцию с возрастом и ответом на стимуляцию. Чем выше значение AFC, тем благоприятнее прогноз, даже при снижении АМГ.
Почему существует несоответствие между уровнем AFC и АМГ? Это может быть связано с различиями в популяции фолликулов, представленной двумя показателями. AFC относится к числу фолликулов диаметром от 2 мм до 9 мм. Они реагируют на гонадотропин и могут развиться в цикле стимуляции.
АМГ же вырабатывается гранулезными клетками преантральных и малых антральных фолликулов диаметром менее 4 мм в яичнике, косвенно отражает популяцию рано растущих фолликулов. Они не способны вступить в стадию набора фолликулов во время цикла индукции овуляции. Следовательно, уровень АМГ в основном отражает резервную функцию яичников.
Факторы, снижающие овариальный резерв
Воспалительные заболевания органов малого таза
Воспалительные заболевания органов малого таза иногда сопровождаются выраженным спаечным процессом, склерозом тканей, в том числе тканей яичников. Происходит нарушение питания яичникового фолликулярного аппарата, которое может повлечь за собой снижение овариального резерва.
Курение
Курение оказывает значительное негативное влияние на овариальный резерв. У курящих женщин отмечаются повышенные уровни гормона ФСГ, сниженный АМГ и снижение антральных фолликулов в яичниках. Снижение овариального резерва в группах курящих женщин встречается в 3 раза чаще, чем у некурящих пациенток. А время наступления менопаузы у курящих женщин в среднем на 2 года раньше.
Оперативные вмешательства на органах малого таза
Значительную роль в уменьшении овариального резерва играют оперативные вмешательства на яичниках.
Это одна из самых распространенных причин снижения овариального резерва. Любая операция на яичнике – резекция по поводу кисты, эндометриоза, апоплексии – ведет к потере части ткани яичника и к снижению овариального резерва.
Лучевая и химиотерапия
Радиационное и химиотерапевтичекое лечение различных опухолевых заболеваний крайне негативно сказывается на репродуктивной функции. Поэтому, разработка тестов определения овариального резерва позволяет прогнозировать дальнейшую репродуктивную и менструальную функцию у молодых пациенток с онкологическими заболеваниями.
Генитальный эндометриоз
Эндометриоз является одной из ведущих причин женского бесплодия. Эндометриоз III–IV стадии ассоциирован с значительным уменьшением овариального резерва. Это связано не только с поражением эндометриозом непосредственно ткани яичника, но и со значительным объемом резекции яичников, необходимым при хирургическом лечении эндометриодных кист.
Преждевременное истощение яичников
В случае выявления снижения овариального резерва у молодых женщин проводится анализ гена FMR1 – «ломкой» Х-хромосомы. У 21% женщин с премутацией в этом гене может развиваться преждевременная недостаточность яичников и присутствует риск наследственного заболевания сыновей.
Многие эксперты говорят, что уточнение статуса гена FMR1 может быть полезно любой женщине, планирующей беременность.
Несколько часто задаваемых вопросов гинекологу об овариальном резерве
Зачем и кому оценивать овариальный резерв?
Приведённые маркёры оцениваются для прогноза вероятности наступления беременности, оценки функции яичников, для прогнозирования ответа яичников на стимуляцию овуляции, а также обязательно должен оцениваться женщинам с репродуктивными проблемами, бесплодием, нарушением цикла и женщинам, которые по какой-то причине хотят отложить материнство на неопределенный срок.
Когда подозревать снижение овариального резерва?
Снижение овариального резерва это растянутый во времени процесс. Очень часто признаки преждевременного истощения яичников могут отсутствовать долгое время, а когда появляется повод обратиться к врачу – резерв оказывается крайне низким.
Обратиться к врачу нужно:
- Если началось изменение характера менструального цикла: например он удлинился, всё чаще происходят задержки менструации, или они вовсе стали отсутствовать в течение более 3х месяцев. Либо наоборот цикл стал укорачиваться.
- Если есть в анамнезе операции на яичниках, наличие эндометриоза, кист яичников, спаечного процесса в малом тазу.
- Если в семье были случаи раннего наступления менопаузы, преждевременного истощения яичников.
- Если есть проблемы с зачатием, ненаступление беременности в течение 6-12 месяцев.
Какими в норме должны быть маркёры овариального резерва?
Общепринятых четких норм нет, следует оценивать все данные в совокупности, особую роль играет возраст пациентки и её анамнез – длительность бесплодия (если оно есть), наличии сопутствующей гинекологической и экстрагенитальной патологии.
В общих чертах можно выделить следующие группы женщин:
- Нормальный овариальный резерв: регулярный менструальный цикл, уровень ФСГ не более 12 МЕ/л, АМГ более 1.2 нг/мл, количество антральных фолликулов в каждом яичнике более 5, объём яичников более 5 см3.
- Сниженный овариальный резерв: нарушение менструального цикла, его укорочение или удлинение, уровень ФСГ более 12 МЕ/л, АМГ более 0,6, но менее 1,2 нг/мл, объем яичников от 3 до 5 см3, количество антральных фолликулов 3-5 в каждом яичнике.
- Крайне низкий овариальный резерв: стойкие нарушения менструального цикла, олигоменорея, аменорея, повышение ФСГ более 25 МЕ/л, АМГ менее 0,6 нг/мл, объем яичников менее 3 см3, число антральных фолликулов менее двух в каждом яичнике.
Возможна ли естественная беременности при низком овариальном резерве или только ЭКО?
Шансы наступления естественной беременности снижаются, но они есть. Случаев наступления беременности при низком овариальном резерве очень много. По одному показателю овариального резерва нельзя делать прогноз на беременность или направлять на ЭКО. Следует провести полноценное обследование, исключить другие возможные факторы ненаступления беременности, скорректировать их и только после этого принимать решение о необходимости ЭКО у конкретной женщины, исходя из ее возраста, длительности бесплодия и ведущей причины отсутствия беременности.
Можно ли повысить овариальный резерв?
Самая сложная проблема в репродукции – это старший репродуктивный возраст и преждевременное истощение яичников — состояние, при котором значительно уменьшается число антральных фолликулов в яичниках, критично низкий АМГ и высокие цифры ФСГ, возникают задержки менструации или они вовсе отсутствуют. Такое заболевание возникает или вследствие проведенных операций на яичниках с иссечением большого количества ткани, либо же из-за генетических особенностей женщины.
Учеными доказано, что в яичниках таких женщин (даже при отсутствии менструации) всё равно есть фолликулы, но преантральные, «спящие» — на которые нельзя воздействовать гормональными препаратами. Профессор Кавамура разработал уникальную методику воздействия на ткань яичника с преантральными фолликулами, после чего они становятся антральными, т.е. чувствительными к гормональной стимуляции.
Активация яичников по методу Кавамура происходит следующим образом: при лапароскопии проводится забор ткани яичника. А затем в лабораторных условиях производят активацию преантральных фолликулов и проводят обратный перенос активированной ткани в яичник. У женщины даже появляются собственные менструации, как правило, на 1-3 цикла. В этот период проводится программа стимуляции овуляции, и пункции для получения ооцитов с помощью программы ЭКО. К сожалению, только у 50% женщин происходит фолликулярная активация в яичниках, позволяющая получить эмбрионы. А до операции неизвестно, сколько «спящих» фолликулов в яичниках женщины сохранилось и как они реагируют на активацию.
Еще одним методом, положительно сказывающимся на овариальном резерве и улучшающим качество доминантного фолликула является применение низких доз дигидроэпиандростерона (ДГЭА) пациентками старшего репродуктивного возраста. Это происходит потому, что в организме с возрастом происходит дефицит ДГЭА, из которого образуются все андрогены и эстрогены. А для поддержки внутриклеточного механизма выработки тестостерона и эстрадиола возможно введение ДГЭА извне. Положительный эффект наступает через 3-4 месяца после начала приема препарата, что примерно соответствует полному циклу роста фолликулов в яичниках.
Подробнее о ДГЭА
Репродуктивная функция – это сложный процесс слаженной работы женских половых органов и других эндокринных желёз. Очень важно как можно раньше выявлять возможную причину репродуктивных проблем, чтобы не терять драгоценное время.
Случай из практики
Пациентка 35 лет обратилась на прием по поводу отсутствия беременности в течение года. Предыдущие беременности (девочки 12 лет и 8 лет) наступали сразу и протекали без особенностей. В течение последних 3 лет отмечала редкие менструации, 1 раз в 3-5 месяцев. Было проведено обследование, которое выявило снижение овариального резерва – преждевременное истощение яичников: АМГ – 0,4 нг/мл, ФСГ – 22 МЕ/мл, по УЗИ в яичниках единичные фолликулы. После постановки диагноза супруги решили оставить попытки зачатия, поскольку уже имели двух здоровых детей. Была назначена циклическая заместительная гормональная терапия, чтобы избежать сердечно-сосудистых осложнений у женщины с ПНЯ. Через несколько месяцев пациентка сообщила мне о спонтанно наступившей беременности на фоне ЗГТ, о которой она даже не догадывалась до начала ощущения шевелений плода.
В данном случае, крайне низкий АМГ и преждевременное истощение яичников не помешало наступлению беременности, поскольку не было другой сопутствующей гинекологической патологии, а ненаступление беременности в течение года было связано с отсутствием овуляции, которая произошла самостоятельно на фоне заместительной гормональной терапии.
Читайте также
Яйцеклетка. Новые способы получения яйцеклеток при истощении овариального резерва. Новости науки.
Список литературы
- Fertility preservation for deferred childbearing for nonmedical indications. Authors: Karine Chung, MD, MSCE Meghan B Smith, MD uptodate.com
- Ovarian development and failure (menopause) in normal women. Author: Corrine K Welt, MD, Section Editors: Robert L Barbieri, MD, William F Crowley, Jr, MD, Deputy Editor: Kathryn A Martin, MD uptodate.com
- Определение референтных интервалов антимюллерова гормона, специфичных для российской популяции © И.И.Гузов , Е.Ю.Печёрина, А.В.Ружанская, В.А.Козлов, О.И. Ласкина, Н.Н.Синтюрина, Е.А.Седышкина, Е.Ю.Гвоздик, С.А.Тё, А.В.Зенкина, А.С. Куранников Лабораторная служба 2019, Т. 8, № 2, с. 25–35
- Боярский К. Ю. Клиническое значение тестов определения овариального резерва в лечении бесплодия / Санкт-Петербург, 2000.
- Боярский К. Ю. Фолликулогенез и современная овариальная стимуляция (обзор литературы) /К. Ю. Боярский // Проблемы репродукции. – 2002.
- Калинина Е. А. Резервы повышения эффективности экстракорпорального оплодотворения при лечении бесплодия у женщин с гинекологическими заболеваниями : Научный центр акушерства, гинекологии и перинатологии РАМН. – М.,2005.
- Мишиева Н. Г. Бесплодие у женщин позднего репродуктивного возраста: принципы диагностики и лечения в зависимости от овариального резерва / ФГУ «Научный центр акушерства, гинекологии и перинатологии им. В. И. Кулакова 2008.
- Количественный анализ состава фолликулов яичника при эндометриозе / Курило Л. Ф. [и др.] // Проблемы репродукции. — 2006.
- Назаренко Т. А., Смирнова А. А. Индукция моно- и суперовуляции: оценка овариального резерва, ультразвуковой и гормональный мониторинг // Проблемы репродукции. 2004.
- Evaluation and management of infertility in females of advancing age. Author: Mary E Morris, MD, PhD uptodate.com
Дементьева В.О.
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России
- ORCID:
0000-0001-9850-7982
Асатурова А.В.
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России
- ORCID:
0000-0001-8739-5209
Степанян А.А.
Академия женского здоровья и эндоскопической хирургии
Смольникова В.Ю.
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России
- SPIN РИНЦ: 3352-7880
- Scopus AuthorID:
55353025600 - ORCID:
0000-0002-8025-4849
Аракелян А.С.
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России
Гус А.И.
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России

Одноэтапный хирургический метод активации функции яичников у пациенток с преждевременной недостаточностью яичников и «бедным» овариальным ответом
Авторы:
Адамян Л.В., Дементьева В.О., Асатурова А.В., Степанян А.А., Смольникова В.Ю., Аракелян А.С., Гус А.И.
Как цитировать:
Адамян Л.В., Дементьева В.О., Асатурова А.В., Степанян А.А., Смольникова В.Ю., Аракелян А.С., Гус А.И. Одноэтапный хирургический метод активации функции яичников у пациенток с преждевременной недостаточностью яичников и «бедным» овариальным ответом. Проблемы репродукции.
2020;26(5):58‑64.
Adamyan LV, Dementyeva VO, Asaturova AV, Stepanian AA, Smolnikova VYu, Arakelyan AS, Gus AI. One-step surgery for activation of ovarian function in patients with premature ovarian insufficiency (POI) and «poor» ovarian response. Russian Journal of Human Reproduction. 2020;26(5):58‑64. (In Russ.)
https://doi.org/10.17116/repro20202605158
По данным официальной статистики, каждая шестая пара в России сталкивается с проблемой бесплодия, решение которой в полной мере до конца не найдено, даже с учетом возможности применения различных методов вспомогательных репродуктивных технологий (ВРТ) [1]. Сниженный овариальный резерв, как самостоятельная причина или как сочетанный фактор женского бесплодия, наряду с трубно-перитонеальным, мужским и др. является существенным препятствием к достижению беременности в программах с использованием собственных ооцитов в связи с низкой эффективностью стимуляции функции яичников, даже с применением высоких доз гонадотропинов [2]. Преждевременная недостаточность яичников (ПНЯ), представляющая собой крайнюю степень снижения овариального резерва, определяется как гипогонадизм в возрасте до 40 лет у женщин, ранее имевших нормальный менструальный цикл. Такой диагноз может быть верифицирован путем получения минимум двух результатов повышенного фолликулостимулирующего гормона (ФСГ) (более 25 МЕ/л) с интервалом 4 недели [3]. Частота данной нозологии колеблется от 1 до 13% [4]. Одним из принципиальных моментов является создание классификации различных форм ПНЯ — классической, оккультной и биохимической, позволяющей обосновать необходимость решения репродуктивных задач до полной клинической манифестации заболевания [5]. «Бедный» ответ на стимуляцию функции яичников — это созревание менее трех фолликулов при стимуляции высокими дозами гонадотропинов. Данная нозология, по данным ASRM, обусловливает до 50% отмены всех циклов экстракорпорального оплодотворения (ЭКО) [6]. Возможности стимуляции функции яичников ограничены гонадотропинзависимой стадией фолликулогенеза — когортой антральных фолликулов в каждом менструальном цикле. В связи с резким снижением количества антральных фолликулов у пациенток с различными формами ПНЯ и «бедным» ответом на стимуляцию функции яичников необходим поиск механизмов воздействия на фолликулогенез в гонадотропин-независимой стадии — на этапе рекрутинга примордиальных фолликулов с целью оптимизации последующей стимуляции функции яичников и повышения эффективности лечения бесплодия у этой категории пациенток [7].
Метод активации фолликулярного роста, впервые описанный K. Kawamura, A. Hsueh и соавт., эффективность которого подтверждена клинически, а также данными молекулярно-генетических исследований, сегодня нашел применение в различных модификациях более чем в 6 странах мира [8, 9]. Одним из фундаментальных обоснований механизма хирургического воздействия в рамках описанной методики является влияние фрагментации ткани яичников на полимеризацию актина, прекращение передачи сигнала по пути Hippo, повышение концентрации факторов роста CCN и ингибиторов апоптоза BIRC 1,7 [10]. Изначально методика японских исследователей предполагала проведение односторонней овариоэктомии с последующим этапом демедулляции под гистологическим контролем, криоконсервацию коркового слоя яичниковой ткани, его фрагментацию и двухдневную активацию in vitro (добавление в среду ингибитора PTEN и активатора PI3K-сигнальных путей). Далее производилась ипсилатеральная трансплантация фрагментированной размороженной ткани под серозную оболочку маточной трубы лапароскопическим доступом [9].
Дальнейшее изучение фундаментальных механизмов хирургической активации яичниковой ткани позволило оптимизировать методику до одно-этапного метода. В России первая операция, в основу которой легла хирургическая активация функции яичников, выполнена академиком РАН Л.В. Адамян 06.03.19 [11]. При этом разработаны собственные подходы к тактике ведения, включающей оперативное лечение на этапах идентификации зоны биопсии яичниковой ткани под оптическим увеличением, микрохирургического «шейвинга» коркового слоя яичников, подготовки ложа для реимплантации фрагментированной овариальной ткани, а также ушивания краев разреза для оптимизации данного этапа операции.
Цель исследования — оптимизация методов лечения бесплодия у пациенток со сниженным овариальным резервом с использованием одноэтапного хирургического метода активации функции яичников.
Материал и методы
Характеристика пациентов, включенных в исследование. Проведено проспективное клинико-лабораторное обследование 50 пациенток репродуктивного возраста с ПНЯ (1-я группа — n=22) и «бедным» ответом на стимуляцию функции яичников (2-я группа — n=28). Пациентки разделены на 2 группы согласно критериям ESHRE 2011 и 2014 гг. соответственно. Пациентки с «бедным» ответом на стимуляцию функции яичников имели в анамнезе минимум 2 неудачные попытки ЭКО, ассоциированные с данной нозологией. Средний возраст пациенток 1-й группы составил — 34,64±5,063 года. Средний возраст пациенток 2-й группы — 38,5±3,88 года.
Основная жалоба у женщин обеих групп — бесплодие, резистентное к стандартным методам лечения, включая ВРТ. Всем пациенткам по заключению репродуктолога рекомендована донация ооцитов как единственно возможный вариант достижения беременности. Пациентки с ПНЯ наряду с бесплодием отмечали жалобы, ассоциированные с дефицитом женских половых гормонов.
На дооперационном этапе все пациентки проходили общеклиническое, эхографическое, клинико-лабораторное обследование. Уровни гормонов — ФСГ, лютеинизирующего гормона (ЛГ), эстрадиола (Е2), антимюллерова гормона (АМГ) — определяли методом иммуноферментного анализа (ИФА, ELISA). Ультразвуковое исследование органов малого таза выполняли в отделении ультразвуковой и функциональной диагностики ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России (руководитель отделения — д.м.н., профессор А.И. Гус) с помощью аппарата Voluson E10 (GE Healthcare, США), используя трансвагинальный датчик 9,0 МГц. При трансвагинальной эхографии органов малого таза вычисляли объем яичников и проводили подсчет антральных фолликулов, кроме этого оценивали состояние полости матки.
Проведен анализ данных анамнеза, параметров клинико-гормонального статуса пациенток, включенных в исследование, при этом выявлены характерные особенности в обеих группах больных.
При изучении данных анамнеза обращали внимание на перенесенные соматические заболевания, в том числе заболевания щитовидной железы, метаболические расстройства, инфекционно-воспалительные заболевания и другие. Обращали особое внимание на изучение наследственных факторов: возраст наступ-ление менопаузы и репродуктивный анамнез матери, особенности течения беременности и родов (воздействие факторов внешней среды, вредных привычек, стрессов, профессиональных вредностей и др.). Среди причин, приведших к развитию ПНЯ, пациентки наиболее часто отмечали стрессовые факторы (28,76%), хотя у большинства больных (71,24%) непосредственную причину возникновения заболевания установить не удалось.
При анализе жалоб у 100% пациенток 1-й группы (ПНЯ) выявлены вторичная олигоаменорея и бесплодие. К моменту проведения исследования средняя продолжительность аменореи у пациенток 1-й группы составила 2,7 года. Начало нарушений ритма менструаций пришлось на возраст 27,3 года. Кроме того, 19 (85,71%) пациенток предъявляли жалобы на приливы, преимущественно в ночное время, при этом у 4 из них вазомоторные симптомы не удавалось нивелировать даже с использованием среднеэффективных доз заместительной гормональной терапии (ЗГТ). Снижение либидо отмечали 13 (57,14%) пациенток. Каждая описанная выше жалоба значительно влияла на качество жизни женщин.
Основной жалобой пациенток с «бедным» ответом на стимуляцию функции яичников (2-я группа) было бесплодие. В связи с сохранностью ритма менструаций у всех больных данной группы жалоб, ассоциированных с дефицитом эстрогенов, не было. Несмотря на регулярность менструального цикла у пациенток этой группы, большинство из них отмечали укорочение межменструального интервала на 3—5 дней в течение последних 2—3 лет, а также уменьшение объема менструальной кровопотери. У пациенток с ПНЯ преобладало первичное бесплодие — у 13 (59,1%) из 22 со средней продолжительностью 3,2 года, в то время как пациентки с «бедным» ответом на стимуляцию функции яичников чаще предъявляли жалобы на вторичное отсутствие наступления беременности — 18 (64,3%) из 28 с более длительным анамнезом бесплодия (7,4 года).
Перед операцией всем пациенткам проводилось кариотипирование с использованием метода G-окраски для исключения хромосомных нарушений, а также изучение статуса гена FMR1 (количество CGG-повторов). Все пациентки, включенные в исследование, имели нормальный кариотип, а число CGG-повторов в гене FMR1 не доходило до уровня премутации.
Проведено исследование гормонального статуса у пациенток обеих групп. Базальный уровень ЛГ и ФСГ у больных с ПНЯ значительно превышал нормативные показатели для женщин репродуктивного возраста, составляя 24,71 и 52,4 МЕ/л соответственно. Концентрация Е2 у большинства пациенток находилась на уровне 73,4 пмоль/л и была значительно ниже нормативных показателей ранней фолликулярной фазы у женщин с регулярным менструальным циклом, при этом у одной из пациенток уровень Е2 не превышал 34 пмоль/л.
Сывороточные уровни гонадотропинов и Е2 у пациенток с «бедным» ответом на стимуляцию функции яичников находились в соответствующих референсных интервалах с периодическими эпизодами повышения концентрации ФСГ до 35 МЕ/л и последующим самопроизвольным снижением к очередному менструальному циклу.
Критерии включения в исследование: возраст до 42 лет, сниженный овариальный резерв (АМГ менее 0,5 нг/мл), минимум 2 эпизода «бедного» ответа на стимуляцию функции яичников при предыдущих попытках ЭКО, отсутствие операций на яичниках в анамнезе, отсутствие сопутствующих гинекологических заболеваний, а также отсутствие тяжелых форм патозооспермии, включая случаи получения спермы оперативным путем, нормальный кариотип.
Предоперационное гормональное лечение. Пациентки получали ЗГТ (эстрадиола валерат 2 мг + дидрогестерон 10 мг) в течение 2—3 менструальных циклов до операции с целью нормализации уровней гонадотропинов и Е2 и повышения эффективности комплексного лечения.
Показания к операции: бесплодие, сниженный овариальный резерв, настойчивое желание реализовать репродуктивную функцию с использованием собственных ооцитов, а также отсутствие эффекта от проводимого ранее лечения, включая методы ВРТ.
Всем обследованным после получения информированного добровольного согласия на участие в исследовании выполнено оперативное вмешательство в объеме: лапароскопия, ревизия органов брюшной полости и малого таза, биопсия коркового слоя обоих яичников с последующей его фрагментацией и одноэтапной реимплантацией в толщу яичника, гистероскопия, биопсия эндометрия, хромогидротубация.
Проводилась визуальная оценка яичников, маточных труб и матки, а также оценка состояния эндомет-рия с гистологической верификацией.
Макроскопическая картина ткани яичников: яичники уменьшены в размерах, белесовато-желтого цвета, несколько уплощенной формы с крупнобугристой поверхностью, плотной консистенции с утолщенной белочной оболочкой, глубокими бороздами и с некоторой анатомической асимметрией в пользу правого яичника, на разрезе — отсутствие признаков адекватной васкуляризации [12].
Техника операции (по собственной методике). На первом этапе определяли зоны биопсии яичниковой ткани [12, 14]. Далее проводили иссечение участка коркового слоя в верхнелатеральном полюсе обоих яичников максимально вдоль к поверхности органа. В условиях операционной в стерильном гаметном буфере специальным острым хирургическим инструментом выполняли микрохирургическую фрагментацию иссеченного участка коркового слоя яичника до размеров 1×1 мм (около 100 фрагментов). В это же время осуществляли формирование пространства между остаточной корой и мозговым веществом ипсилатерального яичника и создание ниши в мозговом веществе, в которую проводили одноэтапную реимплантацию фрагментированной ткани. Края разреза яичника ушивали с использованием ареактивного шовного материала. Затягивание швов выполняли до сопоставления краев раны, исключая ишемизацию ткани. При проведении описанного оперативного вмешательства не допускалось использование каких-либо хирургических энергий, кроме механической. Для гистологической верификации состояния яичниковой ткани, в том числе опосредованной оценки овариального резерва, исследовали 10—20% объема каждого фрагмента биоптата яичников. Все образцы ткани подвергались обработке согласно стандартному гистологическому протоколу [12].
Результаты
Проанализированы результаты комплексного лечения бесплодия, включающего вышеописанный хирургический этап у 50 пациенток с ПНЯ и «бедным» ответом на стимуляцию функции яичников. Оперативное лечение во всех случаях прошло без осложнений, продолжительность операции составила от 50 мин до 1,5 ч. Кровопотеря составила от 10 до 20 мл. На следующий день после операции пациенты отмечали улучшение общего самочувствия, психоэмоционального состояния, купирование вазомоторных симптомов, головных болей, что продолжалось на протяжении всего периода наблюдения. Выписку осуществляли на 2—5-е сутки после операции. В послеоперационном периоде проводили динамическое определение сывороточного уровня гонадотропинов, АМГ и Е2 на 3-и сутки после операции, а также на 2—3-й день в каждом менструальном цикле после операции в сочетании с ультразвуковой фолликулометрией.
Весь период послеоперационного наблюдения сопровождался ЗГТ.
При анализе данных гормонального исследования пациенток в послеоперационном периоде отмечены следующие изменения. У пациенток с ПНЯ после операции выявлено постепенное снижение уровня ФСГ, ЛГ с максимально низкими значениями на 3—4-й менструальный цикл после операции (уровень ЛГ снизился в 1,37 раза, ФСГ — в 1,97 раза), после условного плато продолжительностью в 2—3 менструальных цикла отмечалось достижение исходного уровня. Уровень Е2 после операции находился в пределах средних значений для ранней фолликулярной фазы менструального цикла (90 пг/мл), что, по-видимому, обусловлено применением ЗГТ. Обращает на себя внимание то, что на 3-и сутки после оперативного вмешательства отмечено резкое повышение уровня Е2, превосходящее базальные уровни в среднем в 3,56 раза. У пациенток с «бедным» ответом на стимуляцию функции яичников в первом менструальном цикле после операции зафиксировано практически двукратное увеличение уровня гонадотропинов, однако через 2—3 цикла после операции концентрация ФСГ и ЛГ достигала оптимальных значений для начала стимуляции функции яичников (средние значения ФСГ — 4,5—9,0 МЕ/л; ЛГ — 3,6—7,5 МЕ/л). Уровень Е2 у пациенток с «бедным» овариальным ответом на стимуляцию функции яичников изначально не являлся заниженным и оставался в пределах референсных значений (среднее значение 90 пг/мл). Существенных изменений в уровне АМГ у пациенток обеих групп не отмечено.
При проведении ультразвукового исследования в послеоперационном периоде выявлены следующие изменения. У больных с ПНЯ и «бедным» ответом на стимуляцию функции яичников после проведения оперативного лечения отмечалось увеличение числа антральных фолликулов практически в 2 раза. При ультразвуковой визуализации фолликулярный тип ПНЯ выявлен у 100,0% пациенток по сравнению с 85,71% до лечения, при этом среднее количество антральных фолликулов на яичник увеличилось практически в 2 раза, что свидетельствует об относительном улучшении показателей овариального резерва. Полученная динамика соотносилась со снижением уровней гонадотропинов более чем в 1,5 раза, при этом тенденция изменений ЛГ по сравнению с ФСГ менее выражена, что ранее описано в исследовании K. Kawamura и соавт. [13].
По данным гистологического исследования нами установлены морфометрические особенности яичниковой ткани у пациенток с бесплодием, ассоциированным со сниженным овариальным резервом [12].
Стимуляция функции яичников после оперативного лечения. К настоящему времени стимуляция функции яичников после оперативного вмешательства проведена 28 пациенткам (13 пациенткам с ПНЯ и 15 пациенткам с «бедным» ответом). Сроки овариальной стимуляции определялись согласно промежутку времени, прошедшему после операции, и достижению оптимальных сывороточных уровней гонадотропинов, а также ультразвуковой картине, свидетельствующей о наличии антральных фолликулов. Стимуляция функции яичников проводилась при достижении уровня ФСГ 25 МЕ/л и менее.
Выбор протокола стимуляции функции яичников. Независимо от выбранного протокола стимуляция функции яичников у пациенток с ПНЯ проводилась на фоне ЗГТ. Выбор протокола овариальной стимуляции обусловлен возрастом пациенток, анализом предшествующих попыток ЭКО, а также уровнями гонадотропинов, отмеченными на начало стимуляции. У пациенток с «бедным» ответом на стимуляцию функции яичников статистически значимо чаще использовали «короткий» протокол с антагонистами гонадотропин-рилизинг-гормона (ГнРГ) с применением человеческого менопаузального гонадотропина (чМГ) и рекомбинантных форм гонадотропинов со средней суточной дозой 225—300 МЕ. Средняя продолжительность стимуляции составила 12 дней. У пациенток с ПНЯ выбор протокола стимуляции функции яичников определялся уровнем ФСГ. При значении ФСГ более 20 МЕ/л предпочтительным оказалось использование «короткого» протокола с агонистами ГнРГ, что обеспечивало удержание оптимальных уровней ФСГ и ЛГ в течение периода стимуляции. Средняя продолжительность стимуляции пациенток в данной группе составила 17 дней со средними суточными дозами гонадотропинов 375—450 МЕ. При значении ФСГ менее 20 МЕ/л стимуляция функции яичников проводилась по «короткому» протоколу с антагонистами ГнРГ с применением средних доз гонадотропинов 375—400 МЕ/сут, длительностью 15—21 день. В отсутствие динамики фолликулярного роста при стимуляции функции яичников в течение 21 дня отменяли стимуляцию и назначали гестагены (дидрогестерон 10 мг × 2 раза в день) для индукции менструации. По достижению одним из фолликулов диаметра 18 мм для индукции финального дозревания ооцитов вводили триггер овуляции — хорионический гонадотропин человека из расчета 1500 МЕ на фолликул. Далее через 36 ч проводили трансвагинальную пункцию фолликулов и оплодотворение полученных ооцитов методом интрацитоплазматической инъекции сперматозоида (ИКСИ).
Из 28 пациенток с попытками стимуляции функции яичников после операции фолликулярный рост отмечен у 18 пациенток (у 6 с ПНЯ, у 12 с «бедным» ответом на стимуляцию функции яичников), ооциты получены у 17 пациенток — у 5 пациенток с ПНЯ и у 12 пациенток с «бедным» овариальным ответом на стимуляцию (суммарное количество полученных ооцитов составило — 39). В результате овариальной стимуляции получено 17 эмбрионов 5-суточных (суммарно), из них — перенесено в полость матки — 7, криоконсервировано и готово к переносу — 10.
В результате комплексного лечения бесплодия с использованием одноэтапного хирургического метода активации функции яичников к настоящему моменту наступило 4 беременности (исследование продолжается).
У одной из пациенток 32 лет с биохимической формой ПНЯ спустя 1,5 месяца после операции наступила самопроизвольная беременность двойней, протекающая без каких-либо осложнений на протяжении всего периода гестации. Плановое оперативное родоразрешение проведено 1 октября текущего года при сроке беременности 37 недель 4 дня. Операция прошла без осложнений. Продолжительность операции 33 мин. На 2-й минуте за паховые сгибы извлечена живая доношенная девочка массой 2 620 г, длиной 49 см, оценка состояния по шкале Апгар 8/9 баллов. На 3-й минуте за подмышечные впадины извлечен живой доношенный мальчик массой 2332 г, длиной 47 см, оценка состояния по шкале Апгар 8/8 баллов. Кровопотеря составила 600 мл. Послеродовый период протекает без особенностей.
У пациентки 37 лет с «бедным» ответом на стимуляцию функции яичников наступила беременность в результате проведения программы ЭКО в естественном цикле. При этом пациентке в послеоперационном периоде проведено 2 цикла стимуляции функции яичников с получением 1 и 4 ооцитов соответственно. Однако перенос эмбриона в полость матки в данных стимулированных циклах не привел к наступлению беременности.
У пациентки 31 года с ранней классической формой ПНЯ в послеоперационном периоде проведено более 5 циклов стимуляции функции яичников с получением суммарно 3 бластоцист хорошего качества. Перенос эмбрионов осуществлялся в рамках криопротоколов ЭКО с наступлением двух биохимических беременностей.
Предварительные результаты, полученные в ходе настоящего исследования, показывают эффективность одноэтапного хирургического метода активации функции яичников как с позиции улучшения общего самочувствия, изменения психоэмоционального фона, динамики гормонального статуса, увеличения количества антральных фолликулов, получения собственного клеточного материала (ооцитов, эмбрионов) в циклах ЭКО, так и достижения беременности у ряда пациенток (исследование продолжается).
Заключение
В статье приведены результаты исследования 50 пациенток, страдающих бесплодием, в основе которого лежит снижение овариального резерва, ассоциированное с преждевременной недостаточностью яичников и «бедным» ответом на стимуляцию функции яичников. Все указанные пациентки обследованы, и в течение длительного времени им проводилось лечение бесплодия, в том числе и многократно предпринимались попытки экстракорпорального оплодотворения. К моменту включения в настоящее исследование выявлены изменения в гормональном профиле (критически низкие значения сывороточного уровня антимюллерова гормона у большинства больных и эстрадиола у пациенток с преждевременной недостаточностью яичников, высокие базальные уровни гонадотропинов у пациенток с преждевременной недостаточностью яичников) и в параметрах ультразвукового исследования (снижение количества или отсутствие антральных фолликулов, уменьшение объема, отсутствие эхографических признаков функциональной активности яичников). В связи с данными клинико-лабораторного исследования всем пациенткам рекомендована донация ооцитов как единственно возможный вариант достижения беременности, что и явилось показанием к оперативному лечению.
В результате разработанной нами тактики ведения, включающей клинико-лабораторное и инструментальное обследование, гормональную подготовку, а также хирургический этап — одноэтапный хирургический метод активации функции яичников, отмечено улучшение общего самочувствия, психоэмоционального фона у ряда пациенток, изменение показателей овариального резерва, а именно положительная динамика гормонального статуса, сопряженная с активацией фолликулярного роста по данным ультразвукового исследования, ответом на стимуляцию функции яичников в циклах экстракорпорального оплодотворения с получением собственного клеточного материала и достижением беременности у ряда пациенток (исследование продолжается). Проведенное исследование позволяет считать данную операцию целесообразной для выполнения у пациенток с выраженным снижением овариального резерва как альтернативу донации ооцитов.
Выражаем благодарность за консультативную помощь профессорам Kazuhiro Kawamura и Aaron J. Hsueh.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
